Эффекторные механизмы врожденного иммунитета
Общие положения
Определение 1
Врожденный, или неспецифический иммунитет является более ранним механизмом защиты организма, как по времени ответа, так и в эволюционном плане.
Иммунный ответ при врожденном иммунитете развивается в первые несколько часов или дней после контакта с патогенным антигеном. Большая часть патогенов запускают механизмы врожденного иммунитета до развития иммунного ответа с присутствием лимфоцитов.
Организм-хозяин обладает различными механизмами врожденного иммунитета, эффективность которого при повторном контакте с возбудителем инфекции не возрастает.
Основную роль в механизмах неспецифической защиты организма играют:
- система комплемента,
- первичные рецепторы для патогенов,
- фагоцитоз, интерфероны (факторы защиты от вирусов),
- пептиды-антибиотики.
Барьеры против инфекций
От внедрения болезнетворных микроорганизмов, чужеродных клеток, организм защищают:
- кожа,
- секрет слизистых оболочек,
- движение ресничек эпителия,
- смывающий эффект и антибактериальное действие выделяемых жидкостей,
- нормальная микрофлора.
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Бактерия, внедрившаяся в организм, разрушается под действием лизоцима и подвергается дальнейшему фагоцитозу с последующим уничтожением фагоцитарными клетками.
К основным фагоцитарным клеткам относятся:
- полиморфноядерные нейтрофилы,
- мононуклеарные макрофаги.
Фагоцитарные клетки имеют рецепторы, способные распознавать на поверхности клеток патогенных микроорганизмов определенные молекулярные структуры. Вследствие этого фагоцит может связываться с микробной клеткой.
Компоненты микробных клеток распознают трансмембранные белки $TLR$ (Toll-подобные рецепторы. Их активация инициирует секрецию провоспалительных цитокинов.
По завершении фагоцитоза в действие вступают разнообразные бактерицидные механизмы:
- образуются реакционноспособные метаболиты кислорода;
- из гранул высвобождаются многочисленные кислород-независимые факторы;
- синтезируется оксид азота.
Привлечению фагоцитов к микробным клеткам и осуществлению фагоцитоза способствует активация по каскадному механизму многокомпонентной системы комплемента.
Комплемент выполняет ряд функций:
- микроорганизмы, покрытые белком $C_3b$, связываются с рецептором для $C_3b$ ($CR_1$) на оверхности фагоцитарных клеток, что способствует фагоцитозу;
- белок $C_5a$ оказывает активирующее и хемотаксическое воздействие на нейтрофилы, аналогично белки $C_3a$ и $C_5a$ воздействуют на эозинофилы, эти белки значительно повышают проницаемость капилляров;
- встраивание ЛМК в мембрану микробной клетки вызывает ее лизис;
- фрагмент $C_3b$ способствует продукции антител В-клетками.
Острая воспалительная реакция с участием комплемента
Активация комплемента участвует в следующих процессах:
- обеспечивает привлечение и стимуляцию нейтрофилов; приток полиморфноядерных лейкоцитов и повышение сосудистой проницаемости приводят к развитию острой воспалительной реакции, которая способна оказывать сильный антимикробный эффект;
- индуцирует экспрессию молекул адгезии на эндотелиах клетках, которые обеспечивают адгезию лейкоцитов и способствуют их проникновению между эндотелиальными клетками в очаг воспаления;
- активированные пептидом $C_5a$ фагоцитарные клетки, поглощают и уничтожают внедрившиеся в организм микробы;
- активированные пептидом $C_5a$ или компонентами микробных клеток тканевые макрофаги также могут инициировать воспаление, например, эндотоксином.
Гуморальные механизмы защиты
Гуморальные механизмы обеспечивают вторую линию защиты.
К факторам гуморальной защиты относятся:
- лизоцим;
- дефензины;
- система комплемента;
- белки острой фазы (С-реактивный белок, манносвязывающий лиганд);
- интерфероны (их регулярный эффект приводит к подавлению размножения вирусов);
- коллектины связываются с углеводными структурами на поверхности микробных клеток и с рецепторами фагоцитарных клеток, способствуя фагоцитозу.
Внеклеточное уничтожение микробов
Замечание 1
Клетки-киллеры (НК-клетки) обладают рецепторами, активирующими их цитотоксическую функцию, а также доминантными ингибиторными рецепторами, распознающими молекулы главного комплекса гистосовместимости класса I на поверхности не инфицированных и не измененных клеток.
НК-клетки разрушают инфицированные вирусами клетки. Вызывая запрограммированную клеточную гибель – апоптоз. Апоптоз может быть индуцирован или цитотоксическим эффектом перфорина и гранзимов, или взаимодействием лиганда Fas клеток-киллеров с рецептором Fas клеток-мишеней.
Внеклеточное уничтожение паразитов осуществляют эозинофилы, связываясь через свои $C_3b$-рецепторы с их поверхностью, покрытой $C_3b.$ Благодаря этому многие крупные паразиты, инвазирующие потенциально восприимчивый организм-хозяин, не вызывают заболевания.
Источник
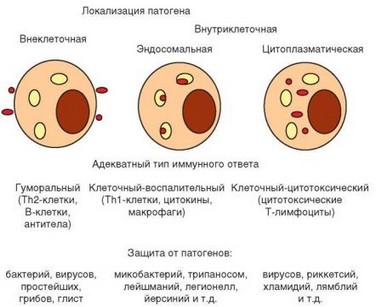
Особенности развития иммунного ответа определяются природой и локализацией патогенов. Существует 3 главные стратегии адаптивного иммунитета в отношении внутриклеточных и внеклеточных патогенов (рис. 1.7). Наиболее разнообразные эффекторные механизмы задействованы в защите от внеклеточных патогенов, при которой преобладает гуморальный иммунный ответ. Основные эффекторные молекулы при этом — антитела, секретируемые плазматическими клетками, дифференцирующимися из В-лимфоцитов при участии Th2-клеток.
Антитела способны связываться с антигенами, представленными как на клеточной мембране, так и в свободной растворимой форме. Прямое защитное действие антител в отношении свободных антигенов проявляется в нейтрализации их биологической активности (наиболее характерный пример — нейтрализация токсинов). В отношении антигенов, связанных с мембраной патогена, нейтрализующее действие антител проявляется в изменении биологической активности микроорганизма, например, в подавлении его подвижности или способности к адгезии на клетках хозяина, в предотвращении инфицирования вирусом клетки и т.д.
Более универсальны защитные механизмы, реализуемые антителами с участием других факторов или клеток. Главный из них — опсонизация — покрытие клеток молекулами иммуноглобулинов, облегчающими их распознавание и поглощение фагоцитами, которые имеют на мембране рецепторы для «хвостовой» части антител (Fc-рецепторы). Опсонизация значительно ускоряет фагоцитоз патогенов. Другой механизм защитного действия антител состоит в активации комплемента по классическому пути. Комплекс «антиген—антитело» связывает сывороточный фактор C1q, что вызывает каскадную активацию других компонентов комплемента. Этот процесс имеет

Рис. 1.7. Стратегия иммунной защиты зависит от локализации патогена
2 основных эффекта. Первый и главный из них — опсонизация клеток, но не антителами, а продуктами расщепления С3-компонента — C3b. Фагоциты имеют рецепторы к фрагментам С3 компонента и легко распознают опсони- зированный патоген. Второй результат, опосредующий защитный эффект комплемента, — цитолиз клетки за счет формирования мембраноатакующего комплекса. Кроме того, имеющие Fc-рецепторы естественные киллеры распознают опсонизированную антителами клетку и вызывают ее лизис по контактному механизму. Наконец, антитела облегчают распознавание патогенов макрофагами, имеющими высокоаффинные Fc-рецепторы, что резко усиливает защитные свойства этих клеток.
Защита от другой разновидности внеклеточных патогенов — макропаразитов (гельминтов) также осуществляется по ^2-зависимому механизму. Однако в этом случае наибольшую роль играют эозинофилы, привлекаемые цитокинами, которые секретируют ^2-лимфоциты и тучные клетки. Эозинофилы располагаются по поверхности паразита и выделяют содержащиеся в их эозинофильных гранулах высокоактивные белки, убивающие паразитов.
Антитела не способны проникнуть внутрь клеток и фактически бессильны против патогенов, имеющих внутриклеточную локализацию. Для защиты от внутриклеточных патогенов иммунная система имеет 2 стратегии. Как уже упоминалось, TM-клетки активируют макрофаги. При взаимодействии этих клеток ТЫ-лимфоцит получает дополнительный стимул через TCR, а макрофаг — через действие IFNy и костимулирующую молекулу CD40. Этот
«диалог» приводит к дополнительной активации макрофагов, в частности, к повышению бактерицидной активности этих клеток и формированию нового фактора — оксида азота и его производных (благодаря экспрессии макрофагами индуцибельной NO-синтазы). Это стимулирует разрушенние внутриклеточных патогенов, резистентных к действию факторов врожденного иммунитета до подключения Т-хелперов.
Таким образом, в данном случае истинными эффекторами становятся клетки врожденного иммунитета — макрофаги, завершающие элиминацию патогенов, поглощеных ими путем фагоцитоза. Только стимулирующие сигналы, поставляемые ТЫ-клетками, позволяют реализовать этот способ защиты от внутриклеточных (поглощенных, но не разрушенных) патогенов. В процессе иммунного ответа возникает еще одна разновидность индуцируемых Т-хелперов — Th17 (названы по доминирующему продукту — IL-17). Они привлекают нейтрофилы и реализуют свои эффекты, активируя эти клетки. В то же время их действие часто переходит в область патологии, выражающийся в развитии аутоиммунных процессов.
Другая стратегия борьбы с внутриклеточными патогенами направлена на элиминацию локализующихся в цитозоле патогенов (микоплазмы, лямблии и т.д.) или вирусов, геном которых интегрируется в геном клетки. Если в основе предыдущего механизма лежит усиление активности эффекторных клеток врожденного иммунитета, позволяющее им «излечиться» от патогена, то в данном случае иммунная система выбирает более радикальный путь — убивает инфицированную клетку вместе с патогеном (убитая клетка затем фагоцитируется). Функцию киллеров выполняют цитотоксические СD8+ Т-лимфоциты, отличающиеся от естественных киллеров не столько механизмом цитолиза, сколько специфичностью: прежде чем убить клетку, цитотоксический Т-лимфоцит должен распознать антигенный пептид патогена, выносимый на поверхность клетки-мишени в составе молекул MHC-I. Такой же механизм иммунная система использует при борьбе с опухолевыми клетками и при отторжении чужеродного трансплантата. Он же может участвовать в развитии аутоиммунной патологии (сахарный диабет I типа и др.).
Сопоставляя эффекторные механизмы врожденного (реализуемые на первой линии защиты) и адаптивного иммунитета (формируются в ходе иммунного ответа), следует отметить их сходство; при адаптивном ответе они незначительно модифицируются. Действительно, и во врожденном, и в адаптивном иммунитете используется киллинг патогенов или инфицированных клеток, регулируемый цитокинами или антителами. Таким образом, под влиянием факторов адаптивного иммунитета фагоцитоз интенсифицируется и становится более целенаправленным. Т-киллеры действуют подобно натуральным киллерам, но спектр их мишеней ограничен специфичностью их рецепторов, т.е. Т-киллеры действуют более избирательно. Внеклеточный цитолиз, осуществляемый эозинофилами, при адаптивном ответе проявляется локально благодаря выработке цитокинов, привлекающих эозинофилы к гельминтам. Наконец, реакции комплемента, активируемого через альтернативный и классический пути, приводят к одинаковым результатам, но включаются по антигенспецифическому механизму только во втором случае. Иными словами, адаптивный иммунитет использует

Рис. 1.8. Взаимосвязь врожденного и адаптивного иммунитета. Врожденный иммунитет обеспечивает презентацию антигена и костимуляцию, необходимые для запуска адаптивного иммунитета. В свою очередь, адаптивный иммунитет благодаря выработке антител и цитокинов придает реакциям врожденного иммунитета избирательность действия и повышает их эффективность
эффекторные механизмы врожденного иммунитета, придавая им специфичность и усиливая их путем контактных межклеточных взаимодействий и стимулирующего действия цитокинов (рис. 1.8).
Источник
Общие положения
Эффекторные механизмы иммунитета заключаются в следующем: $TCR$ на поверхности $T$-лимфоцита или иммуноглобулины в растворе доставляют связанный антиген к специально предназначенным для его расщепления клеткам или ферментам.
Антиген расщепляется до мелких продуктов обмена, от которых организм может избавиться самостоятельно через собственные системы выделения.
Существуют следующие типы эффекторных механизмов:
Гуморальный, или антителозависимый иммунитет. Обеспечивается гуморальными факторами, антителами, которые связывают антиген и способствуют его удалению через ряд механизмов:
- агглютинация,
- преципитация,
- нейтрализация, блокада,
- лизис,
- опсонизация.
Клеточный, или опосредованный клетками иммунитет. Осуществляется клетками иммунной системы: $T$-лимфоцитами, активированными макрофагами, $NK$-клетками, разрушающими чужеродные клетки, клетки, инфицированные вирусами или внутриклеточными патогенами клетки опухолевые клетки.
Гуморальный иммунитет
Определение 1
Гуморальный иммунитет – это иммунитет, обеспечивающийся специфическими антителами. Антитела являются основными эффекторными молекулами.
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Антитела вырабатываются в периферической лимфоидной ткани плазматическими клетками. Плазматические клетки возникают в результате пролиферации и дифференцировки В-клеток, активированных антигеном
Гуморальный иммунитет можно перенести с помощью специфических антител или с помощью специфической сыворотки.
Замечание 1
Гуморальный иммунитет – главный способ защиты от бактериальных инфекций.
Основу защитных эффектов составляет реакция антиген-антитело. В следствие этой реакции происходит:
- Нейтрализация внеклеточных вирусов и токсинов (растительные, бактериальные, химические и биологические). Присоединение антитела к вирусу замедляет его попадание в клетку. Антитело присоединяется около активного центра токсина. Оно блокирует взаимодействие токсина с субстратом стереохимически или в следствие конформационных аллостерических изменений.
- Образование агглютинатов и преципитатов. Агглютинат образуется при взаимодействии с корпускулярными антигенами, а преципитат – вследствие взаимодействия антител с растворимыми антигенами.
- Опсонизация и элиминация патогенов. Связываясь со специфическим антителом, патоген становится более доступным для фагоцитоза макрофагами и полиморфноядерными лейкоцитами. Это становится возможным в результате взаимодействия на поверхности фагоцита Fc-фрагмента иммуноглобулина с Fc-рецептором.
- Активация белков системы комплемента, которые могут проявляться в качестве хемотаксических факторов, опсонинов, белков с литической активностью.
- Бактериолиз и цитолиз клеток-мишеней.
Клеточный иммунитет
Определение 2
Клеточный иммунитет – это иммунитет, опосредованный деятельностью клеток.
Это основной способ защиты от:
- внутриклеточных вирусов, бактерий, грибов;
- чужеродных тканей и клеток, измененных клеток собственного организма.
Клеточный иммунитет – основа опухолевого и трансплантационного иммунитета.
В реализации и развитии клеточной формы защиты принимают участие:
- $T$-лимфоциты – основные эффекторы;
- Макрофаги;
- $NK$-клетки.
Защитное действие клеточных иммунных реакций проявляется:
- во внутриклеточном переваривании бактерий;
- в цитотоксическом действии на клетки-мишени иммунокомпетентных клеток.
Клетками-мишенями выступают
- клетки, инфицированные вирусом;
- аллогенные клетки;
- опухолевые клетки;
- клетки трансплантата.
Переваривание бактерий происходит в следствие активации инфицированных клеток факторами, которые продуцируются Т-клетками воспаления, стимулированными антигеном. В результате активации в макрофагах интенсивно образуются фаголизосомы, инициируется метаболический взрыв с образованием соединений, обладающих выраженной бактерицидностью.
Замечание 2
При комплексном воздействии этих факторов инфицированные клетки «очищаются» от бактерий.
Источник
Глава 8. ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ ИММУНИТЕТА
Эффекторные механизмы иммунитета состоят в том, что TCR на поверхности T-лимфоцита и/или иммуноглобулины в растворе физически доставляют связанный антиген к таким клеткам или ферментам, специально предназначенным для расщепления антигена до мелких метаболитов, от которых организм может избавиться через свои системы выделения (почки, пищеварительный тракт).
В соответствии с двумя типами антигенсвязывающих рецепторов выделяют 2 типа эффекторных механизмов.
• Антителозависимый, или гуморальный иммунитет. Осуществляется за счет гуморальных (растворимых) факторов — антител, связывающих антиген и удаляющих его через ряд механизмов: преципитацию, агглютинацию, нейтрализацию, лизис, блокаду и опсонизацию.
• Опосредованный клетками (антителонезависимый), или клеточный иммунитет. Клеточный иммунитет реализуется за счёт клеток иммунной системы, в первую очередь Т-лимфоцитов, а также активированных макрофагов и NK-клеток, непосредственно разрушающих генетически чужеродные клетки, инфицированные вирусами и другими внутриклеточными патогенами клетки, и опухолевые клетки.
АНТИТЕЛОЗАВИСИМЫЕ МЕХАНИЗМЫ ЗАЩИТЫ
Опсонизация и запуск системы комплемента
Само по себе связывание антител с антигеном является защитным, по крайней мере, в двух случаях:
• если антиген — сильный яд, то антитело при связывании нейтрализует его токсичность;
• если антиген представлен на поверхности патогена (вирус, прион, бактерия), то антитело, связав его, препятствует распространению патогена в организме.
Однако и в этих случаях защитная реакция не заканчивается образованием макромолекулярных комплексов антиген-антитело. Эти комплексы необходимо расщепить до мелких метаболитов. Для этого антитела фиксируют и активируют компоненты комплемента (IgM > IgG3 > IgG1). Комплексы антиген-антитело-компоненты комплемента транспортируются эритроцитами, имеющими рецепторы для компонентов комплемента, в синусоиды селезёнки и печени, где их фагоцитируют и расщепят макрофаги.
Fc-рецепторы
FcR — мембранные молекулы, специфически связывающие Fc-фрагменты иммуноглобулинов. Их (наряду с TCR и BCR) можно отнести к иммунорецепторам, так как клетка-носитель FcR способна связать антиген (пусть и посредством антител) и отвечать на него. FcR присутствуют не толко на лимфоцитах, но и на всех известных лейкоцитах.
Типы и разновидности FcR. По изотипу связываемых тяжёлых цепей иммуноглобулинов выделяют 4 разновидности FcR: γ, ε, α, μ; а по аффинности связи с лигандом — 3 типа FcR: I, II и III. FcR типа I способны связывать свободные молекулы антител (это особенно характерно для IgE), FcR типов II и III — только комплексы антиген-антитело.
Антителозависимая клеточная цитотоксичность
Феномен антителозависимой клеточной цитотоксичности (АЗКЦТ) имеет место, когда антитело связывает антиген на по-
верхности какой-либо клетки-мишени и через Fc-фрагмент привлекает для её разрушения эффекторные клетки (NK-клетки, макрофаги, эозинофилы и др.).
• Естественные киллеры. NK-клетки имеют рецептор (FcγRIII) для Fc-фрагментов IgG. Механизм собственно киллерного действия NK на клетку-мишень такой же, как и киллерный механизм ЦТЛ — перфорин-гранзимовый (см. рис. 1-4 и рис. 6-4).
• Эозинофилы. Механизм санации от гельминтов — это тоже антителозависимая клеточная цитотоксичность (АЗКЦТ), где в качестве эффекторных клеток выступают эозинофилы, имеющие низкоаффинные рецепторы для IgE — FcεRII и для IgA — FcaRII. Связывание этих рецепторов с лигандами в сочетании с сигналом от цитокина ИЛ-5 стимулирует синтез и секрецию эозинофилом высокотоксичных белков, направленных на уничтожение гельминтов. Другими словами, активированный эозинофил секретирует ряд биологически активных веществ, свойства которых объясняют симптоматику так называемых эозинофильных воспалительных процессов (табл. 8.1).
Таблица 8-1. Биологически активные продукты эозинофилов
Гиперчувствительность немедленного типа
Сосудистые и миоконстрикторные реакции, опосредованные медиаторами тучных клеток и базофилов, приводят к развитию гиперчувствительности немедленного типа (ГНТ).
Базофильные лейкоциты и тучные клетки. В этих реакциях антитела вовлекают в ответ базофилы и тучные клетки. Существенные функциональные признаки этих клеток схожи: наличие на мембране высокоаффинного рецептора для IgE (FcεRI) и одинаковый набор биологически активных медиаторов.
• Тучные клетки локализованы в соединительной ткани собственного слоя слизистых оболочек, в подкожной соединительной ткани и соединительной ткани, расположенной по ходу всех кровеносных сосудов. Выделяют, по крайней мере, 2 тканевые разновидности тучных клеток.
— Тучные клетки слизистой оболочки из сериновых протеаз экспрессируют триптазу и химазу, секретируют минимум гистамина; из протеогликанов в них преобладает хондроитинсульфат; из метаболитов арахидоновой кислоты — лейкотриен C4 (LTC4). По-видимому, дифференцировка этих клеток зависит от T-лимфоцитов, а именно от местной стимуляции клеток-предшественников цитокином ИЛ-3.
— Тучные клетки соединительной ткани локализованы в серозных оболочках полостей тела и в лёгких. Из сериновых протеаз экспрессируют преимущественно триптазу, из протеогликанов — гепарин, секретируют много гистамина, из метаболитов арахидоновой кислоты в них преобладает простагландин D2. Дифференцировку этих тучных клеток стимулируют фибробласты.
• Базофилы циркулируют в крови и мигрируют в ткани только в очаг воспаления (как нейтрофилы). На базофилах экспрессированы молекулы адгезии, важные для хоминга в очаг: LFA-1 (CD11a/CD18), Mac-1 (CD11b/CD18), CD44.
Активация. Сигналы, активирующие и тучные клетки, и базофилы.
• Гомотипная агрегация FcεRI (активируются комплексом IgE с антигеном или антителами к рецептору); FcεRI способен связывать свободные IgE-антитела (до того как они свяжут свой антиген). Клетки с комплексом IgE-FcεRI на мембране находятся в состоянии готовности в считанные секунды и минуты осуществить дегрануляцию в ответ на распознавание поступившего антигена (рис. 8-1).
• Анафилатоксины — активированные компоненты комплемента (C5a > C4a > C3a).
• Медиаторы из активированных нейтрофилов.
• Нейромедиаторы (норадреналин, вещество Р).
Медиаторы тучных клеток и базофилов различны по биохимическим свойствам, предназначению и срокам выброса из активированной тучной клетки. Медиаторы, депонируемые в гранулах, первыми выбрасываются из клетки в ответ на активирующий сигнал. Другие медиаторы синтезируются de novo и вступают в процесс позже.
• Гистамин. На разных клетках есть различные рецепторы для гистамина — Н1, Н2 и Н3. Гистамин проявляет различные вазоактивные эффекты: эндотелиальные клетки претерпевают

Рис. 8-1. Дегрануляция тучных клеток. На поверхности тучных клеток молекулы IgE связаны Fc-рецепторами. Антиген взаимодействует с Fab-фрагментами IgE. Активированная этим сигналом тучная клетка подвергается дегрануляции
констрикцию, и сыворотка выходит из сосуда в ткани; гистамин стимулирует синтез в клетках эндотелия простациклина и радикала оксида азота (NO), вызывающих расслабление гладких мышц сосудистой стенки и, следовательно, вазодилатацию.
— Если процесс происходит в коже, то клинически он проявляется в виде волдырей и покраснения (крапивница). В случае аллергической патологии снять симптомы помогают лекарственные средства — блокаторы Н1-рецепторов гистамина.
— Если гистамина выделяется достаточно много, то он вызывает клинически значимые сокращения гладких мышц кишки (перистальтику) и бронхов (бронхоспазм), однако этот эффект непродолжителен, поскольку гистамин быстро распадается во внеклеточной среде.
• Липидные медиаторы. При стимуляции тучных клеток в них активируются ферменты метаболизма липидов, а именно фосфолипаза А2. Этот фермент использует в качестве субстратов фосфолипиды клеточных мембран и липиды (в первую очередь арахидоновую кислоту). В результате образуются биологически активные медиаторы.
— Простагландин D2— действует как вазодилататор и бронхоконстриктор. В биосинтезе простагландина D2 из арахидоновой кислоты участвует циклооксигеназа. Фармакологическими ингибиторами этого фермента служат ацетилсалициловая кислота и другие НПВС.
— Лейкотриены (LTC4, LTD4, LTE4) — альтернативные продукты метаболизма арахидоновой кислоты, образуемые под воздействием 5-липооксигеназы. Комплекс лейкотриенов — медленно реагирующий компонент анафилаксии. Именно этот комплекс медиаторов в наибольшей мере ответственен за бронхоконстрикцию при бронхиальной астме. Это объясняет усугубление астматических приступов ацетилсалициловой кислотой: блокируя синтез простагландина D2, ацетилсалициловая кислота высвобождает метаболический шунт арахидоновой кислоты в пользу лейкотриенов.
— Фактор активации тромбоцитов (ФАТ) вызывает бронхоконстрикцию, а также релаксацию гладких мышц сосудов и ретракцию эндотелия. ФАТ продуцируют не только (а может
быть и не столько) тучные клетки, сколько клетки эндотелия, стимулированные гистамином и лейкотриенами.
— Ферменты тучных клеток и базофилов [сериновые протеазы (триптаза и химаза), катепсин G, карбоксипептидаза] способствуют перестройке матрикса соединительной ткани.
— Цитокины тучных клеток и базофилов. К ним относят интерлейкины, GM-CSF и др.
Гиперчувствительность немедленного типа (ГНТ). Цитокины тучных клеток и базофилов поддерживают иммунное отклонение в дифференцировке субпопуляций CD4+ T-лимфоцитов в пользу Th2 (ИЛ-4, ИЛ-13), а также поддерживают дифференцировку и активацию эозинофилов (ИЛ-5, ИЛ-3, GM-CSF). В случае патологии именно эти клетки (Th2, тучные клетки, базофилы, эозинофилы) и IgE составляют самоподдерживающийся ансамбль, ответственный за реакции ГНТ. Мишени для цитокинов — клетки гладкой мускулатуры и эндотелия (следовательно, сосуды, бронхи, органы пищеварения). Системная реакция ГНТ — анафилактический шок (АШ).
Реликтовые свойства антител
Помимо связывания антигенов, компонентов комплемента и FcR, молекулы иммуноглобулинов имеют ещё несколько свойств (видимо, унаследованных от каких-то предковых белков).
• Каталитическая (пептидазная) активность — в некоторых случаях антитела сами расщепляют специфичный антиген, функционируя как протеазы.
• Способность связывать нуклеотиды выявлена у доменов VL и VH: пуриновое кольцо связывается с остатками триптофана и тирозина. При этом связи с нуклеотидами могут не мешать связыванию антигена в антигенсвязывающем центре. Некоторые антитела, связывающие нуклеиновые кислоты, обладают способностью расщеплять полинуклеотиды (ДНКазная активность).
• Способность связывать металлы (например, ртуть, цинк, свинец). Это свойство антител может иметь отношение к патогенезу заболеваний: антитела, связывая жизненно необходимые ионы металлов-микроэлементов, вызывают дефицит этих металлов во внутренней среде. Подобные предположения воз-
никли в отношении склеродермии и антител, связывающих свинец.
• Способность связывать суперантигены. Свойства суперантигенов для иммуноглобулинов описаны для трёх веществ: белка А стафилококка (SpA), gp120 ВИЧ-1 и кишечного сиалопротеина. Один такой суперантиген может связать более 80% всех иммуноглобулинов крови, при этом иммуноглобулин теряет способность связывать свой специфический антиген. Считают, что таков один из компонентов патогенеза иммунодефицита при ВИЧ-инфекции.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ, ОПОСРЕДОВАННЫЕ КЛЕТКАМИ
Антителонезависимые эффекторные механизмы иммунитета в первую очередь реализуют ЦТЛ. К ним в основном относят CD8+ Tαβ-лимфоциты и NKT-клетки (лимфоциты, одновременно экспрессирующие рецепторы NK- и Т-клеток). Есть T-киллеры и среди Tγδ-лимфоцитов.
Главное назначение ЦТЛ — санация организма от внутриклеточных патогенов, опухолевых и других изменённых клеток, реализуемая киллерной функцией ЦТЛ и цитокинами.
• Киллерная функция. ЦТЛ осуществляют киллерную функцию (см. рис. 1-4 и рис. 6-4) с помощью особых белков — цитотоксинов, к которым относят перфорин, гранзимы и недостаточно изученный цитолизин.
— Синтез цитотоксинов происходит de novo после вовлечения ЦТЛ в иммунный ответ и распознавания ими специфического антигена.
— Накопление цитотоксинов. В виде функционально неактивных молекул-предшественников цитотоксины накапливаются в гранулах, которые сконцентрированы вблизи TCR.
— Дегрануляция ЦТЛ происходит в области межклеточного контакта, образующегося при связывании TCR с антигеном на поверхности клетки-мишени. Этот процесс облигатно зависит от Ca2+.
— Перфорин накапливается в гранулах в виде растворимого предшественника. При высвобождении из гранул и в при-
сутствии Ca2+ перфорин быстро полимеризуется в мембране клетки-мишени, образуя цилиндрическую структуру. При этом липофильные участки молекул перфорина ориентируются в сторону клеточной мембраны, а гидрофильные — в сторону канала внутрь клетки. В результате образуется пора диаметром около 16 нм.
— Гранзимы и апоптоз. Через пору, образованную перфорином, внутрь клетки-мишени попадают выделенные ЦТЛ гранзимы. Охарактеризовано 3 гранзима ЦТЛ — А, В и С. Это специализированные сериновые протеазы, субстратами которых служат ферменты, инициирующие в клеткемишени программу апоптоза. При этом происходит разрушение ДНК и белков не только клетки, но и инфицировавшего её вируса.
— Лизис мишени. Если в механизмах апоптоза клетки-мишени есть какие-либо дефекты, ЦТЛ всё равно разрушает клетку — путём осмотического лизиса через сформированные перфорином поры. Однако в этом случае неповреждённые вирусные частицы и нуклеиновые кислоты могут инфицировать другие клетки, что и происходит в случае некоторых инфекций.
• Цитокины. CD8+ ЦТЛ продуцируют цитокины — ИФНγ, ФНОα и ФНОβ (лимфотоксин). В частности, ИФНγ проявляет следующие эффекты:
— непосредственно подавляет репликацию вирусов;
— индуцирует в клетках-мишенях повышенную экспрессию молекул MHC-I и MHC-II, способствуя более эффективной презентации вирусных антигенов T-лимфоцитам (и для распознавания, и для киллинга);
— активирует макрофаги и NK-клетки;
— наконец, ИФНγ — кофактор индукции дифференцировки наивных CD4+ T-лимфоцитов в Th1-клетки, а последнее означает, что CD8+ ЦТЛ вносят вклад в развитие других эффекторных механизмов иммунного ответа (с участием Th1-лимфоцитов).
ГИПЕРЧУВСТВИТЕЛЬНОСТЬ
ЗАМЕДЛЕННОГО ТИПА
Гиперчувствительность замедленного типа (ГЗТ) — воспаление тканей, «организуемое» CD4+ T-лимфоцитами субпопуляции Th1 — продуцентами ИФНу. Клетками-исполнителями служат активированные макрофаги. Если макрофаг в очаге инфекции активирован при взаимодействии с CD4+ Th1-лимфоцитом, то микробицидные возможности макрофага существенно увеличиваются и активированный макрофаг с большей вероятностью разрушит патогены (к сожалению, в макрофаге погибают не все патогены, особенно жизнеспособны вирусы, например, ВИЧ, а также микобактерии).
Активация макрофага. Для активации макрофага необходимы 2 типа воздействия со стороны лимфоцитов:
• контактное — молекула CD40L на Th1-лимфоците вступает в связь с молекулой CD40 на макрофаге;
• цитокиновое — ИФНγ, продуцируемый Th1-клеткой, CD8+ ЦТЛ или NK-клеткой, связывает рецептор на макрофаге;
• инфицированный макрофаг имеет больше шансов вступить во взаимодействие с Th1-клеткой, обусловленное распознаванием Т-клеткой антигена на поверхности макрофага. В результате именно этот макрофаг получит активирующие сигналы от Т-клетки через интерферон и CD40L.
Ингибитор активации макрофагов — ИЛ-10.
Характеристики активированного макрофага. Макрофаг, активированный взаимодействием с Th1-клеткой, приобретает следующие признаки и функциональные способности.
• Увеличивается число рецепторов FcγR,припомощикоторых макрофаг связывает комплексы антиген-антитело и фагоцитирует их.
• ИФНу в макрофагах индуцирует биосинтез ферментов, генерирующих радикалы активных форм кислорода, которые окисляют фагоцитированный антиген.
• В макрофагах под воздействием ИФНγ,ФНОα и,возможно, ИЛ-1 индуцируется экспрессия NO-синтазы, продуцирующей радикал NO*, который также окисляет фагоцитированный материал.
• В макрофагах индуцируется синтез липидных медиаторов воспаления — ФАТ, простагландинов и лейкотриенов (LTE4).
• Макрофаг синтезирует тканевой фактор коагуляции. В начавшемся процессе коагуляции активируется сывороточный тромбин — протеаза, стимулирующая клетки эндотелия сосудов, а также нейтрофилы к синтезу ФАТ, что ещё больше способствует прогрессированию воспалительного процесса.
• ИФНγ служит самым сильным из известных индукторов синтеза и экспрессии молекул MHC-II. Кроме того, на активированных макрофагах (в отличие от неактивированных) индуцируется экспрессия костимуляторной молекулы B7, что делает активированные макрофаги более эффективн?
