Как формируется иммунитет у плода
Развитие иммунной системы у плода начинается на 2-3-й неделе жизни в утробе матери, а уже на 9-15-й неделе выявляются первые признаки становления клеточного иммунитета. На 3-м месяце беременности у развивающегося плода могут появляться бласты. На 6-й неделе жизни плода начинают типироваться антигены HLA как 1, так и 2 класса. Тимоциты появляются с 7-8-й недели, и к 14-й неделе они располагаются, в основном, в корковом слое тимуса. К 9-й неделе в вилочковой железе можно обнаружить малые лимфоциты, которые вскоре переходят в кровь. В периферической крови нарастание числа лимфоцитов происходит чрезвычайно быстро – к 12-й неделе их количество в 1 мм3 равно приблизительно 1000, а к 20-25 неделе около 10000.
Первые В-лимфоциты появляются в печени после 8-й недели беременности и лишь затем – в костном мозге. В течение длительного срока беременности в печени и крови доминируют пре-В-лимфоциты, в цитоплазме которых выявляются М-глобулиновые цепи, но отсутствуют рецепторы к иммуноглобулинам. Последние в печени плода выявляются приблизительно на 9-й неделе гестации и лишь на 20-й неделе – в периферической крови.
С 12-й недели В-лимфоциты плода способны переходить в плазматические клетки и синтезировать IgM, с 5-го месяца – IgG, а с 7-го – IgA. IgE выявляются у плода на 12-й неделе в легких и на 21-й неделе – в селезенке. Следует отметить, что синтез иммуноглобулинов у плода ограничен. Так, концентрация IgE к моменту рождения крайне низка (в 100-200 раз меньше, чем у взрослого), что обусловлено слабой аллергизацией плода. Очень низкой остается содержание и других иммуноглобулинов. Исключение составляет лишь IgG, которые переходят через плаценту от матери к плоду и потому их содержание в крови достаточно велико.
До момента рождения как Т-, так и В-лимфоциты обладают малой функциональной активностью, хотя и способны в низких концентрациях продуцировать отдельные интерлейкины и интерфероны.
По мнению В. Ботвиньевой, иммунная система ребенка претерпевает 5 критических периодов.
Первый критический период –это период новорожденности. Сразу после рождения в процентном отношении общее число лимфоцитов и Т-лимфоцитов у ребенка снижено. Однако в это время у ребенка имеется резко выраженный физиологический лейкоцитоз, благодаря чему содержание всех популяций лимфоцитов, а также число бластов достаточно высоко. Все Т-лимфоциты новорожденного несут маркер незрелости. Для В-лимфоцитов характерно наличие всех Аг – CD19, CD20, CD23, CD25.
На 5-е сутки после рождения, когда наступает первый перекрест в содержании форменных элементов крови, относительное число лимфоцитов возрастает, но их количество из-за уменьшения общего содержания лейкоцитов остается приблизительно таким же, как и при рождении. Пассивный иммунитет ребенка обеспечивается материнским IgG, прошедшим к плоду через плаценту. IgA в период новорожденности не выявляется, а отсюда отсутствие местного барьерного иммунитета слизистых оболочек. Плазмоциты новорожденного первых дней жизни практически не способны к секреции иммуноглобулинов, за исключением IgM, концентрация которого к 3-му месяцу соответствует приблизительно 50% от уровня взрослого человека.
Уровень IgE даже у взрослых людей очень низок. В крови пупочной вены он практически не выявляется, ибо его концентрация не превышает 0,5-1 МЕ (в норме у взрослого 100 МЕ). У большинства детей первых 3-х месяцев жизни IgE определить не удается.
Чрезвычайно важную роль в иммунной защите ребенка играет секреторный иммуноглобулин А (SIgA), выполняющий барьерную функцию в желудочно-кишечном тракте и органах дыхания. Однако SIgA по ходу желудочно-кишечного тракта у новорожденного отсутствует, что делает его уязвимым к кишечным инфекциям. Указанная восприимчивость к инфекциям объясняется еще и тем, что через плаценту не проникает IgM, появляющийся в ответ на действие ЛПС грамотрицательных бактерий.
В то же время высоко содержание SIgA в грудном молоке и особенно молозиве. Кроме того, в молозиве и грудном молоке находятся IgG, IgM и, в значительно меньшей концентрации, – IgE, обладающие также выраженной защитной функцией против возбудителей различных детских заболеваний. В молозиве, особенно в первые 2 дня после родов, обнаружена высокая концентрация IL-8. Не исключено, что значительная продукция IL-8 эпителиальными клетками молочных желез приводит к повышению в молозиве числа нейтрофилов и концентрации лактоферрина, принимающих участие в защите новорожденного ребенка от инфекционных болезней. Все это лишний раз свидетельствует, как важно раннее (сразу после рождения) прикладывание ребенка к груди матери и кормление женским молоком.
Несмотря на несовершенство собственной иммунной системы ребенка, материнские IgG, прошедшие к плоду через плаценту, а также SIgA молозива и материнского молока обеспечивает ему защиту от многих вирусных и бактериальных заболеваний.
Второй критический период (3-6 месяцев)характеризуется, главным образом, исчезновением из крови ребенка материнского IgG, в результате чего исчезает пассивный иммунитет к детским инфекциям. Несмотря на выраженный лимфоцитоз, в этот период сохраняется супрессорный характер иммунного ответа. На внедрение большинства Аг ребенок реагирует появлением IgM, которые не оставляют иммунной памяти, благодаря чему вновь может проявиться рецидив только что перенесенного заболевания. Точно такой же тип иммунного ответа в этом возрасте возникает на вакцинацию против столбняка, дифтерии, коклюша, полиомиелита и кори. Вот почему в этом возрасте перенесенные коклюш и корь не оставляют иммунитета.
Второй критический период развития иммунной системы ребенка отличается также тем, что в этом возрасте начинают секретироваться IgG.
Уже в первые месяцы жизни ребенка синтезируется барьерный IgA, однако он проявляет слабую активность. Сказанное обусловлено тем, что у ребенка первых месяцев жизни синтезируется в основном секреторный компонент, не обладающий активностью Ат, а не истинный SIgA. Забегая вперед, отметим, что минимально-достаточные сроки созревания SIgA колеблются от 8 месяцев до 1,5-2-х лет. Только к этому времени у ребенка начинает функционировать местный иммунитет пищеварительной системы. Окончательно же SIgA созревает лишь к 10-12 годам.
IgE после 40-й недели выявляется не более чем у 30-35% детей. Концентрация его нарастает очень медленно и приходит к норме взрослых к моменту полового созревания.
Во второй критический период ребенок чрезвычайно подвержен заболеваниям дыхательного аппарата и пищеварительной системы, а также возникновению детских инфекций.
Третий критический период – второй год жизни ребенка–характеризуется сохранением первичного иммунного ответа. Уровень IgM к концу первого года жизни достигает 70%, а к 2-м годам – показателей взрослых людей. К этому сроку в ответ на Аг могут синтезироваться IgG, а, следовательно, может проявляться вторичный иммунный ответ, ибо сохраняются Т- и В-лимфоциты памяти. На втором году жизни преимущественно синтезируются IgG1 и IgG3. К этому сроку число лимфоцитов достигает максимума. В иммунном ответе преобладает хелперная активность по отношению к В-лимфоцитам, которые при переходе в бласты преимущественно синтезируют IgM, IgG1 и IgG3. Следует заметить, что в этом возрасте в крови повышается концентрация не только IgG, но и IgA.
Тем не менее, в третий критический период местный иммунитет еще недостаточно развит, из-за чего дети чувствительны к респираторным вирусным инфекциям.
Четвертый критический период – 4-6-й годы жизни,когда формируется второй перекрест лимфоцитов и нейтрофилов, и уменьшается относительное число лимфоцитов. В этом возрасте концентрация IgG, IgM и IgA достигает цифр, характерных для взрослых людей, а уровень IgE даже может превышать его (максимально до 150 МЕ, при норме 100 МЕ). Завершение формирования системы местного иммунитета наблюдается у большинства детей к 7-ми годам.
Четвертый критический период характеризуется высокой частотой атопических, паразитарных и иммунокомплексных заболеваний и формированием хронических болезней – пневмонии, пиелонефрита, гломерулонефрита.
Пятый критический период – подростковый – наступает у девочек к 12-13-ти годам, а у мальчиков – в 14-15 лет. Показатели клеточного и гуморального иммунитета в этот период мало отличаются от таковых взрослых людей, а дефекты иммунной системы и восприимчивость к различным заболеваниям связаны с особенностями гормонального статуса. Пубертатный скачок массы и длины тела сопровождается относительным снижением лимфоидной ткани, а гормональная перестройка – супрессией клеточного и преобладанием гуморального иммунитета. Система местного иммунитета к этому сроку полностью сформирована, все классы и субклассы IgG и IgA находятся в крови в такой же концентрации, как и у взрослых.
К этому периоду окончательно выявляются индивидуальные, генетически детерминированные типы иммунного ответа – сильный, средний и слабый.
С началом полового созревания могут обостриться хронические воспалительные процессы – пневмония, туберкулез и другие.
Зная, к каким заболеваниям предрасположен ребенок в различные критические периоды развития иммунной системы, врач может предпринимать профилактические меры для предупреждения их развития (своевременное назначение прививок).
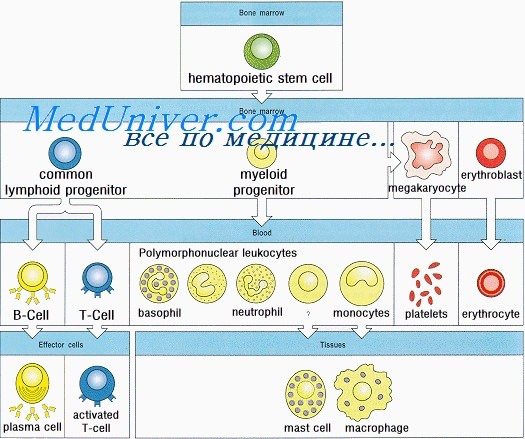
Формирование иммунитета у плода. Неонатальный лимфопоэзЗащиту организма от инфекционных агентов обеспечивают физические барьеры (кожа, слизистые оболочки и реснитчатый эпителий) и различные компоненты иммунной системы. Последняя состоит из Т- и В-лимфоцитов, NK-клеток, дендритных и фагоцитирующих клеток, а также белков комплемента. Иммунная система защищает организм также от аутоиммунных заболеваний и развития злокачественных опухолей. Иммунная система человека развивается из ткани первичной кишки. Полипотентные кроветворные стволовые клетки впервые появляются в желточном мешке на 2,5-3-й неделе внутриутробного развития и на 5-й неделе мигрируют в печень плода. Позднее они попадают в костный мозг, где и остаются на протяжении всей жизни. Из этих клеток образуются лимфоидные стволовые клетки, которые в зависимости от локализации дифференцируются в Т-, В- и NK-клетки. В середине I триместра беременности у плода образуются первичные лимфоидные органы (тимус и костный мозг), а вскоре и вторичные — селезенка, лимфатические узлы, миндалины, пейеровы бляшки и lamina propria. В этих органах дифференцировка Т-, В- и NK-лимфоцитов из стволовых клеток продолжается в течение всей жизни. Как для органогенеза, так и для клеточной дифференцировки необходимо взаимодействие поверхностных молекул лимфоидных клеток с их микроокружением. Многочисленность и разнообразие этих поверхностных молекул отражена в международной классификации дифференцировочных антигенов, которые носят название кластеров дифференцировки (CD). Т- и В-лимфоциты — единственные компоненты иммунной системы, способные распознавать специфические антигены; именно из них образуются клетки памяти (адаптивный иммунитет). Из кроветворных стволовых клеток образуются и NK-клетки, которые также являются лимфоцитами. Они защищают организм от вирусных инфекций, уничтожают опухолевые клетки и участвуют в регуляции иммунных реакций. Белки, синтезируемые и секретируемые Т- и В-лимфоцитами и NK-клетками, а также взаимодействующими с ними клетками, называются цитокинами. Некоторые из этих белков получили название интерлейкинов (ИЛ). На 4-й неделе внутриутробной жизни из эктодермы третьей жаберной дуги и эндодермы третьего глоточного кармана образуется первичная закладка тимуса. На 7-8-й неделе правая и левая его части перемещаются каудально и сливаются друг с другом. На 8-й неделе предшественники Т-лимфоцитов из печени плода через кровь начинают поступать в окружающую тимус мезенхиму. Эти про-Т-лимфоциты идентифицируют по поверхностным белкам CD7 и CD34. К 8-8,5 нед. гестации СD7-клетки обнаруживаются уже в самом тимусе, причем на некоторых из них экспрессируются также CD4 и CD8.
Первый из этих маркеров характерен для зрелых Т-лимфоцитов-хелперов (Th), a CD8 — для зрелых цитотоксических Т-лимфоцитов и NK-клеток. Кроме того, на некоторых клетках присутствуют одиночные цепи антигенраспознающих рецепторов Т-лимфоцитов (TCR, Ti), но не полные TCR. Зрелые TCR представляют собой гетеродимеры, состоящие из двух цепей — либо а и b, либо у и 8. TCR экспрессируются на клеточной поверхности вместе с CD3, образуя комплекс из пяти полипептидных цепей). Рекомбинация гена TCR осуществляется путем слияния крупных отдаленных друг от друга сегментов ДНК. Эти сегменты называются V (вариабельным), D (дополнительным) и J (соединяющим), причем каждый из них имеет ряд вариантов. Сегменты VDJ присоединяются к константной области а-гена, а сегменты VJ — к р-гену, завершая строение генов, кодирующих TCR. Случайная комбинация сегментов и определяет, в основном, огромное разнообразие TCR, придавая им способность распознавать миллионы различных антигенов. Рекомбинация генов TCR регулируется ферментами RAG-1 и RAG-2 (рекомбиназы, активирующие гены), а также другими ферментами. При тяжелом комбинированном иммунодефиците у мышей и некоторых людей процесс рекомбинации нарушен. Рекомбинация генов TCR знаменует собой превращение про-Т-лимфоцитов в пре-Т-лимфоциты. Этот процесс начинается вскоре после заселения тимуса стволовыми клетками. На 8-10-й неделе внутриутробной жизни начинают формироваться Т-лимфоциты с разной функцией. На 9,5-10-й неделе более 95% тимоцитов экспрессирует CD7, CD2, CD4, CD8 и цитоплазматический CD3, а примерно 30% — внутренний антиген клеток коркового вещества тимуса. К 10-й неделе 25% тимоцитов обладают TCRaP. Число таких тимоцитов в ходе эмбрионального развития постепенно увеличивается и после рождения превышает 95 %. По мере экспрессии TCR начинаются процессы позитивной и негативной селекции клеток коркового вещества тимуса. Позитивная селекция происходит путем взаимодействия незрелых тимоцитов (слабо экспрессирующих TCR) с МНС на эпителиальных клетках тимуса. В результате активируются и созревают только те тимоциты, рецепторы которых способны взаимодействовать с чужеродными антигенами, представляемыми им антигенами МНС. Зрелые тимоциты, прошедшие процесс селекции, экспрессируют либо CD4, либо CD8. Первые способны взаимодействовать с чужеродными антигенами, представляемыми молекулами HLA класса II, а вторые — с антигенами, представляемыми классом I HLA. Затем начинается негативная селекция, обусловленная взаимодействием выживших тимоцитов, экспрессирующих значительно большее количество TCR, с пептидами хозяина, представляемыми HLA классов I и II, которые присутствуют на поступивших из костного мозга макрофагах, дендритных клетках и, возможно, В-лимфоцитах. Взаимодействие с этими антигенами включает программу апоптоза (запрограммированной гибели) аутореактивных тимоцитов. Клетки коркового вещества тимуса плода относятся к числу наиболее быстро делящихся клеток организма; их количество за 2 нед. после заселения тимуса стволовыми клетками возрастает в 100 000 раз. По мере их созревания происходят процессы селекции, в результате которых 97 % этих клеток погибает. Выжившие клетки несут на своей поверхности либо только CD4, либо только CD8, но не оба этих антигена и мигрируют в мозговое вещество тимуса. Одновременно с появлением тимоцитов, обладающих только одним дифференцировочным антигеном, развиваются и функции Т-лимфоцитов, но до их выхода из тимуса эти клетки остаются незрелыми. Одна стволовая клетки дает начало примерно 3000 зрелых клеток мозгового вещества тимуса. Они устойчивы к лизирующему эффекту кортикостероидов. На 11—12-й неделе внутриутробной жизни Т-лимфоциты начинают покидать тимус, заселяя селезенку, лимфатические узлы и аппендикс, а на 14-15-й неделе — и миндалины. Наибольшее их количество скапливается в корковом веществе лимфатических узлов, вокруг артериол селезенки и в лимфе грудного лимфатического протока. Клетки, недавно покинувшие тимус, одновременно экспрессируют изоформы CD45RA и CD62L (L-селектин). Рекомбинация генов TCR в ходе этого процесса приводит к образованию в качестве побочного продукта круговых эписом, которые обнаруживаются в Т-лимфоцитах, недавно покинувших тимус. В Т-лимфоцитах, созревающих вне тимуса, эписомы отсутствуют. Молекула адгезии, L-селектин, взаимодействует с углеводными компонентами специфических участков кровеносных сосудов. Такие участки (венулы с высоким эпителием) присутствуют в периферических лимфоидных органах, что и определяет задержку лимфоцитов в них. К 12-й неделе внутриутробной жизни Т-лимфоциты приобретают способность к пролиферации под действием растительных лектинов, таких как ФГА и КонА, и аллогенных клеток; антигенсвязывающие Т-лимфоциты появляются на 20-й неделе. — Также рекомендуем «Созревание и дифференцировка В-лимфоцитов у плода. Синтез иммуноглобулинов в утробе матери» Оглавление темы «Иммунитет плода»:
|
Практически у всех женщин с наступлением беременности снижается иммунитет, так как в этот период включается естественный механизм его подавления. В первую очередь это относится к клеточному иммунитету.
Женский организм, плацента и плод вырабатывают особые белковые факторы и вещества, которые угнетают иммунный ответ на присутствие чужеродного организма и не допускают реакции отторжения зародыша. Беременная женщина обычно не рассматривается как иммунологически «скомпрометированный» хозяин. Однако беременность связана со сложными иммунологическими изменениями, которые могут подвергнуть беременную женщину более высокому риску заболеваний.
Особенности клеточного иммунитета беременной женщины[править | править код]
Т-лимфоциты матери распознают антигены плода. Этот антиген-специфический иммунный ответ на отцовские антигены приводит к пролиферации и накоплению определенных клонов T-лимфоцитов. Во время беременности происходит сенсибилизация цитотоксических T-лимфоцитов матери к унаследованным от отца антигенам тканевой совместимости.
Беременность всегда сопровождается иммунодепрессией, но иммунитет женщины восстанавливается примерно через 3 месяца после родов. Иными словами, во время беременности у всех женщин иммунный статус понижается, тем не менее, после родов он почти всегда возвращается к исходному уровню.
Угнетение иммунной системы проявляется в снижении абсолютного и относительного количества Т-клеток при некотором повышении относительного содержания активных Т-лимфоцитов. При исследовании субпопуляций Т-лимфоцитов установлено достоверное снижение числа Т-хелперов, Т-супрессоров при повышенном значении соотношения Т-супрессоры/Т-хелперы. Функция Т-клеток, оцениваемая по их колониеобразующей активности и пролиферативному ответу на стимуляцию антигеном, снижается. Также Т-клеточная цитотоксичность может быть снижена. В-клеточный ответ и продукция иммуноглобулинов тоже оказываются подавленными, количество B-лимфоцитов снижается.
Другие авторы наблюдали повышение функции В-лимфоцитов, сопровождающееся повышением уровня сывороточных иммуноглобулинов. Иммуноглобулины играют важную функцию посредников в каскадном развитии иммунного ответа и частично могут обусловливать эффективность конечных, эффекторных реакций клеточного иммунитета по инактивации и элиминации бактериальных, вирусных и грибковых антигенов. Функциями антител является запуск классического пути активации комплемента, прикрепление к микробной клетке (опсонизация) с целью усиления эффективности фагоцитоза и цитотоксических реакций, осуществляемых естественными киллерами, моноцитами и макрофагами, цитотоксическими Т-лимфоцитами.
Изменения в иммунном статусе беременных выражаются в дисиммуноглобулинемии: снижении содержания IgG, повышении уровня IgM и IgA. Так как IgG относится к основному классу иммуноглобулинов, ответственных за антибактериальный иммунитет, снижение его содержания при активации инфекционного процесса у беременной может свидетельствовать об угнетении иммунологической реактивности организма. С иммунопатологической точки зрения, в регуляции иммунологического равновесия во время беременности участвует самая древняя система иммуного ответа, система цитотоксических NK-клеток, которые инактивируются при беременности.
Более того, гормональные изменения, происходящие во время беременности, также могут иметь иммуносупрессивный эффект. Прогестерон и кортизол, оба повышающиеся во время беременности, обладают способностью подавлять клеточный иммунитет. Доказано, что эстрогены и прогестерон обладают свойствами физиологических иммуносупрессоров, причем прогестерон поддерживает локальную иммуносупрессию в плаценте, избирательно блокируя Т-лимфоциты. Во время беременности в матке содержится большое количество макрофагов, располагающихся в эндометрии и миометрии. Их количество регулируется гормонами яичников, так как макрофаги содержат рецепторы к эстрогенам.
Современные взгляды на иммунобиологию беременности[править | править код]
Традиционные взгляды на беременность не только как на иммуносупрессивное состояние, но даже как на иммунодефицитное состояние все ещё широко распространены. Однако эта точка зрения не согласуется с тем, что при беременности не отмечается склонности к развитию инфекционных и воспалительных заболеваний, наоборот, многие хронические воспалительные процессы, в том числе и в органах малого таза, затухают во время беременности. Более того, остаются необъясненными важные изменения в иммунной системе при беременности, а именно содержание больших количеств лейкоцитов (включая макрофаги, большие гранулярные лимфоциты и T-лимфоциты) на границе трофобласта и децидуальной оболочки, а также повышение в периферической крови матери количества гранулоцитов и моноцитов. Большое число пролиферирующих клонов T-лимфоцитов в крови беременной женщины четко определяется уже на 9-10 неделе после зачатия. Эти изменения достигают максимума во втором триместре беременности. После 30 недель беременности почти все пролиферировавшие клоны исчезают. К моменту родов степень клональности возвращается к нормальным значениям.
В ответ на действие эндотоксинов моноциты беременных женщин выделяют больше провоспалительных цитокинов, чем моноциты небеременных женщин. Таким образом, налицо активация системы естественного иммунитета при беременности. Исследования профессора Кембриджского университета Дугласа Фирона и американского профессора Ричарда Локси помогли по-новому взглянуть на роль естественного иммунитета в защите организма от чужеродных факторов. Они считают, что система естественного иммунитета, возникшая с первыми многоклеточными организмами не является иммунологическим атавизмом. Исследования последних лет показали, что естественный иммунитет является основой в защите организма от инфекций. Новое осмысление роли естественных факторов иммунной защиты позволило выработать новые подходы к профилактике и лечению бактериальных, вирусных, аутоиммунных заболеваний, и это позволило по-новому взглянуть на «иммунологический парадокс» беременности.
Основываясь на выводах Фирона-Локси, была предложена концепция регуляции иммунной системы матери при беременности: клеточные и растворимые продукты плаценты обладают разнонаправленным модулирующим действием на врожденное и приобретенное звенья иммунной системы матери, что приводит к тому, что специфический иммунный ответ подавляется, а неспецифический, наоборот, усиливается.
Источники[править | править код]
- Сидорова И. С., Алешкин В. А., Матвиенко Н. А. Состояние иммунной системы у беременных и новорожденных группы высокого риска по внутриутробному инфицированию. – М.: Центр иммунокоррекции НИИ эпидемиологии и микробиологии им. Г.Н. Габричевского.
- Гузов И. И. Иммунобиология и иммунопатология беременности. – Центр иммунологии и репродукции.
См. также[править | править код]
- Иммуносупрессия
