Клеточный иммунитет при сифилисе

Реакции иммунной системы организма при заражении сифилисом

Сифилис — это инфекционное заболевание, вызываемое бледной трепонемой (бактерией Treponema pallidum). Организм человека, заболевшего сифилисом, защищается от возбудителя заболевания с помощью механизмов иммунитета. Проникновение, длительное сохранение в организме (персистенция) и размножение возбудителя заболевания в организме хозяина приводят к выраженным изменениям со стороны иммунной системы.
После попадания бледных трепонем в организм и при их дальнейшем размножении, в организме больного человека происходят иммунные сдвиги. Механизм иммунного ответа при сифилисе исследован не полностью, однако имеются достаточно убедительные данные о том, что в этом процессе участвуют все звенья иммунной системы.
Активируются механизмы как врожденного неспецифического иммунитета, свойственного человеку как биологическуому виду, так и адаптивного, антиген-опосредованного иммунного ответа, вызванного контактом с антигеном. В иммунном ответе организма принимают участие как клеточные (макрофаги, Т-лимфоциты), так и гуморальные механизмы (синтез специфических иммуноглобулинов — антител).
Иммунную реакцию вызывают белки, входящие в состав структур бледной трепонемы; они являются чужеродными веществами для организма человека и относятся к антигенам. Все антигены трепонемы способны стимулировать организм больного вырабатывать антитела соответствующих классов. Вследствие этого, в сыворотке крови больных сифилисом отмечается множественность антител: протеиновых, комплементсвязывающих, полисахаридных реагинов, иммобилизинов, агглютининов.
Классы вырабатываемых антител меняются на разных этапах течения сифилиса — в различных стадиях болезни преобладают то одни, то другие антитела, относящиеся к разным классам иммуноглобулинов. Сила иммунного ответа и спектр антител, выявляемых на разных стадиях развития инфекции, зависит от особенностей организма у данного человека.
У больных вторичным и третичным сифилисом отмечаются признаки микробзависимой супрессии иммунитета.
Сифилис принадлежит к инфекциям, хроническое течение которых вступает в несоответствие с выраженным иммунным ответом на антигены возбудителя. Иными словами, «иммунитет» (т.е. резистентность к инфекции) и «иммунные сдвиги» при сифилисе не совпадают, а иногда и противоречат друг другу.
Во многих случаях иммунологический ответ не предотвращает поэтапного развития инфекции. Организм хозяина неспособен уничтожить сифилитическую инфекцию, что приводит к дальнейшей эволюции патологического процесса. Болезнь, начавшись с местного процесса, распространяется на весь организм и продолжается много лет.
Клеточный и гуморальный иммунный ответ на внедрение бледной трепонемы в организм
В иммунном ответе организма на заражение принимают участие клеточные и гуморальные механизмы иммунитета.
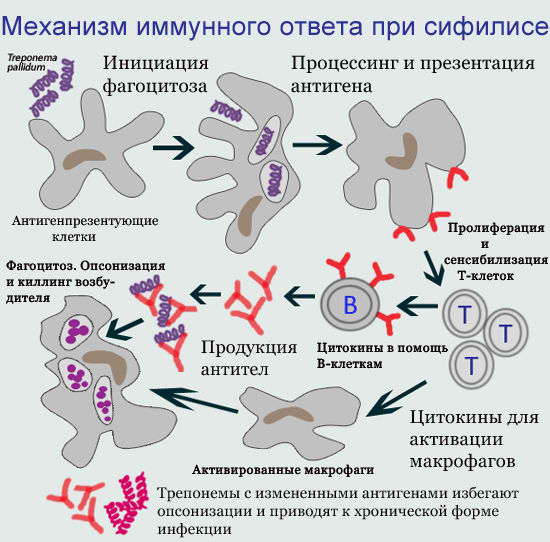
1. Клеточный иммунитет при заражении сифилисом
Клеточный иммунитет является одним из наиболее ранних ответов макроорганизма человека на внедрение бледной трепонемы и, в целом, играет значительную роль в формировании иммунной защиты и санации от сифилитической инфекции.
На клеточном уровне бледной трепонеме противодействуют высокоспециализированные клетки иммунной системы — макрофаги, T-лимфоциты, B-лимфоциты. Происходит изоляция и частичное уничтожение трепонем фагоцитами, в основном макрофагами. Фагоцитоз носит преимущественно незавершенный характер — при поглощении фагоцитом возбудитель не погибает, а остается в клетке, сохраняя свою структуру и способность к размножению. Более того, фагоцит оберегает от антител и воздействия антибиотиков бледную трепонему, которая становится недоступной для защитных сил организма.
Ранний сифилис характеризуется частичным угнетением клеточного иммунитета и развитием состояния иммуносупрессии, постепенно нарастающей активизацией гуморального иммунитета. Клеточное звено страдает в первую очередь, так как Т-лимфоциты более чувствительны к воздействию бактерий T. pallidum.
У больных вторичным, латентным и третичным сифилисом формируется клеточный иммунитет, признаки которого выявляются в реакциях in vivo (кожные пробы) и in vitro (стимуляция Т-лимфоцитов трепонемными антигенами).
2. Гуморальный иммунитет при заражении сифилисе
Гуморальный иммунный ответ заключается в продукции широкого спектра противосифилитических антител. В структуре бледной трепонемы выявлено большое количество соединений, имеющих выраженные антигенные свойства для иммунной системы человека. На начальных этапах развития сифилиса происходит более выраженный синтез антител к антигенам, имеющим высокое содержание в клетке T. pallidum и локализующимся в структуре мембран наружной клеточной стенки или протоплазматического комплекса.
3. Уклонение бледных трепонем от иммунного ответа
Клеточное и гуморальное звенья иммунитета не в состоянии обеспечить полное уничтожение и элиминацию бледных трепонем. Благодаря своему необычному молекулярному строению, T. pallidum обладает замечательной способностью уклоняться от защитной реакции макроорганизма.
В геноме T. pallidum существует нескольких повторяющихся участков, отвечающих за синтез белков, определяющих взаимодействие с иммунной системой организма. «Ускользание» бледной трепонемы от иммунной системы обусловлено вариабельностью этих поверхностных белков, структура которых определяется вариабельностью генов. Этот феномен способствует сохранению бледной трепонемы в организме, в том числе при скрытой инфекции.
Электронно-микроскопические исследования показали, что при сифилисе преобладает незавершенный фагоцитоз трепонем (захват и поглощение трепонем лейкоцитами, макрофагами и другими клетками). При этом трепонемы не погибают, а получают защиту от антибиотиков и антител, и могут даже размножаться в фагоцитирующей клетке. В течение всего инкубационного периода, а также в конце первичного и в начале вторичного периодов сифилиса, возбудители активно размножаются и распространяются по всему организму.
Гуморальный иммунный ответ. Противосифилитические антитела.
Гуморальный иммунный ответ заключается в продукции широкого спектра антител, которые можно разделить на две группы. Противосифилитические антитела могут быть неспецифическими — их называют «реагины» (или антикардиолипиновые антитела) и специфическими (противотрепонемные антитела).
1. Неспецифические антитела при сифилисе
Неспецифические антитела при сифилисе — это антикардиолипиновые антитела, исторически получившие название «реагины». Они направлены против липидных антигенов бледной трепонемы и против аутоантигенов, появляющихся вследствие повреждения и разрушения клеток больного.
Реагиновые антитела у больного сифилисом — это иммуноглобулины класса IgG и IgM. Они являются комплексным ответом на высвобождение липоидных молекулярных фрагментов из поврежденных клеток хозяина, а также на появление липопротеиноподобных структур, сходных с кардиолипином, входящих в состав бактериальной клетки бледной трепонемы.
Липидные антигены cоставляют значительную часть бактериальной клетки T. pallidum. Помимо других антигенов, в клеточной стенке бледной трепонемы содержится фосфолипид кардиолипин; на его долю приходится около 30% сухого вещества клетки спирохеты. В организме человека, больного сифилисом, могут присутствовать липиды, имеющие сходное строение с липоидными структурами клеточной стенки бледной трепонемы. Это аутоантигены, образующиеся в результате разрушения органов и тканей, в основном липиды митохондриальных мембран.
Аутоантигены — это компоненты клеток и тканей собственного организма, которые распознаются при определённых условиях как частично чужеродные. Аутоантитела к кардиолипину – это антитела, направленные организмом против собственного кардиолипина.
Клетки человека, больного сифилисом выделяют в большом количестве липоидный и липопротеиноподобный материал, сходный с кардиолипином. Бледная трепонема приводит к поражению внутренних органов, в частности, к повреждению печени и сердца, освобождая некоторые фрагменты тканей. При интенсивном размножении спирохет в организме больного происходит распад тканей, в результате чего из поврежденных клеток высвобождаются липоидные молекулярные фрагменты.
Иммунная система пациента реагирует, вырабатывая реагиновые антитела на эти фрагменты. Продукты распада клеток — липоидные белки — поступают в кровяное русло. Эти белки являются чужеродными для организма человека, поэтому реакция организма проявляется в виде выработки неспецифических антител (иммуноглобулинов) класса IgM и IgG к липоидному и липопротеиноподобному материалу. Именно эти антитела исторически называются реагинами.
Следует иметь в виду, что реагины с помощью кардиолипиновых тестов могут обнаруживаться в организме людей, никогда не болевших сифилисом, т.к. их количество повышается при различных физиологических и патологических состояниях, не связанных с сифилисом, например у пациентов с аутоиммунными, воспалительными и гематологическими заболеваниями. Эти реагины могут быть причиной так называемых биологических ложноположительных серологических реакций на сифилис.
Антилипидные (неспецифические) антитела появляются в организме человека со стадии первичного сифилиса —примерно через 7-14 дней после образования твердого шанкра, через 4-5 недель после заражения.
Антитела против кардиолипина выявляют посредством нетрепонемных серологических тестов. При нетрепонемных методах анализа на сифилис не различают тип антител (IgG, IgM или др.), а определяют суммарный ответ.
2. Специфические антитела при сифилисе
Специфические антитрепонемные антитела направлены против бледной трепонемы. Плазматические клетки организма вырабатывают специфические антитела, направленные против соответствующих антигенов возбудителя заболевания.
На ранних этапах развития сифилиса, как бактериальной инфекции, у заболевшего человека осуществляется выработка специфических антител, относящихся преимущественно к иммуноглобулинам класса M (первичный иммунный ответ). Трепонемоспецифические Ig класса M у больных сифилисом могут регистрироваться даже в период инкубации. Позднее происходит переключение на синтез IgG (вторичный иммунный ответ).
Параметры иммунного ответа могут изменяться в результате проводимого лечения. Адекватное лечение раннего сифилиса приводит к быстрому снижению титров неспецифических антител и специфических IgM.
По мере развития патологического процесса постепенно включаются механизмы образования антител классов G и А. Ведущая роль в гуморальном ответе переходит к специфическим антителам IgG и IgА. При этом специфические IgG обычно сохраняются в сыворотке крови в течение длительного периода времени,а иногда и всю жизнь
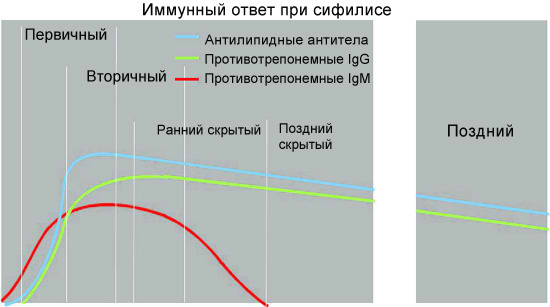
Динамика образования специфических антител у больного при сифилисе
По данным современных исследований, гуморальный ответ при сифилисе происходит в соответствии с общими закономерностями для бактериальных инфекций. Вначале вырабатываются иммуноглобулины класса M против наиболее иммуногенных и специфичных антигенов возбудителя. Специфические антитела класса M способны выявляться в крови пациентов, инфицированных T. pallidum, на самых ранних этапах развития инфекции, уже через 1,5-2 недели после заражения, что клинически соответствует скрытому инкубационному периоду заболевания. При первичном и вторичном сифилисе содержание указанных антител в крови больных быстро нарастает и сохраняется на высоком уровне; максимальное их содержание у больных сифилисом приходится на 6—9-ю неделю заболевания.
После успешного лечения антибактериальными препаратами специфические IgM у больных относительно быстро элиминируют из кровотока (через 3—12 месяцев). При лечении раннего сифилиса IgM исчезают через 3-6 месяцев, позднего – через 1 год. Большое диагностическое значение приобретает выявление антитрепонемных антител IgM в крови новорожденных. Так как IgM не проходит через плаценту, выявление антитрепонемных IgM-антител у новорожденного указывает на врожденный сифилис. Точно так же IgM-антитела не проникают через гематоэнцефалический барьер, и их появление в спиномозговой жидкости говорит о нейросифилисе.
Многие лабораторные методики диагностики сифилиса основаны именно на выявлении трепонемоспецифических IgM. Например, иммуноферментный анализ (ИФА) на твердой фазе и линейный иммуноблоттинг (ИБ) на микропористых стрипах с использованием антивидовых конъюгатов на основе моноклональных антител к тяжелой мю-цепи в структуре IgМ человека, а также реакция непрямой иммунофлюоресценции (РИФ) с исследованием 19S-фракции сыворотки крови, содержащей тяжелые IgМ.
Раннее определение специфических IgM также может быть применено для своевременного выявления случаев раннего врождённого сифилиса (определение специфических IgM в крови новорожденных) или случаев реинфекции у пациентов, ранее перенесших сифилис.
Без лечения, по мере развития болезни и разрешения клинических проявлений вторичного периода, уровень специфических IgМ в крови больных сифилисом постепенно понижается и начинает преобладать синтез IgG. Развитие иммунного ответа на антигенную стимуляцию в организме больного сифилисом сопровождается постепенным переключением с синтеза антител класса M на продукцию более мелких молекул иммуноглобулинов класса G.
Специфические иммуноглобулины класса G в кровотоке больных сифилисом появляются более поздно, в конце 3-й или на 4-й неделе после заражения и, как правило, достигают более высоких титров, чем IgM. Уже на 6 неделе после инфицирования уровень IgG преобладает над уровнем IgM и может сохраняться в таком состоянии годы.
Содержание специфических IgG, постепенно увеличиваясь, достигает максимальной выраженности через 1—1,5 года, после чего несколько снижается, подвергаясь волнообразным колебаниям в зависимости от активности инфекционного процесса. Количество специфических IgG в циркулирующей крови после адекватно проведенного лечения снижается медленно. Антитела этого класса могут сохраняться даже после клинического излечения пациента в течение десятков лет или пожизненно.
Кроме перечисленных видов антител, в гуморальном иммунитете при сифилисе принимают участие иммуноглобулины класса А. Антитела IgA вырабатываются в сравнительно небольших количествах. Вопрос о синтезе IgE и IgD в настоящее время изучен недостаточно.
1.2.2. Клеточное звено иммунитета при сифилисе
Известно, что повышение продукции ИЛ 1 клетками моноцитарного ряда развивается в ответ на их стимуляцию антигенами микроорганизмов и является пусковым фактором активации иммунной системы организма. В отдельных работах было показано, что по мере развития иммунного ответа при сифилисе выработка ИЛ 1 подавляется метаболитами арахидоновой кислоты по механизму обратной связи (Tomai M.A., Fitzegald T.J., 1991). Кроме того, подавление выработки ИЛ 1 может осуществляться многими цитокинами (Paul W.E., 1984). Экспериментально было установлено, что введение бледных трепонем в организм кролика вызывает развитие повышенной продукции ИЛ 1 в течение 24 часов, затем уровень синтеза монокина начинает подавляться вырабатывающимися простогландинами (Fitzgerald T.J. et al., 1991). Но у пациентов с различными формами раннего приобретённого сифилиса не обнаружено повышение продукции ИЛ 1 (Соколовский Е.В. и соавт., 1996). Это можно объяснить тем, что запуск иммунного ответа, начинающийся у больных ещё в инкубационном периоде и сопровождающийся повышением продукции ИЛ 1, уже произошел, и к моменту манифестации клинических проявлений продукция ИЛ 1 снизилась до нормальных значений. Достоверное повышение уровня продукции ИЛ 1 было выявлено у пациентов с серорезистентностью (Соколовский Е.В. и соавт., 1996). Стимулирующим фактором синтеза ИЛ 1 может являться персистирующая в организме бледная трепонема. О персистенции возбудителя в организме свидетельствует выработка специфических Ig M (Paul W.E., 1984) и Ig G. Остаётся неясным, почему при серорезистентности не происходит снижение синтеза ИЛ 1 клетками моноцитарного ряда по механизму обратной связи. Предполагается, что отсутствие подавления синтеза ИЛ 1 обусловлено нарушением регуляции функционирующих макро-фагов, что может быть спровоцировано самой бледной трпонемой, которая в результате длительной персистенции приобретает новые свойства. Нельзя ис-ключать и возможность наличия генетического дефекта макрофагов. У больных сифилисом была показана корреляция между определёнными генетическими маркёрами и различным течением инфекции (Ким Э.Г., 1992). При исследованиях иммуногенетических маркёров было установлено, что лица с локусами HLA-антигенов А1, В7, В8 имеют гораздо больший риск заразиться сифилисом, чем лица с локусом В17, которые инфицируются почти в 4 раза реже (Капкаев Р.А. и соавт., 1989). Следует также учитывать, что помимо макрофагов вырабатывать ИЛ 1 могут и В-лимфоциты (Кетлинский С.А. и соавт., 1992). Активация макро-фагов при серорезистентности не сопровождается повышением уровня неоп-терина *(Hubert C., 1984; Wachter H. et al., 1989), что отличается от состояния активации моноцитов при манифестных формах сифилиса. В сочетании с менее выраженным, по сравнению с манифестными формами, повышением в крови бе-та-2-микроглобулина**, это говорит не только о более низком уровне активации иммунокомпетентных клеток, но и об изменении антигенпрезентирующей функ-ции макрофагов.
По данным отдельных авторов при серорезистентности и вторичном свежем сифилисе наблюдается повышение продукции ИЛ 2 (Соколовский Е.В. и соавт., 1996). В других исследованиях было установлено, что самый высокий уровень ИЛ 2 наблюдается при раннем и позднем скрытом сифилисе (Podwinska J. et al., 1995). Повышение уровня ИЛ 2 происходит на фоне увеличенного количества ИЛ 1 и повышенного относительного содержания Т-лф. Последнее может быть связано с действием ИЛ 2, как росткового фактора Т-лф. ИЛ 2, действуя на активированные липополисахаридами бледной трепонемы макрофаги, может вызвать стимуляцию представления ими антигенов. Бледная трепонема, увеличивая цитотоксическую активность, выступает в роли макрофагактивирующего фактора (Tomai M.A. et al., 1989). За счет действия ИЛ 2 на пролиферацию В-лф, развивается увеличение относительного содержания В-лф и увеличение продукции ими специфических Ig G при серорезистентности. Однако следует заметить, что ИЛ 2 активирует только те В-лимфоциты, которые предварительно имели специфическую стимуляцию (Кетлинский С.А. и соавт., 1992).
Как показали исследования, клеточный иммунитет при сифилитической инфекции развивается значительно быстрее, чем гуморальный, и имеет первостепенную роль в иммунологической перестройке организма (Антоньев А.А. и соавт., 1977; Резникова Л.С. и соавт., 1980; Федотов В.П. и соавт., 1981; Мануйлова Л.А. и соавт., 1983; Шапошников О.К., 1991; Родионов А.Н., 1997). Как известно, реакции клеточного иммунитета формируются за счет двух субпопуляций Т-лф (антигенреактивных и эффекторных) и протекают в условиях организма стадийно. Выраженность стадий отражается в кожных тестах ГЗТ. Результаты этих тестов при сифилисе следует рассматривать как показатель угнетения первичного иммунологического ответа вследствие определённых функциональных нарушений активности Т-лф, особенно их резервных возможностей в иммунологических реакциях. Причем при поздних формах сифилиса угнетение данной реакции наиболее выражено. Абсолютная анергия кожи отмечалась у больных сифилисом с патологическими изменениями в ликворе, пустулёзными элементами, широкими кондиломами, алопецией и лейкодермой (Федотов В.П. и соавт., 1981; Мануйлова Л.А. и соавт., 1983). Отчётливо выявлялось дальнейшее угнетение иммунных реакций клеток и снижение возможности их адекватного ответа на антигенное раздражение у больных с длительным инфекционным процессом и продолжительным воздействием на организм продуктов жизнедеятельности бледной трепонемы. Можно предположить и отрицательное влияние при этом аутоиммунных процессов, развивающихся в очагах инфекции вследствие денатурации белков и превращения их в аутоантигены (Федотов В.П. и соавт., 1981).
Выявлено неблагоприятное влияние сифилитической инфекции на количественное содержание Т-клеток, резкое снижение числа которых наблюдается уже на ранних этапах заболевания, особенно у ослабленных больных и при наличие осложнений (Мануйлова Л.А. и соавт., 1983; Главинская Т.А. и соавт., 1987; Соколовский Е.В. и соавт., 1996; N`Gom P.T. et al., 1997). В тоже время при первичном и вторичном свежем сифилисе наблюдается увеличение количества О- и D-клеток, нарушение процессов их пролиферации и дифференцировки (Главинская Т.А. и соавт., 1987). Наиболее низкое содержание Т-лф наблюдается при вторичном свежем сифилисе (Цераиди Н.Ф., 1987; Иванов О.Л. и соавт., 1998). Снижение числа Т-клеток и их функции сопровождается недостаточными титрами специфических реагинов в RW, что можно расценивать как вторичную супрессию В-клеток. При дальнейшем развитии инфекции абсолютное количество Т-лф увеличивается. Достоверное повышение данного показателя было выявлено у больных скрытым сифилисом с длительностью болезни больше года (Соколовский Е.В. и соавт., 1996; Иванов О.Л. и соавт., 1998). В других исследованиях было отмечено снижение количества Т-клеток, особенно при раннем скрытом сифилисе в сочетании с сопутствующими заболеваниями (Нестеренко Г.Б., Захаров В.К., 1983). В отношении субпопуляций Т-лф были получены следующие данные: количество Т-хелперов снижается на ранних стадиях сифилиса, особенно при первичном серопозитивном и вторичном свежем сифилисе, количество Т-супрессоров недостоверно снижено при первичном серопозитивном, вторичном свежем, рецидивном и раннем скрытом сифилисе (Родионов А.Н., 1997; Иванов О.Л. и соавт., 1998). У больных первичным серопозитивным, вторичном свежем сифилисе отмечается снижение иммунорегуляторного индекса (Т-х / Т-с) (Цераиди Н.Ф., 1987; Иванов О.Л. и соавт., 1998), а при вторичном рецидивном и раннем скрытом сифилисе он не отличается от нормы (Иванов О.Л. и соавт., 1998).
Тенденция к увеличению количества Т-лф в сыворотке крови наблюдается по мере нарастания патологических изменений в ликворе (Зорин П.М., Кондратенко Л.А., 1979). При этом первичный клеточный ответ угнетен. Т-лимфоцитоз объясняется компенсаторными реакциями иммунной системы при нарушении гематоэнцефалического барьера и дополнительным антигенным воздействием на нервные центры, способствующим продукции Т-лф и выбросу их в кровь. Подобное следует расценивать как доброкачественный защитный ответ иммунокомпетентных органов на дальнейшее распространение инфекции в организме.
В то же время по мере нарастания патологических изменений в ликворе количество В-лф имеет тенденцию к снижению (Бурдак В.Н. и соавт., 1989). Эти различия в характере иммунных сдвигов у больных ранними формами сифилиса авторы объясняют либо компенсаторными реакциями организма с целью снижения титра антител, либо, что вероятнее всего, развитием иммунодепрессии В-звена для сдерживания развивающихся аутоиммунных процессов.
Как показали исследования, РБТЛ и РТМЛ более выражены на ранних этапах заболевания. При вторичном рецидивном и латентном сифилисе их интенсивность снижается причем параллельно с уменьшением титров специфических реагинов (Мануйлова Л.А. и соавт., 1983; Sandhofer M., Fritz J., 1976). Уже в первичной серонегативной стадии сифилиса в увеличенном лимфатическом узле содержались лимфоциты, обладающие узкой антигенспецифичностью к трепонемам, в то время как в перифирической крови у этих больных комитированных Т-лф было еще мало (Долгов А.Д., 1978; Barret L.K. et al., 1996). РБТЛ на ФГА у больных скрытым сифилисом снижена, а РБТЛ с трепонемным и кардиолипиновыми антигенами повышена. Причем при использовании трепонемного антигена активность Т-лф более выражена, т.е. антигены с разной специфичностью вызывают у Т-лф различную по интенсивности реакцию, указывающую на неодинаковый иммунный ответ на разные антигены, присущие бледной трепонеме (Нестеренко Г.Б., Захаров В.К., 1983).
Следует отметить, что в 1969 году Левене в плазме больных с вторичным сифилисом выявил присутствие фактора, который снижает способность нормальных лимфоцитов трансформироваться в бласты. В последующем было установлено наличие супрессорного фактора (мукополисахарид) в крови больных сифилисом людей, инфицированных бледной трепонемой экспериментальных животных и в жидкости из сифилитических орхитов кроликов. В результате проведенных исследований было выявлено, что патогенные трепонемы в отличие от непатогенных имеют на своей поверхности мукополисахаридный слой, который закрывает доступ иммунокомпетентным клеткам к антигенным детерминантам их клеточной стенки (Попов В.Е., Дмитриев Г.А., 1983). Как оказалось, мукополисахариды, попадая из очагов поражения в кровь, оседают на поверхности лимфоцитов, и, закрывая их рецепторы, препятствуют процессу иммунологического распознавания, что ведет к снижению выраженности клеточного иммунного ответа.
Необходимо также упомянуть о реакции агломерации лейкоцитов. Данная реакция положительна уже в серонегативной стадии сифилиса, в то время как КСР еще отрицательны (Антоньев А.А. и соавт., 1977; Резникова Л.С. и соавт., 1980). Аналогичные результаты получены и при экспериментальном сифилисе (Родин Ю.А., Звягницева Л.Е., 1978). Интенсивность РАЛ зависит от напряженности клеточного иммунитета, обусловленного специфической сенсибилизацией лейкоцитов к продуктам обмена бледной трепонемы. По мере развития сифилитического процесса наблюдается повышение процента агломерации лейкоцитов, достигающего максимума у больных вторичным рецидивным сифилисом. При третичном, латентном сифилисе, нейросифилисе напряженность клеточного иммунитета несколько ниже, но все же довольно высока (Антоньев А.А. и соавт., 1977; Резникова Л.С. и соавт., 1980).
Рассматривая состояние клеточного иммунитета при сифилисе, нельзя не упомянуть о феномене суперинфекции, когда реакция организма больных сифилисом на новое заражение зависит от периода болезни. Как показали исследования, наиболее точной характеристикой сущности взаимоотношений возбудителя сифилиса и организма при суперинфекции является тканевая ареактивность. В свете полученных данных об активации супрессии при ранних формах сифилиса можно объяснить характерные черты иммунной реакции и клинической картины болезни. Так, депрессию иммунного ответа, выявленную у больных с ранними формами сифилиса на примерах РБТЛ, РТМЛ, ЦЭЛ правильнее рассматривать не как отсутствие клонов антигенореактивных клеток вследствие их элиминации, а как стимуляцию супрессорных регуляторных механизмов. Помимо выявленных сывороточных факторов изменения количественного содержания иммунокомпетентных клеток, активация Т-супрессоров являются главными факторами в поддержании толерантности организма к возбудителю. Снижение иммунного ответа, выявляемое в РБТЛ, РТМЛ, ЦЭЛ, Е-розеткообразование, иммунорегуляторном коэффициенте сопровождается высоким уровнем индекса супрессии (Мануйлова Л.А., 1987; Цераиди Н.Ф., 1987; Соколовский Е.В. и соавт., 1996). Одним из возможных объяснений падения содержания Т-лф и индекса Т-х / Т-с в крови больных может быть присутствие ЦИК, блокирующих Fc-рецепторы на лимфоцитах с нарушением регуляции их функционирования (Цераиди Н.Ф., 1986). Показано, что больные сифилисом после появления первичного аффекта не реагируют сколько-нибудь заметным образом на новое заражение извне – состояние, характеризуемое как “шанкерный иммунитет” (Зорин П.М., Кондратенко Л.А., 1979; Цераиди Н.Ф., 1987). Однако, если рассматривать первичную сифилому как проявление ГЗТ (Родин Ю.А., Звягницева Л.Е., 1978; Зорин П.М., Кондратенко Л.А., 1979; Резникова Л.С. и соавт., 1980; Цераиди Н.Ф., 1987), помимо прямого ингибиторного влияния возбудителя на ткани, отсутствие иммунного ответа является следствием преимущественной активации супрессорных клеток, отвечающих за формирование ГЗТ in vivo. На это указывает то, что антигенспецифические Т-супрессоры содержат клетки памяти, которые обеспечивают глубокое подавление иммунного ответа при повторном контакте с антигеном. Наблюдаются так называемые конкурентные взаимоотношения между клеточным иммунным ответом, депрессия которого сопровождается отсутствием резистентности к интрацеллюлярным микроорганизмам, и гуморальным иммунитетом, активация которого уже при раннем сифилисе не обеспечивает все же уничтожение возбудителя (Цераиди Н.Ф., 1987; Соколовский Е.В. и соавт., 1996).
Патогенез последовательных шанкров при первичном сифилисе и гранулемы при третичном отражает функциональную активность мононуклеаров, участвующих в формировании ГЗТ (вследствие увеличения антигенреактивных клеток) и определяющих резистентность к инфекциям (вследствие активации макрофагов лимфоцитами и формирования эпителиоидных клеток), и поэтому не является показательным для отличия кожной анергии от явлений резистентности. Папулезные и розеолезные сифилиды, появляющиеся вследствие внедрения инфекции у больных вторичным сифилисом, являются отражением чувствительности организма к суперинфекции, что влечет за собой характерную клиническую симптоматику, обусловленную функционированием гуморального звена и действием механизмов ГНТ при депрессии клеточно-опосредованного иммунитета. При наличие резистентности происходит уничтожение возбудителя без гематогенной диссеминации инфекции, а на месте внедрения возбудителя отмечаются клинические проявления ГЗТ (Зорин П.М., Кондратенко Л.А., 1979; Цераиди Н.Ф., 1987).
Функциональная активность лимфоцитов, ответственных за ГЗТ и клеточный иммунитет, возрастает по мере увеличения длительности инфекции и не зависит от наличия или отсутствия возбудителя; так называемый “вертикальный спектр” иммунного реагирования – предопределенное, зависящее от временного интервала изменение (увеличение) резистентности к инфекции. На это указывает отсутствие повторного заражения у больных с поздними формами сифилиса, когда на месте внедрения возбудителя наблюдается гиперэргическая (гранулематозная) реакция – показатель высокой степени резистентности к инфицирую-щему агенту (Цераиди Н.Ф., 1987).
Раздел: Медицина, здоровье
Количество знаков с пробелами: 101439
Количество таблиц: 9
Количество изображений: 10
… тестам относят определение количества нейтрофилов, изучение их морфологии и образования активных форм кислорода, к развернутым- определение киллинга микробов, лизосомальных ферментов, цитокинов. Существующие методы оценки иммунного статуса постоянно совершенствуются, однако есть ряд общих правил, которых необходимо придерживаться при оценке иммунограмм: — комплексный анализ, а не оценка одного …
… вновь стала расти. Так, за 1993г. зарегистрировано > 60 случаев. Классификация врожденного сифилиса. Врожденный сифилис делят на: 1) сифилис плода, 2) ранний врожденный сифилис (от момента рождения ребенка до 2-х лет), 3)поздний врожденный сифилис (у детей старше 4-х лет), 4) скрытый врожденный сифилис, наблюдающийся во всех возрастных группах. СИФИЛИС ПЛОДА. Врожденный сифилис является …
… на его
течение профессиональные
вредности и
стрессовые
ситуации. Все
это необходимо
учитывать при
диагностике
и лечении
атопического
дерматита у
пациентов
разных возрастных
группК
л и н и ч е с к и
е ф о р м ы а т о
п и ч е с к о г о д е р м а т и т а. Единой
классификации
форм атопического
дерматита в
литературе
нет.
Многие
авторы, в зависимости
от возраста
больных выделяют
несколько форм
…
… проблема врачей и работников здравоохранения, но и ученых многих специальностей, государственных деятелей и экономистов, юристов и социологов. 2. Туберкулез Среди заболеваний, относящихся к социальным болезням, особое место занимает туберкулез. Социальная природа туберкулеза известна давно. Еще в самом начале XX века эту болезнь называли «сестрой бедности», «пролетарской болезнью». В старом …
