Лекция по инфекционным болезням иммунитет
Теория по иммунологии. Оценка иммунного статуса, аллергия, иммунитет при бактериальных, вирусных, грибковых, протозойных, глистных инфекциях; новообразования.
При создании данной страницы использовалась лекция по соответствующей теме, составленная Кафедрой репродуктивного здоровья человека ИДПО с курсом иммунологии
Навигация:
- Оценка уровня естественной резистентности
- Оценка иммунного статуса
- Исследование Т-системы иммунитета
- Исследование В-системы иммунитета
- Диагностические мероприятия при аллергических заболеваниях
- Особенности иммунитета при бактериальных инфекциях
- Особенности противовирусного иммунитета
- Особенности противогрибкового иммунитета
- Особенности иммунитета при протозойных инвазиях
- Особенности противоглистного иммунитета
- Трансплантационный иммунитет
- Иммунитет против новообразований
Иммунодиагностика – это решение двух вопросов:
- Изменена ли иммунологическая реактивность организма?
- Если она изменена, в чем выражено это изменение и в какой степени?
Методы исследования иммунологической реактивности:
- оценка уровня естественной резистентности;
- оценка уровня иммунного статуса.
Оценка уровня естественной резистентности
Исследование клеточных факторов неспецифической резистентности
1. Определение бактерицидной активности кожи путем посевов-отпечатков по методу Клемпарской (N>95%).
2. Определение фагоцитарной активности лейкоцитов.
- Фагоцитарный показатель (N=79%).
- Фагоцитарный индекс (N=1,3-3,0, для частиц латекса=10,2).
- Завершенность фагоцитоза.
- НСТ-тест – способность фагоцитирующих клеток (супероксидные радикалы) восстанавливать бесцветный реактив нитросиний тетразоль в краситель, окрашивающий активную клетку в синий цвет (N=48-80%).
Исследование гуморальных факторов неспецифической резистентности:
- уровень комплемента в сыворотке крови;
- содержание лизоцима в слюне или сыворотке крови;
- титры сывороточных β – лизинов;
- С-реактивный белок в сыворотке крови;
- сывороточный интерферон.
Оценка иммунного статуса
Исследование Т-системы иммунитета
1. Количественное определение Т-лимфоцитов:
- в реакции розеткообразования с бараньими эритроцитами (ЕРОК) (N=50-76%).
- Розеткой считается лимфоцит, прикрепивший не менее 3 эритроцитов.
- по кластерам дифференцировки CD-2 и CD-3 с диагностическими меченными моноклональными антителами в непрямых вариантах реакции иммунофлюоресценции (РИФ) и иммуноферментного анализа (ИФА).
2. Определение CD4+ и CD8+ лимфоцитов и их соотношения:
- в непрямой РИФ с моноклональными антителами. (NCD4+=31-46% всех Т-лимфоцитов, а NCD8+=30-35%. Соотношение CD4+ : CD8+ = 1,0:2,2 – 1,0:1,5)
3. Функциональная активность Т-лимфоцитов:
- реакция бластной трансформации (РБТ) (N=20-100%);
- цитотоксическая функция Т-клеток в реакциях с клетками мишенями;
- реакция торможения миграции лейкоцитов (РТМЛ).
Исследование В-системы иммунитета
1. Количественное изучение В-лимфоцитов:
- в реакции розеткообразования с эритроцитами мышей (ЕАРОК);
- в реакции розеткообразования с бараньими эритроцитами, сенсибилизированными антителами и комплементом (ЕАСРОК) (N=10-20%);
- по кластерам дифференцировки CD-19, 20, 22 в непрямой РИФ и ИФА.
2. Определение функциональной активности В-лимфоцитов:
- РБТ;
- уровень нормальных антител в реакции агглютинации (РА) с эритроцитами барана и с микробными антигенами;
- содержание иммуноглобулинов классов G, М, А методом Манчини (реакция преципитации в геле), непрямым ИФА и радиоиммунным анализом (РИА). N IgM=109 МЕ/мл (0,5 – 1,9 мг/мл) N IgG=233 МЕ/мл (8,0 –16,0 мг/мл) N IgA=147 МЕ/мл (1,4 – 4,2 мг/мл).
Практическое использование методов исследования иммунной системы
- Оценка состояния иммунной системы (оценка иммунного статуса).
- Серотипирование бактериальных и вирусных культур, выделенных из организма человека.
- Серодиагностика инфекционных болезней.
- Выявление иммунопатологических состояний.
- Определение состава и характеристики тканей человека: групп крови, Rh-фактора, HLA антигенов.
- Выявление в организме человека или во внешней среде любых веществ, обладающих антигенными свойствами (гормонов, ферментов, ядов, лекарств, наркотических средств).
Оценка иммунного статуса:
I этап – клиническая долабораторная диагностика иммунодефицитных и других иммунопатологических состояний:
- иммунологический анамнез (частота инфекционных заболеваний, характер их течения, выраженность температурной реакции, наличие очагов хронической инфекции);
- клинический анализ крови (содержание лейкоцитов, в т.ч. лимфоцитов, моноцитов, сегментоядерных);
- результаты бактериологического (вирусологического) и серологического исследований на бактерио- (вирусо-) носительство.
II этап предусматривает применение тестов 2-х уровней:
Тесты первого уровня позволяют выявить грубые нарушения функций иммунной системы:
- процентное содержание и абсолютное количество Т — и В-лимфоцитов;
- уровень иммуноглобулинов сыворотки крови классов М, G, А, Е;
- титр комплемента;
- фагоцитарная активность нейтрофилов.
Тесты второго уровня проводятся при выявлении грубых нарушений функции иммунной системы и включают углубленное иммунологическое обследование для установления регуляторных нарушений и дисфункций иммунитета:
- субпопуляции Т-лимфоцитов (CD4+, CD8+), их соотношение;
- функциональная активность Т- и В-лимфоцитов в РБТ и РТМЛ;
- цитотоксическая активность лейкоцитов;
- кожные тесты.
Диагностические мероприятия при аллергических заболеваниях
- аллергологический анамнез (наличие аллергических реакций на антибиотики, пищевые продукты, пыльцу растений и т. д.);
- данные клинико-лабораторных исследований (лейкоцитоз, эозинофилия);
- при аллергических реакциях I – содержание сывороточного JgE;
- при аллергических реакциях II типа – выявление в сыворотке крови антиэритроцитарных, антилейкоцитарных, антитромбоцитарных антител, оказывающих цитолитическое действие в присутствии комплемента на клетки-«мишени»;
- при аллергических реакциях III типа – иммунные комплексы, циркулирующие в крови или фиксированные на тканях органа- «мишени»;
- для изучения клеточно-опосредованной сенсибилизации при аллергии IV типа проводят РБТ и РТМЛ;
- при реакциях I и IV типов проводят кожно-аллергические пробы.
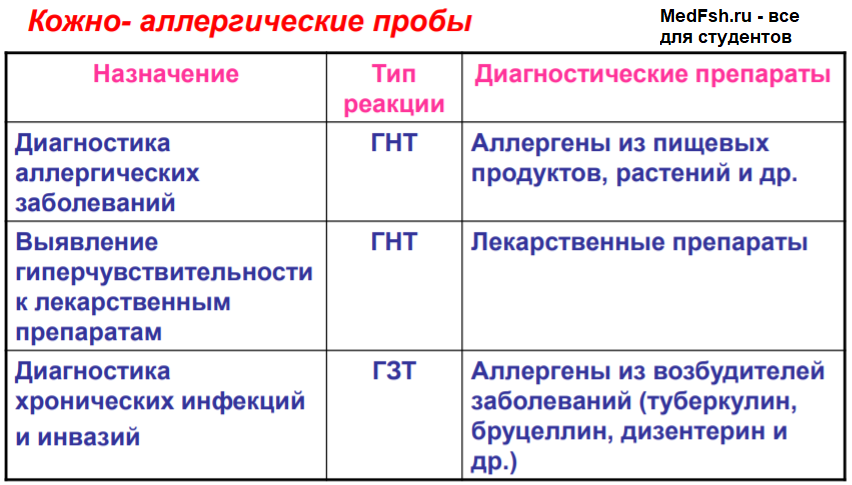
Метод кожных проб основан на том, что Ig Е находится не только в шоковом органе, но и в коже. В месте введения аллергена происходит аллергическая реакция АГ-АТ с высвобождением гистамина (через 20-30 минут – покраснение, волдырь).
Выраженность кожной реакции зависит от степени сенсибилизации организма.
В основе кожных проб на внутрикожное введение аллергена в специфически сенсибилизированный (инфицированный или вакцинированный) организм лежат аллергические реакции клеточного типа (на месте введения – через 24-48 часов образуется мононуклеарный инфильтрат, величина которого зависит от степени сенсибилизации).
Практическое применение:
- диагностика туберкулеза (проба Манту с туберкулином);
- диагностика туляремии (проба с тулярином);
- диагностика дизентерии (проба Цуверкалова с дизентерином) и т. д.
Лабораторная диагностика аутоиммунных процессов осуществляется с помощью выявления аутоантител и циркулирующих иммунных комплексов методом осаждения полиэтиленгликолем.
Особенности иммунитета при бактериальных инфекциях
- Иммунная реакция макроорганизма в ответ на бактериальную инфекцию в значительной степени определяется факторами патогенности микроба и в первую очередь его способностью к токсинообразованию. Различают иммунитет антибактериальный — против структурных компонентов бактериальной клетки и антитоксический — против белковых токсинов.
- Основными факторами антибактериальной защиты являются антитела и фагоциты. Антитела эффективно инактивируют биологически активные молекулы бактериальной клетки (токсины, ферменты агрессии и др.), маркируют их, запускают антителозависимый бактериолиз и иммунный фагоцитоз. Фагоциты непосредственно осуществляют фагоцитоз, в том числе иммунный, антителозависимый бактериолиз и внеклеточный киллинг патогена при помощи ион-радикалов и ферментов. Важная роль в борьбе с грамположительными микробами принадлежит лизоциму, а с грамотрицательными — комплементу (альтернативный путь активации), кроме того, существенное значение имеют белки острой фазы (С-реактивный и маннозосвязывающий протеин).
- Ряд бактерий, относящихся к факультативным внутриклеточным паразитам, отличается повышенной устойчивостью к действию комплемента, лизоцима и фагоцитов (незавершенный фагоцитоз). К их числу относятся микобактерии, йерсинии, бруцеллы, сальмонеллы и некоторые другие. В такой ситуации макроорганизм вынужден переключать нагрузку на клеточное звено иммунитета, что ведет к аллергизации организма по механизму ГЗТ. Особое значение приобретают активированные макрофаги и естественные киллеры, осуществляющие АЗКЦТ, а такжеТ-лимфоциты.
- Напряженность специфического антибактериального иммунитета оценивают в серологических тестах по титру или динамике титра специфических антител, а также по состоянию клеточной иммунореактивности (например, по результатам кожно-аллергической пробы).
Особенности противовирусного иммунитета
- Особенности иммунной защиты макроорганизма при вирусных инфекциях обусловлены двумя формами существования вируса: внеклеточной и внутриклеточной. Основными факторами, обеспечивающими противовирусный иммунитет, являются специфические антитела, Т-киллеры, естественные киллеры, интерферон и сывороточные ингибиторы вирусных частиц.
- Специфические противовирусные антитела способны взаимодействовать только с внеклеточным вирусом, так как у них нет доступа внутрь живой клетки. Антитела нейтрализуют вирусные адгезины и нейраминидазы, препятствуя адсорбции вирусов на клетках-мишенях и их инфицированию. Они также связывают вирусные белки и нуклеиновые кислоты, образовавшиеся после разрушения зараженных вирусами клеток. Сформировавшиеся иммунные комплексы элиминируются путем иммунного фагоцитоза.
- Клетки, инфицированные вирусом и приступившие к его репликации, экспрессируют вирусные белки на цитоплазматической мембране в составе молекул антигенов гистосовместимости — MHC I класса. Измененная структура MHC I класса этих антигенов гистосовместимости является маркером для Т-киллеров, которые распознают зараженные вирусом клетки и уничтожают их.
- Мощным противовирусным свойством обладает интерферон. Он не действует непосредственно на внутриклеточный вирус, а связывается с рецептором на мембране клетки и подавляет в ней все биосинтетические процессы.
- Напряженность противовирусного иммунитета оценивают преимущественно в серологических тестах по нарастанию титра специфических антител в парных сыворотках в процессе болезни. Определяют также концентрацию интерферона в сыворотке крови.
Особенности противогрибкового иммунитета
- Антигены грибов имеют относительно низкую иммуногенность: они практически не индуцируют антителообразование (титры специфических антител остаются низкими), но стимулируют клеточное звено иммунитета. Основными действующими факторами противогрибкового иммунитета являются активированные макрофаги, которые осуществляют АЗКЦТ грибов.
- При микозах наблюдается аллергизация макроорганизма. Кожные и глубокие микозы сопровождаются, как правило, ГЗТ. Грибковые поражения слизистых оболочек дыхательных и мочеполовых путей вызывают аллергизацию по механизму ГНТ (реакция I типа). Напряженность противогрибкового иммунитета оценивается по результатам кожно-аллергических проб с грибковыми аллергенами.
Особенности иммунитета при протозойных инвазиях
- Паразитарная инвазия сопровождается формированием в макроорганизме гуморального и клеточного иммунитета. В крови определяются специфические антитела классов M и G, которые чаще всего не обладают протективным свойством. Однако они активируют АЗКЦТ с участием макрофагов, а в случае внутриклеточного паразитирования — естественных киллеров и T лимфоцитов. Паразитарные инвазии сопровождаются аллергизацией макроорганизма по механизму ГЗТ.
- Характер противопаразитарного иммунитета определяется биологическими особенностями паразита. Многие паразиты обладают высокой антигенной изменчивостью, что позволяет им избегать действия факторов иммунитета. Например, каждой стадии развития малярийного плазмодия соответствуют свои специфические антигены.
- Напряженность противопаразитарного иммунитета оценивается в серологических тестах по титру специфических антител и в кожноаллергических пробах с протозойным антигеном.
Особенности противоглистного иммунитета
- Ведущую роль в осуществлении иммунной защиты макроорганизма от глистной инвазии играют эозинофилы, которые осуществляют АЗКЦТ. Эти клетки распознают паразитов, отмеченных специфическими IgE или IgA. Активированный эозинофил выделяет путем дегрануляции ряд токсичных субстанций (ферменты, белковые токсины), губительно действующих на гельминты.
- Антигены гельминта, связываясь также с рецепторными комплексами тучных клеток слизистой оболочки, вызывают их дегрануляцию. Экскретированные биологически активные соединения вызывают интенсивную перистальтику, удаляющую паразита или его останки из просвета кишки.
- Эозинофилы и тучные клетки синтезируют цитокины и липидные медиаторы, потенцирующие воспалительную реакцию в месте внедрения гельминта. Глистная инвазия сопровождается аллергизацией в основном по механизму ГЗТ.
Трансплантационный иммунитет
- Макроорганизм формирует иммунную реакцию, направленную против пересаженной в него чужеродной ткани (трансплантата). Это является основной проблемой, препятствующей успешной пересадке органов и тканей. Иммунная реакция на чужеродные клетки и ткани обусловлена тем, что в их составе содержатся генетически чужеродные для организма антигены. Эти антигены получили название трансплантационных или антигенов гистосовместимости. Наиболее полно они представлены на цитоплазматической мембране клеток.
- Реакция отторжения не возникает в случае полной совместимости донора и реципиента по антигенам гистосовместимости — такое возможно лишь для однояйцовых близнецов. Выраженность реакции отторжения во многом зависит от степени чужеродности, объема трансплантируемого материала и состояния иммунореактивности реципиента.
- На чужеродные трансплантационные антигены организм реагирует факторами клеточного и гуморального иммунитета. Основным являются Т-киллеры и специфические антитела. Т-киллеры осуществляют АНКЦТ тканей трансплантата (реакция реципиент против трансплантата) или реципиента (реакция трансплантат против реципиента). Специфические антитела, которые образуются к антигенам трансплантата, запускают комплемент- или клеточно-опосредованный цитолиз трансплантата.
- Возможен адаптивный перенос трансплантационного иммунитета с помощью активированных лимфоцитов или со специфической антисывороткой от сенсибилизированной особи интактному макроорганизму.
- Механизм иммунного отторжения пересаженных клеток и тканей имеет две фазы. В первой фазе вокруг трансплантата и сосудов наблюдается скопление иммунокомпетентных клеток (лимфоидная инфильтрация), в том числе Т-киллеров. Во второй фазе происходит деструкция клеток трансплантата Т-киллерами, активируются макрофагальное звено, естественные киллеры, специфический антителогенез. Затем возникают иммунное воспаление, тромбоз кровеносных сосудов, нарушается питание трансплантата и происходит его гибель. Разрушенные ткани утилизируются фагоцитами. Ткани трансплантата реагируют на ткани реципиента подобным же образом. Однако иммунная реакция трансплантата слабее, так как ограничена его ресурсами.
- В процессе реакции отторжения формируется клон клеток иммунологической памяти. Повторная попытка пересадки тех же органов и тканей вызывает вторичный иммунный ответ, который протекает очень бурно и быстро заканчивается отторжением трансплантата.
Иммунитет против новообразований
- Противоопухолевый иммунитет имеет свои особенности, связанные с низкой иммуногенностью раковых клеток. Эти клетки практически не отличаются от нормальных, интактных морфологических элементов собственного организма. Специфический антигенный репертуар опухолевых клеток также скуден.
- В число опухоль-ассоциированных антигенов входят группа раково-эмбриональных антигенов, продукты онкогенов, некоторые вирусные антигены и гиперэкспрессируемые нормальные белки. Слабому иммунологическому распознаванию опухолевых клеток способствуют отсутствие воспалительной реакции в месте онкогенеза, их иммуносупрессивная активность — биосинтез ряда негативных цитокинов (β-ТФР и др.), а также экранирование раковых клеток противоопухолевыми антителами.
- Механизм противоопухолевого иммунитета до сих пор слабо изучен. Считается, что основную роль в нем играют активированные макрофаги, определенное значение имеют также естественные киллеры. Защитная функция гуморального иммунитета во многом спорная — специфические антитела могут экранировать антигены опухолевых клеток, не вызывая их цитолиза.
- В последнее время получила распространение иммунодиагностика рака, которая основана на определении в сыворотке крови раково-эмбриональных и опухоль-ассоциированных антигенов. Так, в настоящее время удается диагностировать некоторые формы рака печени, желудка, кишечника, простаты и др.
- Между состоянием иммунной защиты и развитием новообразований существует тесная связь. Злокачественные новообразования наблюдаются чаще у индивидуумов с иммунодефицитами и престарелых (в связи с понижением активности иммунной системы). Иммуносупрессивная химиотерапия также нередко сопровождается пролиферативными процессами. Поэтому в лечении опухолей нашли применение иммуномодуляторы (интерлейкины, интерфероны), а также адъюванты (мурамилдипептиды, вакцина БЦЖ и др.).
3
0

КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
- Понятие об инфекции
- Факторы, определяющие возникновение и развитие инфекции
- Иммунитет
1. Понятие об инфекции
инфекция — это комплекс биологических процессов, которые возникают в результате проникновения патогенных микробов в макроорганизм.
Инфекция может протекать скрыто и с видимыми признаками. Клиническое проявление процесса называют инфекционной болезнью. Признаки болезни могут быть выражены по-разному, их форма бывает яркой, стертой, атипичной и т. д. Знание их имеет большое значение для своевременного и правильного определения болезни.
Инфекционный процесс включает внедрение, размножение и распространение возбудителя, и реакцию организма возбудителя.
Инфекционная болезнь от неинфекционной отличаетсятем, что она вызывается живым возбудителем или высокомолекулярными структурами (ДНК или РНК) — носителями генетической информации у вирусов идругих организмов. Специфической причиной инфекции является микроорганизм, но развитие инфекционной болезни во многом обусловливается состоянием защитных сил макроорганизма.
В возникновении и развитии инфекционного процесса — взаимодействии между макро- и микроорганизмом, которое приводит к нарушению гомеостаза (относительное динамическое постоянство состава и физиологических функций внутренней среды), участвует весь организм как целостная система в единстве с окружающей средой. Это в одинаковой степени относится как к макро-, так и к микроорганизму.
Инфекционный процесс включает в себя следующие периоды:
1. Инкубационный – промежуток времени от момента проникновения микроба до проявления определенных признаков.
2. Продромальный период – характеризуется общими симптомами болезни: повышение температуры, слабость, угнетение, потеря аппетита.
3. Клинический период – развитие основных признаков, характерных для данной инфекции: нарушение пищеварения, нервной системы, дыхания и т.д.
4. Период выздоровления – наступает при благоприятном исходе. Постепенно восстанавливаются физиологические функции организма. Клиническое выздоровление не всегда совпадает с освобождением организма от возбудителя.
Формы инфекции. Та инфекция, при которой микробы размножаются в крови, а следовательно, проникают во все органы и ткани, называется септицемией. Она протекает быстро и обычно заканчивается смертью. Форма инфекции, при которой кровь служит только для переноса микробов, а размножение их происходит в других тканях, называется бактериемией. Если микро бы, размножаясь в поврежденной ткани, образуют токсины, которые затем попадают в кровоток, то такая форма инфекции называется токсемией.
Для микроорганизма (возбудителя) внешней средой является макроорганизм, то есть те ткани, в которых он развивается. Проникновение микробов в организм животного не всегда приводит к развитию инфекции. Для этого необходимы определенные условия и свойства возбудителя.
Факторы, определяющие возникновение и развитие инфекции.Возникновение и развитие инфекции в основном зависит от следующих факторов: а) степени пато-генности микроба; б) иммунологического состояния макроорганизма; в) условий внешней среды.
А) Патогенность— видовой признак микроба, способность его при соответствующих условиях вызывать характерное для него инфекционное заболевание. Микроб не вызовет болезнь, если он не обладает вирулентностью.
Вирулентность — индивидуальный признак каждого штамма, это мера его патогенности. Она проявляется в способности микроба проникать в органы и ткани, размножаться в них, вырабатывать вещества, которые могут подавлять защитные силы макроорганизма. Вирулентность может быть разной у микробов одного и того же вида и зависит от многих причин. Ее определяют путем заражения восприимчивых животных. При этом одни из них могут погибать через день, а другие — через три дня. Следовательно, тот штамм который вызвал смерть через день, имел более высокую вирулентность, чем тот, который привел ктаким же последствиям через три дня. За единицу вирулентности принята минимальная смертельная доза (DLM — dosis letalis minima). Это наименьшее количество микробных клеток, способное вызвать гибель восприимчивых животных. Вирулентность — величина непостоянная, на нее оказывают влияние многие факторы. Так, при пассаже через восприимчивый организм она возрастает и, наоборот, культивирование микробов в неблагоприятных условиях понижает ее.
Факторы, обусловливающие вирулентность.
1. Инвазивность — способность микроорганизмов проникать, распространяться и размножаться в тканях макроорганизма. Некоторые микроорганизмы образуют вещества, которые в сочетании с их продуцентами подавляют защитные силы макроорганизма, главным образом фагоцитоз. В состав таких комплексов входят и ферменты (гиалу-ронидаза, коллагеназа, лецитиназа, нейраминидаза и др.). Так, фермент гиалуронидаза гидролизует гиалу-роновую кислоту — основной компонент соединительной ткани; коллагеназа — разрушает коллаген и т. д. Все это повышает проницаемость тканей, увеличивает степень инвазивности и вместе с другими факторами способствует развитию инфекционного процесса.
2. Токсины — ядовитые вещества, образуемые микроорганизмами. Различают экзо- и эндотоксины. Экзотоксины (белки)—продукты жизнедеятельности микробов, выделяемые во внешнюю среду или освобождаемые после их гибели. Эндотоксины — прочно связаны с телом микробной клетки, главным образом с ее стенкой. Представляют молекулярные комплексы грамотрицательных бактерий, состоящих из белков, липидов и полисахаридов, которые освобождаются только после их разрушения.
Экзотоксины высокотоксичны, термолабильны, разрушаются, как и другие белки, при температуре 60—80°С в течение нескольких минут, при кипячении — мгновенно, чувствительны к действию света. Сохраняются в высушенном состоянии и при низкой температуре. Избирательно действуют на органы и ткани: разрушают субклеточные структуры, нарушают функции клеток. Так, столбнячный токсин поражает двигательные нейроны спинного мозга, вызывает тонические сокращения мышц и клонические судороги. Ботулинический токсин (нейро-токсин) действует на черепномозговые нервы и вызывает расстройство зрения, акта глотания, паралич дыхания и другие явления. Его можно выделить изкультуральной жидкости путем отделения клеток фильтрованием. Синтез микробных экзотоксинов происходит под влиянием генов, локализованных в плазмидах или профагах. Удаление плазмид или профага из клетки делает ее нетоксичной, введение плазмид или профага в клетку восстанавливает процесс токсинообразования. Заболевание, вызываемое токсином, возникает через некоторое время после проникновения его продуцента в организм. Инкубационный период колеблется от нескольких часов до нескольких дней. Токсины обладают свойством ферментов и являются сильными биологическими ядами.
Эндотоксины менее токсичны. В отличие от экзотоксинов они термостабильны, выдерживают кипячение и стерилизацию при 120°Сдо 30 мин. комплексу антигенные свойства. Быстрое разрушение грамотрицательных микробов в организме может ускорить гибель животного, что необходимо учитывать при назначении сильнодействующих лечебных средств.
Имеются микроорганизмы, которые образуют экзо- и эндотоксины (холерный вибрион, гемолитические штаммы эшерихий).
3. Образование капсулы. Капсулообразование не является видовым признаком. Микробы одного и того же вида могут иметь капсульные и бескапсульные штаммы. Капсулы выполняют защитную функцию, повышают резистентность к фагоцитозу, у патогенных микробов обусловливают вирулентность. Так, возбудитель сибирской язвы в организме образует капсулу и, как известно, быстро вызывает смерть. Но из бескапсульного штамма сибиреязвенного микроба готовят вакцину (СТИ), которая не только не приводит животное к гибели, а, наоборот, сообщает ему невосприимчивость к такому же патогенному микробу.
Б) Роль иммунологического состояния макроорганизма
Возникновение инфекции и ее развитие во многом зависят от реактивности макроорганизма. Проникновение возбудителя в организм не всегда приводит к развитию инфекции. Микробы в организм проникают определенными путями, которые называют входными воротами инфекции. Заразное начало в организм чаще попадает через пищеварительный тракт (с кормом и водой) и органы дыхания. Воротами инфекции могут быть также: поврежденная кожа, слизистые глаз, мочеполовых путей.
В организме микробы встречают множество естественных преград: неповрежденные ткани, цидные вещества, выделяемые организмом (лизоцим идр.). Иногда микробы попадают непосредственно в кровоток и распространяются в организме по кровяному руслу (гемато-генный путь). Часть из них на пути следования погибает, и остаются лишь наиболее приспособленные к новым условиям среды. При такой инфекции, как бешенство, возбудитель (вирус) перемещается к месту локализации по нервной ткани (неврогенный путь), а если такую ткань перерезать, заболевания не произойдет.
С пораженной ткани процесс может распространяться на однородную здоровую ткань. Такое явление чаще наблюдается при поражении органов дыхания. Достигнув определенного органа, микробы начинают размножаться: выделяют токсины, образуют капсулы, подавляют защитные силы организма. Органотропность наиболее ярко выражена у возбудителя туберкулеза, местом локализации которого чаще всего бывает легочная ткань. Для некоторых вирусных инфекций (ящур, оспа) таким местом является эпителиальная ткань. Но это не означает, что возбудитель не попадает в другие ткани. Все органы единого организма связаны между собой, поэтому нарушение функции одного из них ведет к изменению физиологического равновесия всего организма.
В инфекционном процессе ведущая роль принадлежит макроорганизму. Ко многим инфекциям животные имеют естественный (конституциональный) иммунитет. Например, крупный рогатый скот не болеет сапом лошадей, которые, в свою очередь, нечувствительны к чуме свиней и т. д. В возникновении инфекции не менее важное значение имеют возраст животного, уровень кормления, другие факторы.
Возраст. Реактивность молодых животных низка: они малочувствительны к раздражителям, в их организме недостаточно антител. Имеются инфекции, которые встречаются главным образом у молодых животных. Так, телята и молодняк некоторых других видов животных сразу же после рождения могут заболевать эшерихиозом (коли-бактериозом).
Кормление. Большое значение в борьбе организма с инфекцией имеет кормление. Оно должно быть не только достаточным, но и доброкачественным (полноценным). Недостаток протеина, витаминов, макро- и микроэлементов отрицательно сказывается на сопротивляемости организма. При этом нарушается обмен веществ, уменьшается количество иммуноглобулинов (антител). Если в рационе недостает витамина А, то в организме нарушаются окислительные процессы, понижается защитная функция кожных и слизистых покровов. При недостатке витаминов группы В наблюдается подавление фагоцитарной активности лейкоцитов, распространение микробов по организму и т. д. Авитаминоз С ведет к повреждению слизистых оболочек и тем самым открывает путь возбудителям болезней. Высокая продуктивность животных иногда понижает резистентность организма, в связи с чем они бывают склонны к заболеванию туберкулезом и другими инфекциями.
В) Влияние условий среды на возникновение и развитие инфекционного процесса
Повышенная влажность, содержание в воздухе взвешенных частиц корма, образование ядовитых продуктов распада белка (аммиак) и других веществ, плохая вентиляция — все это понижает сопротивляемость организма, открывает «ворота» для возбудителей болезней и способствует поражению органов дыхания, пищеварения, кожи. Чем больше скученность животных, тем вероятнее контакт между ними, а следовательно, выше процент случаев кожных и других заболеваний.
. Резкое изменение температуры, переохлаждение или перегревание организма также понижают его резистентность и создают благоприятные условия для развития патогенных микроорганизмов. Значение температуры в возникновении инфекции можно продемонстрировать на следующем примере. Куры обычно не болеют сибирской язвой, так как температура их тела в 42°С неблагоприятна для развития возбудителя. Но если организм курицы охладить путем погружения ее конечностей в холодную воду (по Л. Пастеру) и в это время ввести возбудителя болезни (сибирской язвы), то птица заболевает. Данный пример показывает, что в возникновении и развитии инфекции большую роль играет влияние физических факторов на организм животного.
Дата добавления: 2014-01-06; Просмотров: 3281; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Рекомендуемые страницы:
Читайте также:
