Механизм киллинга врожденного иммунитета

Врождённый
иммунитет — наиболее ранний защитный
механизм как в эволюционном плане (он
существует практически у всех
многоклеточных), так и по времени ответа,
развивающегося в первые часы и дни после
проникновения чужеродного материала
во внутреннюю среду, т.е. задолго до
развития адаптивной иммунной реакции.
Значительную часть патогенов инактивируют
именно врождённые механизмы иммунитета,
не доводя процесс до развития иммунного
ответа с участием лимфоцитов. И только
если механизмы врождённого иммунитета
не справляются с проникающими в организм
патогенами, в «игру» включаются лимфоциты.
При этом адаптивный иммунный ответ
невозможен без вовлечения механизмов
врождённого иммунитета. Кроме того,
врождённый иммунитет играет главную
роль в удалении апоптотических и
некротических клеток и реконструировании
повреждённых органов. В механизмах
врождённой защиты организма важнейшую
роль играют первичные рецепторы для
патогенов, система комплемента, фагоцитоз,
эндогенные пептиды-антибиотики и факторы
защиты от вирусов — интерфероны. Функции
врождённого иммунитета схематично
представлены на рис. 3-1.
Рецепторы распознавания «чужого»
На
поверхности микроорганизмов
присутствуют повторяющиеся
молекулярные углеводные и липидные
структуры, которые
в подавляющем большинстве случаев
отсутствуют на клетках организма
хозяина. Особые рецепторы, распознающие
этот «узор» на поверхности патогена, —
PRR (Pattern
Recognition Receptors –РRP-рецептор)
— позволяют клеткам врождённого иммунитета
обнаруживать микробные клетки. В
зависимости от локализации выделяют
растворимые и мембранные формы PRR.
• Циркулирующие
(растворимые) рецепторы для
патогенов — белки сыворотки крови,
синтезируемые печенью: липополисахаридсвязывающий
белок (LBP — Lipopolysaccharide
Binding Protein), компонент
системы комплемента C1q и белки острой
фазы MBL и С-реактивный белок (СРБ). Они
непосредственно связывают микробные
продукты в жидких средах организма и
обеспечивают возможность их поглощения
фагоцитами, т.е. являются опсонинами.
Кроме того, некоторые из них активируют
систему комплемента.
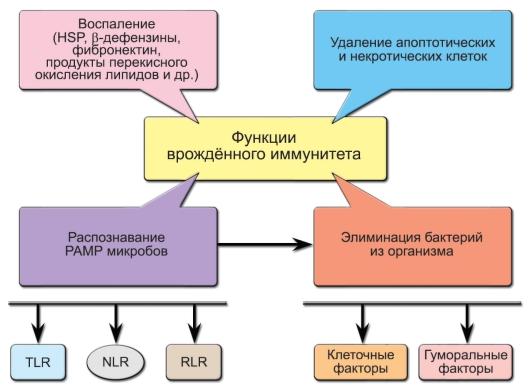
Рис.
3-1. Функции
врождённого иммунитета. Обозначения:
PAMP (PathogenAssociated
Molecular Patterns) —
молекулярные структуры микроорганизмов,
HSP (Heat
Shock Proteins) —
белки теплового шока, TLR (Toll-Like
Receptors), NLR (NOD-Like
Receptors), RLR (RIG-Like
Receptors) —
клеточные рецепторы
— СРБ, связывая
фосфорилхолин клеточных стенок ряда
бактерий и одноклеточных грибов,
опсонизирует их и активирует систему
комплемента по классическому пути.
— MBL принадлежит
к семейству коллектинов. Имея сродство
к остаткам маннозы, экспонированным на
поверхности многих микробных клеток,
MBL запускает лектиновый путь активации
комплемента.
— Белки
сурфактанта лёгких — SP-A и SP-D принадлежат
к тому же молекулярному семейству
коллектинов, что и MBL. Они, вероятно,
имеют значение в опсонизации (связывании
антител с клеточной стенкой микроорганизма)
лёгочного патогена — одноклеточного
грибка Pneumocystis
carinii.
• Мембранные
рецепторы. Эти
рецепторы расположены как на наружных,
так и на внутренних мембранных структурах
клеток.
— TLR (Toll-Like
Receptor —
Toll-подобный рецептор; т.е. сходный с
Toll-рецептором дрозофилы). Одни из них
непосредственно связывают продукты
патогенов (рецепторы для маннозы
макрофагов, TLR дендритных и других
клеток), другие работают совместно с
иными рецепторами: например, CD14 молекула
на макрофагах связывает комплексы
бактериального липополисахарида (ЛПС)
с LBP, а TLR-4 вступает во взаимодействие с
CD14 и передаёт соответствующий сигнал
внутрь клетки. Всего у млекопитающих
описано 13 различных вариантов TLR (у
человека пока только 10).
• Цитоплазматические
рецепторы:
— NOD-рецепторы (NOD1
и NOD2) находятся в цитозоле и состоят из
трёх доменов: N-концевого CARD-домена,
центрального NOD-домена (NOD — Nucleotide
Oligomerization Domain —
домен олигомеризации нуклеотидов) и
C-концевого LRR-домена. Различие между
этими рецепторами заключается в
количестве CARD-доменов. Рецепторы NOD1 и
NOD2 распознают мурамилпептиды — вещества,
образующиеся после ферментативного
гидролиза пептидогликана, входящего в
состав клеточной стенки всех бактерий.
NOD1 распознаёт мурамилпептиды с концевой
мезодиаминопимелиновой кислотой
(meso-DAP), которые образуются только из
пептидогликана грамотрицательных
бактерий. NOD2 распознаёт мурамилдипептиды
(мурамилдипептид и гликозилированный
мурамилдипептид) с концевым D-изоглутамином
или D-глутаминовой кислотой, являющиеся
результатом гидролиза пептидогликана
как грамположительных, так и
грамотрицательных бактерий. Кроме того,
NOD2 имеет сродство к мурамилпептидам с
концевым L-лизином, которые есть только
у грамположительных бактерий.
— RIG-подобныерецепторы (RLR, RIG-Like
Receptors): RIG-I (Retinoic
acid-Inducible Gene I),
MDA5 (Melanoma
Differentiation-associated Antigen 5)
и
LGP2 (Laboratory
of Genetics and Physiology 2).
Все
три рецептора, кодируемые этими генами,
имеют сходную химическую структуру и
локализуются в цитозоле. Рецепторы
RIG-I и MDA5 распознают вирусную РНК. Роль
белка LGP2 пока неясна; возможно, он
выполняет роль хеликазы, связываясь с
двуцепочечной вирусной РНК, модифицирует
её, что облегчает последующее распознавание
с помощью RIG-I. RIG-I распознаёт односпиральную
РНК с 5-трифосфатом, а также относительно
короткие (<2000 пар оснований) двуспиральные
РНК. MDA5 различает длинные (>2000 пар
оснований) двуспиральные РНК. Таких
структур в цитоплазме эукариотической
клетки нет. Вклад RIG-I и MDA5 в распознавание
конкретных вирусов зависит от того,
образуют ли данные микроорганизмы
соответствующие формы РНК.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
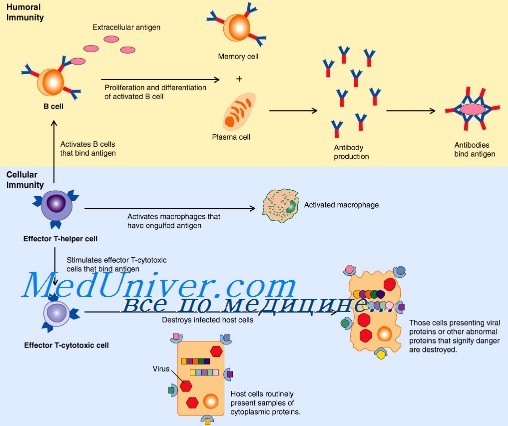
Врожденный иммунитет — иммунитет, с факторами защиты которого человек рождается. Действует против любого чужого тотчас, не запоминает патогена.
Для тех, кто преподаёт иммунологию
immunoanimations — immunbiology интерактивная
https://www.blink.biz/immunoanimations
- Восприимчивость = отсутствие сопротивления
- Резистентность = способность человека противостоять болезни
1. Неспецифическая резистентность / врожденный иммунитет — защита от любых патогенов, немедленная, без памяти
2. Специфическая резистентность / адаптивный иммунитет — защиты от конкретного патогена, требует времени для формирования, предполагает специализированные клетки, имеет память
В таблице 1 отражены компоненты неспецифической и специфической резистентности
Таблица 1 — Факторы, определяющие врожденный и адаптивный иммунитет | ||
Неспецифическая резистентность | Специфическая резистентность | |
Врожденный иммунитет | Адаптивный иммунитет | |
Первая линия защиты | Вторая линия защиты | Третья линия защиты |
|
| Специализированные лимфоциты:
|
Первая линия защиты:
не допустить вторжения патогенов (бактерии, вирусы, грибы, паразиты)
1). Кожа и слизистые оболочки
A. Физические факторы: барьеры или удаление
1. Кожа
(кожная мембрана = дерма + эпидермис)
Эпидермис:
— верхний слой — это мертвые клетки, заполненные кератином, клетки плотно связаны друг с другом
— сухой, неблагоприятный, постоянно слущиваемый
— непроницаемый, если только не поврежден или не влажный
2. Слизистые оболочки
— мягкий, влажный эпителий
— менее защитный, чем кератинизированный
— имеет бокаловидные клетки для продуцирования слизи
3. Цилиарный эскалатор
— реснитчатый эпителий дыхательных путей
— волновое движение ресничек: удаление микробов со слизью из дыхательных путей
4. Слезоточивый аппарат (слезные железы и слезные каналы)
— постоянные слезы на глазах вымывают микробы
5. Слюнные железы — омывание зубов и рта для уменьшения колонизации патогенами
6. Рвота и диарея
— быстрое сокращение желудочно-кишечного тракта для того,чтобы быстро удалить микробы и токсины
B. Химические факторы
1. Слизь
— гликопротеины + вода
— густая, препятствует колонизации
2. Кожное сало
— жиры из сальных желез
— жирные кислоты и молочная кислота определяют кислый pH (рН 3-5) кожи, который ингибирует рост микробов
3. Пот — вода + соли
— вода смывает микробы с кожи
— соли ингибируют рост микробов
4. Лизоцим
— фермент в большинстве секретов организма
— разрушает пептидогликаны клеточных стенок бактерий
5. Желудочный сок
— Соляная кислота + ферменты + слизь
— рН 1-3 уничтожает большинство бактерий и токсинов
2). Нормальная микробиота
- микробный антагонизм:
- конкуренция за питательные веществ или окружающую среду (pH, кислород)
- выделение токсинов (например, бактериоцины — белки, продуцируемые бактериями одного штамма, и активные против белков тесно связанного штамма)
Вторая линия обороны: если микробы преодолевают первый барьер, то система атакует и уничтожает их
3). Лейкоциты
Лейкоциты — это белые клетки крови. Обычно их содержание в циркуляции низкое, во время заражения стремительно повышается (лейкоцитоз) или снижается (лейкопения при действии некоторых патогенов). При активации большинство лейкоцитов продуцирует цитокины: межклеточные сигнальные молекулы / гормоны, которые функционируют как триггеры усиления и координации различных защитных механизмов. Типы лейкоцитов:
A. Гранулоциты ( в цитоплазме видимые гранулы)
1. Нейтрофилы или ПЯЛ (полиморфноядерные лейкоциты)
— 3 – 5 сегментов в ядре
— подвижные, первыми прибывают к месту травмы или инфекции
— преобладают на начальных этапах инфекции или травмы
— часто преобладают при бактериальных инфекционных заболеваниях
2. Базофилы (кровь) = тучные клетки ( в тканях)
— не фагоцитируют
— освобождают гистамин
— триггеры воспаления и аллергии
3. Эозинофилы
— подвижные
— слабые фагоциты
— продуцируют токсины для борьбы с многоклеточными паразитарными инфекциями
B. Агранулоциты (гранулы не видны)
1. Моноциты (кровь) = Макрофаги (активированные в тканях)
— высокая фагоцитарная способность
А. Оседлые макрофаги / гистиоциты
Присутствуют в определенных тканях / органах для улавливания патогенов и удаления поврежденных клеток (например, клетки Купфера (печень), микроглии (ЦНС), подоциты (почки), альвеолярные макрофаги (легкие)
В. Блуждающие / Свободные макрофаги
— перемещаются из крови в местам повреждения или инфекции
— приходят после нейтрофилов
— фагоцитируют остатки мертвых клеток
— доминируют на более поздних стадиях инфекции или травмы
— преобладают при грибковых или вирусных инфекционных заболеваниях
С. Дендритные клетки
— расположены в эпидермисе, слизистой мембране и лимфоидных тканях
— инициаторы адаптивного иммунного ответа
2.Лимфоциты = T, B и NK клетки (агранулоциты)
- Т-клетки: клеточный иммунитет
- В-клетки: опосредованный антителами иммунитет
- NK-клетки: неспецифические, их мишени инфицированные или раковые клетки
— освобождают перфорин и гранзимы
-специализированные клетки
— не фагоцитируют
— локализованы в лимфоидных тканях и крови
— B и T-клетки участвуют в специфической защите
— B и T-клетки реагируют на специфические антигены
Фагоциты
 Фагоциты = лейкоциты, специализированные к эндоцитозу микробов и клеточного мусора: нейтрофилы, макрофаги, эозинофилы.
Фагоциты = лейкоциты, специализированные к эндоцитозу микробов и клеточного мусора: нейтрофилы, макрофаги, эозинофилы.
Фагоциты мигрируют в место инфицирования и могут уничтожать бактерии. Фазами фагоцитоза являются хемотаксис, прилипание, поглощение и переваривание.
Фагоцитоз см. статью
1. Ингибирование прилипания или поглощения
- M. protien: Streptococcus pyogenes
- Капсулы: Streptococcus pneumoniae
- Биопленки: предотвращение отрыва отдельных микробов
2. Выживающий фагоцитоз
- Лейкоцидины: Staphylococcus aureus (золотистый стафилококк) лизирует фагоцит перед слиянием фагосомы с лизосомами
- Мембранно атакующие комплексы: Listeria (листерия) лизирует фагосомы и освобождается в цитоплазму для внутриклеточного роста
- Предотвращение слияния с лизосомами и рост в фагосоме: Plasmodium (плазмодиум, малярия)
- Инактивация пищеварительных ферментов в лизосоме ВИЧ
- Устойчивость к перивариванию: Mycobacterium (палочки туберкулеза)
4) Воспаление
Воспаление — это процесс, вызванный повреждением организма. Проявления: покраснение (эритема), боль, тепло, отек (отеки), а иногда и потеря функции
Цель:
1. Уничтожить вредный агент и удалить побочные продукты травмы
2. Ограничить распространение травмы
3. Восстановить или заменить поврежденную ткань
- повреждение и / или инфекция вызывает синтез и освобождение сигнальных молекул, которые координируют необходимые для воспаления реакции:
- гистамин: из тучных клеток, вызывает расширение сосудов и их повышенную проницаемость сосудов
- TNFa: цитокин из макрофагов, усиливает реакцию
- простагландины: из поврежденных клеток, усиливают действие гистамина и привлекает фагоциты
- — лейкотриены: из тучных клеток, повышает проницаемость сосудов и способствует фагоцитозу
5). Лихорадка
 Лихорадка = повышенная температура тела, активируемая микробным веществом (например, LPS) или цитокинами из активированных фагоцитов, которые включают термостат в гипоталамусе
Лихорадка = повышенная температура тела, активируемая микробным веществом (например, LPS) или цитокинами из активированных фагоцитов, которые включают термостат в гипоталамусе
- ускоряет механизмы защиты и восстанавления
- увеличивает активность противовирусных и антибактериальных ферментов
6) Антимикробные системы
А. Система комплемента
B. Система интерферонов
Интерфероны — специфические цитокины: белки противовирусной сигнализации, используются клетками для инициирования противовирусной защиты
1. IFNβ:
- синтезируется зараженными вирусом клетками, индуцирует в соседних неинфицированных клетках синтез противовирусных белков (ПВБ)
- ПВБ блокируют репликацию вирусов в клетке
2. IFNα:
- синтезирууется лейкоцитами
- индукция синтеза ПВБ в клетках организма
- активирует NK-клетки при киллинге инфицированных вирусом клеток
3. IFNγ:
- продуцируется лимфоцитами
- активирует фагоциты — макрофаги и нейтрофилы
C. Белки, связывающие железо
1. Трансферрин: кровь, лимфа, интерстициальная жидкость
2. Лактоферрин: слизь, слюна, молоко
3. Ферритин: печень, селезенка, красный костный мозг
D. Противомикробные пептиды (ПМП)
Пептиды из 12-50 аминокислот, продуцируются фагоцитами в ответ на сигнал обнаружения поверхностных молекул патогенов. Обеспечивают широкий спектр противомикробных эффектов:
- ингибируют синтез бактериями стенки
- создают поры в мембране
- разрушают ДНК или РНК
- привлекают дендритные клетки (представление антигена)
- мобилизуют тучные клетки (воспаление)
Источник
Активация врожденного иммунитета. Стадия активации врожденного иммунитетаВрожденная иммунная защита первично нацелена на распознавание и элиминацию чужеродных структур. Инфекционные агенты располагают многими факторами вирулентности, воздействие которых может быть разрушительным для защитных механизмов врожденного иммунитета. Организм хозяина выработал уникальные стратегии распознавания патогенных структур микроорганизмов, процессинга их и презентации антигенов Т-лимфоцитам. Активация врожденного иммунитета, обеспечивающая оптимальное развитие специализированных эффекторных механизмов, может быть концептуально разделена на две стадии: 1 — фаза детекции, в течение которой комбинация поверхностных рецепторов распознает присутствие чужеродных структур при вторжении микрорганизмов, и 2 — фаза трансмиссии этой сенсорной информации на язык, понятный для клеток адаптивной иммунной системы, например, через продукцию хемокинов и цитокинов. Универсальная стратегия распознавания микроорганизмов эффекторами врожденного иммунитета основана на детекции доменных структур, которые называются патоген-ассоциированными молекулярными образами — PAMPs (pathogen-associated mollecular patterns), а распознающие их рецепторы врожденной иммунной системы — образраспознающими рецепторами — PRRs (pattern-recognition receptors). PAMPs — консервативные (неспецифические, невариабельные) структуры микроорганизмов общие для разных патогенов, их нет у млекопитающих, поэтому они распознаются иммунной системой как «чужое» с помощью паттерн-распознающих рецепторов (PRRs), включая семейство сигнальных Toll-подобных рецепторов (TRL). Существуют еще и альтернативные рецепторы врожденного иммунитета, такие как нуклеотид-связывающий олигомеризующийся домен (nucleotide-binding oligomerization domain — NOD), локализующийся внутриклеточно. NOD распознают РАМР независимо от участия TLR, активируют ядерный фактор KB (NF-kB) и усиливают продукцию IFN-y.
Эти эволюционно законсервированные рецепторы распознают PAMPs, включающие различные компоненты бактериальной стенки, среди которых наиболее известные — это липополисахариды, пептидогликан, липотейхоевые кислоты, маннаны, флагеллин, бактериальная ДНК, вирусные двуспиральные РНК, глюканы. До недавнего времени рассматривалось, что PAMPs обычно экспрессируются на поверхностях микробов и отсутствуют на клетках организма хозяина, однако в последнее время появляются работы, демонстрирующие наличие паттернов хозяина, распознаваемых рецепторами этого класса. В настоящее время известно два типа рецепторов врожденного иммунитета, обеспечивающих информирование организма о проникновении патогена. К первому типу относятся растворимые рецепторы для патогенов: C1q комплемента, ЛПС-связывающий белок, маннозосвязывающий лектин, С-рективный белок. Второй тип рецепторов для патогенов — рецепторы, экспрессирующиеся клетками врожденного иммунитета. Закодированные в геноме, рецепторы врожденной иммунной системы имеют ряд отличий от рецепторов лимфоцитов. Они экспресси-руются на эффекторных клетках врожденной иммунной системы, осуществляющих первую линию защиты, а также на профессиональных антигенпрезентирующих клетках (макрофагах, дендритных клетках и В-лимфоцитах). — Также рекомендуем «Варианты образраспознающих рецепторов PRRs. Toll-подобные рецепторы» Оглавление темы «Врожденный иммунитет»:
|
Источник