Механизмы противовирусного иммунитета интерфероны
Отличие вируса от большинства видов организмов в том, что он не способен к размножению вне чужой живой клетки. Вирусов известно много: Rabies Virus, Adenovirus, Ebola Virus, HIV, Hepatitis B и C, Papillomaviridae, Herpes Viridae, Influenza Virus и мн. др.
Они предпочитают разные клетки, атакуют нас по-разному, но всем им присуще нечто общее – структура жизненного цикла:
- проникновение в клетку с помощью присоединения к какому-либо типу рецепторов,
- транскрипция вирусной ДНК / РНК (в зависимости от вида вируса),
- встраивание в клеточный аппарат репликации генома,
- репликация вируса и его распространение за пределы клетки.
Врождённый иммунитет человека, формирующийся ещё до рождения, знает этот механизм. Ещё до первых контактов с патогенами мы имеем представление, как с ними бороться, и врождённые инструменты борьбы.
Как неспецифический иммунитет борется с инфекциями?
В распоряжении неспецифического иммунитета имеются естественные клетки-киллеры, запрограммированные уничтожать всё, что не отвечает критерию биологической идентичности геному организма хозяина.
В течение жизни эти клетки занимаются проверкой каждой клетки, каждого микроорганизма, который они встречают. Чтобы пройти контроль, клетки предъявляют молекулярный «паспорт» – главный комплекс гистосовместимости (ГКГС). Считывая его, как штрихкод, киллер отпускает здоровую клеточку – на свободу с извинениями.
Такие проверяющие клетки не умеют определять, инфицирована клетка или нет. Но когда вирус проникает в клетку и встраивает чужеродный геном в её реплицирующий комплекс, ГКГС нарушается и клетка не проходит контроль. Киллер впрыскивает в неё ферменты клеточного «пищеварения» и разрушает, а её остатки, как и остатки вирусов, подъедают фагоциты.
Типология клеток крови
При этом имеет место и иммунологическая толерантность, например, к компонентам нормального микробиома человека – при условии, что он найден в соответствующем месте. Так, кишечной палочке ничего не угрожает со стороны иммунитета хозяина в кишечнике, но, обнаружив её где-то ещё, клетка-киллер уничтожит эту бактерию как условный патоген. И будет права.
Как работает специфический иммунитет человека?
Специфический, или адаптивный, иммунитет человека работает на распознавание инфекций. В том числе новых. Ещё до первого контакта с возбудителем, до появления первых заражённых клеток и запуска соответствующего сигналинга иммунные клетки могут распознать патоген по т. н. паттернам патогенности – молекулярным (чаще всего белковым) комплексам, которые свойственны в принципе – вирусам, в принципе – бактериям, в принципе – грибам и т. д.
Когда патоген проник и развернул атаку, специфический иммунитет приступает к сложному мероприятию по его улавливанию и обезвреживанию. В его распоряжении имеются альфа-, бета- и гамма-интерфероны, которые:
- тормозят репликацию ДНК и РНК в клетке, не давая вирусу размножаться,
- запускают апоптоз – самоубийство заражённой клетки на благо организма.
В момент проникновения вируса клетка распознаёт инфицирование и успевает вывесить на мембране «флажки», которые привлекут внимание Т-хелперов, Т-киллеров, В-лимфоцитов и другие войска специфического иммунитета.Т-хелперы обеспечат исследование и запоминание патогена, В-лимфоциты займутся выработкой антител, которые обклеят (опсонизируют) вирусные фрагменты, сделав их неспособными к репликации. А фагоциты соберут остатки патогена и погибшей клетки. Затем «осколки» вируса затем попадут через кровь в лимфу, где отфильтруются в лимфоузлах и будут тщательно изучены. Затем молодым, т. н. наивным клеткам-лимфоцитам будут предъявлены антигены, и они смогут распознавать угрозы, которые «лично» никогда не встречали. Таким образом тренируется иммунная память.
Что ещё делает интерфероновый сигналинг? Интерфероны присоединяются к оболочкам здоровых клеток, не давая вирусу присоединиться и проникнуть сквозь клеточную мембрану.
Они же разрешают общие провоспалительные реакции, которые сопровождаются хорошо знакомыми клиническими симптомами усталости, разбитого состояния, высокой температуры, ломоты в суставах, сонливости, мышечной боли и т. п.
Всё это говорит о том, что красный костный мозг получил чёткий, конкретный сигнал – продуцировать больше специальных, «профессиональных» клеток: моноцитов, дендритных клеток, лимфоцитов, лейкоцитов и др.
Повышенные лимфо- и лейкоциты мы увидим в общем анализе крови – если, конечно, сам вирус не вызывает лейкоцито- или лимфоцитопению, поразив органы и клетки иммунной системы.
Таким образом, интерфероны оказывают аутокринный, паракринный и эндокринный эффект. И это, с одной стороны, хорошо, а с другой не очень, потому что военную мощь нашего иммунитета вирусы учатся обманывать и даже обращать против нас. И со стимуляцией иммунного ответа следует быть очень аккуратными.
Получить более подробную информацию об этом можно в статье от иммунологов онлайн-академии UniProf «Противовирусный иммунитет человека: как вирусы обманывают его и что с этим делать?»
А полное практические рекомендации, как пациенту подружиться с иммунитетом, а врачу – эффективно использовать иммунологические знания в любом направлении клинической практики,можно в рамках интенсива «Коронный иммунитет».
Лекции читают ведущие российский иммунологи и спикеры Академии UniProf. Регистрируйтесь на обучение, получайте актуальные и необходимые экспертные знания, чтобы быть здоровыми и вести пациентов на принципиально новом профессиональном уровне.
АМИКСИН® — современное противовирусное и иммуностимулирующее средство; способствует образованию в организме четырех видов интерферонов (альфа, бета, гамма и лямбда).
Узнать подробнее про АМИКСИН®…
Противовирусные препараты с иммуностимулирующей активностью могут рекомендоваться как при лечении гриппа, так и других ОРВИ. С их помощью можно сократить сроки болезни и предотвратить развитие осложнений.
Узнать подробнее о препаратах…
Прием противовирусного препарата АМИКСИН® возможен на любой стадии простуды и гриппа по рекомендации врача.
Как принимать препарат?
В сезон простуды и гриппа прием противовирусных и иммуномодулирующих препаратов помогает снизить вероятность заболевания.
Узнать больше о профилактике…
АМИКСИН® — современный противовирусный и иммуномодулирующий препарат, используемый в комплексной терапии целого ряда вирусных инфекционных заболеваний, в том числе гриппа, ОРВИ и герпеса.
Подробнее о препарате…
Иммуномодулирующие препараты — одни из важных составляющих комплексной терапии гриппа и других ОРВИ.
Подробнее…
Справиться с вирусными инфекциями бывает очень сложно. Но в самом нашем организме есть «встроенная» система противовирусной защиты. Это специальные вещества, интерфероны. Чтобы помочь организму справиться с болезнью, медицина создала лекарственные препараты — искусственные интерфероны и стимуляторы их синтеза, о которых пойдет речь в этой статье.
Функции и механизм действия интерферона в человеческом организме
Интерферон — это белковая молекула, которая обеспечивает противовирусный иммунитет. При этом она обладает неспецифической активностью, то есть действуют не на возбудителя какого-то конкретного заболевания, а на все вирусные частицы в целом. Если сказать обобщенно, то интерферон — универсальный защитник организма, который начинает действовать еще до того, как в работу включатся остальные звенья иммунитета[1]. Препараты интерферона применяются даже в терапии онкологии: они подавляют опухолевый рост.
Клетки вырабатывают этот защитный белок в ответ на действие вирусов, бактерий, опухолевых клеток или продуктов их метаболизма. Стимулировать их выработку могут и лекарственные препараты — индукторы интерферона. Молекулы последних, попадая в кровь и межклеточную жидкость, связываются с рецепторами зараженных или поврежденных клеток. Они запускают сложный каскад реакций, приводящих к образованию специфических белков. В результате клетка перестает воспроизводить вирусные частицы, расщепляет их генетическую структуру, а поверхность этой клетки становится менее проницаемой для внутриклеточных паразитов.
Кроме действия на сами зараженные клетки, интерфероны стимулируют активность других звеньев иммунитета, контролируют воспалительную реакцию[2] и даже могут защитить организм от опухолей. Это свойство активно изучают и уже используют для борьбы с некоторыми видами рака[3].
Виды человеческого интерферона
Молекулы интерферона отличаются между собой по генетической структуре, типу клеточных рецепторов, на которые они действуют, даже по участкам ДНК, которые кодируют их состав. Все интерфероны делят на 3 типа.
- К первому типу относят альфа-интерферон, который имеет 13 различных структурных вариантов, а также бета-, каппа-, эпсилон- и омега-.
- Второй тип представлен только одним типом, гамма-интерфероном.
- Относительно недавно, в 2002 году, был открыт и третий тип молекул, лямбда-. Это отдельное семейство интерферонов, которое отличается от всех предыдущих генетическим строением и даже типом рецепторов, с которыми они взаимодействуют. Но по своей биологической активности лямбда-интерфероны очень похожи на первый тип[4].
Не стоит относиться к интерферонам как к панацее от всех бед. Во-первых, некоторые вирусы могут подавлять образование специфических белков внутри зараженных клеток, что значительно снижает эффективность противовирусной защиты.
Во-вторых, это лишь первая «линия обороны», которая стимулирует другие звенья иммунитета и временно приостанавливает продвижение «врага» по организму, давая время на выработку иммунных клеток и антител.
В-третьих, основной механизм действия интерферона — это подавление развития и деления. В физиологических дозах этот эффект контролирует размножение вирусов и опухолевых клеток. Но при введении значительных доз «чужеродного» вещества могут пострадать и собственные ткани организма, которые быстро обновляются. В первую очередь — клетки крови.
Поэтому прежде чем начинать лечение препаратами интерферона, нужно внимательно изучить пользу и возможный вред от их приема.
Применение аналогов интерферона в медицине
Лекарственные средства на основе интерферона доказали свою эффективность[5] в лечении широкого круга заболеваний: герпетических инфекций, ВПЧ, острых и хронических форм вирусного гепатита, рассеянного склероза, волчанки, гриппа и многих других вирусных и бактериальных инфекций. Применяют интерферон и при терапии онкологических заболеваний, а также СПИДа. И это притом, что по меркам медицины открыли его совсем недавно. Это произошло в 1957 году при проведении опытов на мышах. Ученые обратили внимание, что животные, заразившиеся одним вирусом, становились невосприимчивы к другому вирусному заболеванию. Это явление было названо интерференцией, а вещества, которые ему способствовали — интерферонами. Оказалось, что интерфероны вырабатываются не только у мышей, но и у всех млекопитающих, в том числе у человека. Началось изучение возможности промышленного производства веществ, обладающих противовирусным эффектом.
Однако долгое время применение интерферонов было ограничено из-за несовершенства процедуры их получения. Выделять это вещество из крови человека-донора было сложно, дорого и неэффективно.
Цифры и факты
В 1 литре крови донора содержится всего 1 мкг интерферонов. Примерно такое количество этих молекул нужно для того чтобы изготовить всего одну дозу препарата[6]. А за курс лечения тяжелых вирусных заболеваний, таких как гепатит, человек может получить около 150 доз[7].
В 1980 году в Японии впервые использовали для производства интерферона специально выращенную культуру лимфобластных клеток. А в 1981 году в США вместо клеток человека использовали культуру дрожжевых грибков. С помощью генной инженерии в геном ввели ген, который кодирует производство молекулы интерферона. Это позволило значительно упростить производство препарата[8].
По способу производства существует четыре основных разновидности этого препарата: лейкоцитарный, лимфобластоидный, рекомбинантный и пегилированный.
Лейкоцитарный интерферон получают из крови доноров. Для того чтобы усилить выработку нужных веществ, клетки предварительно стимулируют чаще всего с помощью непатогенных вирусов — таких частиц, которые не могут вызвать заболевание, но при этом воспринимаются клетками иммунной системы как «сигнальные».
После получения такой препарат очищают и концентрируют. В него могут входить все виды интерферонов и другие биологически активные вещества. Это одновременно и плюс, и минус. Преимущество такого препарата — его высокий потенциал биологического действия. Недостаток — высокая вероятность побочных эффектов при внутримышечном введении.
Лимфобластоидный интерферон получают не от человека-донора, а из культуры лимфобластных клеток, которые также обрабатывают веществами, стимулирующими иммунный ответ. Такие препараты содержат определенное соотношение различных видов интерферона и не так часто вызывают побочные эффекты.
Рекомбинантные препараты получают из культуры клеток бактерий или грибов, в которые специально внедрили участок человеческого гена. Интерферон, полученный таким образом, может немного отличаться по своему строению от «природного» человеческого. Такие препараты сохраняют противовирусную активность, но стимуляции иммунитета с их помощью добиться сложно[9].
Пегилированные, или ПЭГ-интерфероны — это рекомбинантные белковые молекулы, соединенные с полиэтиленгликолем. Такое соединение увеличило срок действия интерферона в организме.
К примеру
Если стандартный рекомбинантный интерферон при лечении вирусного гепатита C нужно вводить три раза в неделю, то пегилированный достаточно использовать один раз за то же время[10].
ПЭГ растворим в воде, не вступает в биологические реакции в организме и не вызывает иммунного ответа. При присоединении ПЭГ молекула интерферона значительно увеличивается в размерах. А это, в свою очередь, увеличивает период полувыведения препарата.
Препараты на основе интерферона: показания и противопоказания к их применению
Объединить интерфероны в однородные группы по методу получения, формам выпуска и показаниям не получится. Каждый препарат имеет свои особенности применения, эффективность при определенных заболеваниях. В зависимости от степени очистки и других факторов какие-то препараты с одним и тем же видом иммуноглобулина могут применяться только местно, а какие-то можно использовать в виде инъекций.
Например, такие препараты как «Инферон» и «Альфаферон» относят к группе лейкоцитарных интерферонов. При этом «Инферон»[11] согласно инструкции применяют внутримышечно при неуточненных вирусных заболеваниях и для иммунотерапии. «Альфаферон»[12] тоже вводят в мышцу, но при этом уже используют для лечения гепатита, микоза и даже некоторых онкологических заболеваний. А «Интерферон человеческий лейкоцитарный»[13] используют для местного применения, закапывания в нос и проведения ингаляций.
Поэтому при выборе препарата интерферона стоит ориентироваться не только на общую характеристику группы веществ, но в первую очередь на рекомендации врача и инструкцию по применению конкретного препарата.
Интерферон в виде инъекций применяют при системных заболеваниях, таких как гепатит, опухоли или рассеянный склероз. Препарат в виде капель в нос подходит для лечения риносинуситов и профилактики ОРВИ. Капли в глаза помогут при конъюнктивите. Суппозитории можно использовать при многих заболеваниях, в том числе у детей. А гель подходит для смазывания носа или кожи.
Одной из наиболее однородных групп на сегодняшний момент являются пегилированные интерфероны. Существует два основных класса препаратов с доказанной эффективностью[14] — это пегинтерферон альфа-2а и пегинтерферон альфа-2b. Представитель первого класса — «Пегасис»[15], второго — «ПегИнтрон»[16]. Оба препарата используют подкожно, один раз в неделю и применяют только для лечения хронического вирусного гепатита В и С.
Рекомбинантный интерферон — одна из самых многочисленных по торговым наименованиям групп препаратов.[17] Сюда относятся такие лекарства как «Реаферон», «Виферон», «Ингарон», «Интерфераль» и другие. Эти препараты имеют различные формы для местного применения и для инъекций. У каждого препарата в инструкции определен свой перечень показаний, но в целом — это вирусные и бактериальные инфекции.
Интерфероны защищают организм от вирусов, бактерий и опухолевых клеток. Они обладают сложным биологическим действием. Но современная медицина научилась создавать аналогичные вещества и использовать их. Однако подбор подходящего препарата — задача, которую может решить только врач.
Еще несколько месяцев назад мир не знал о существовании
вируса, который изменит жизнь более 7,5 миллиардов человек.
Сегодня ученые всего мира пытаются найти вакцину и действенное
лекарство для борьбы с пандемией. Однако постепенно ученые узнают
больше подробностей о новом вирусе. Так, стало известно, что
SARS-CoV-2 в некоторых случаях избегает иммунного ответа и
приостанавливает выработку важной молекулы — интерферона. Как
коронавирусу это удается? Объясняет иммунолог, академик
Арег Тотолян.
Арег Артемович Тотолян — директор
Санкт-Петербургского института эпидемиологии и микробиологии
имени Пастера, доктор медицинских наук, профессор, академик
РАН.
— Как вирус SARS-CoV-2 проникает в
клетку?
— Первая и основная клетка, в которую проникает вирус —
эпителиальная. Прежде всего, речь идет об эпителиальных клетках
верхних дыхательных путей. Ведь основные ворота для проникновения
вируса — это носоглотка и ротоглотка. При дальнейшем успешном
развитии инфекции поражаются средние и нижние дыхательные
системы.
В части случаев вирус поражает и другие органы и системы человека
— желудочно-кишечный тракт и почки. Об этом свидетельствует
соответствующая симптоматика — диарейный синдром и почечная
недостаточность.
Когда в январе 2020 году инфекция стала известна широкому кругу
специалистов, считалось, что единственный путь попадания вируса в
клетку осуществляется с помощью ангиотензинпревращающего фермента
— рецептора, получившего название ACE2. Но оказалось, что
существует второй рецептор, который выполняет функцию входных
ворот для вируса в клетку — CD147. Чем он примечателен?
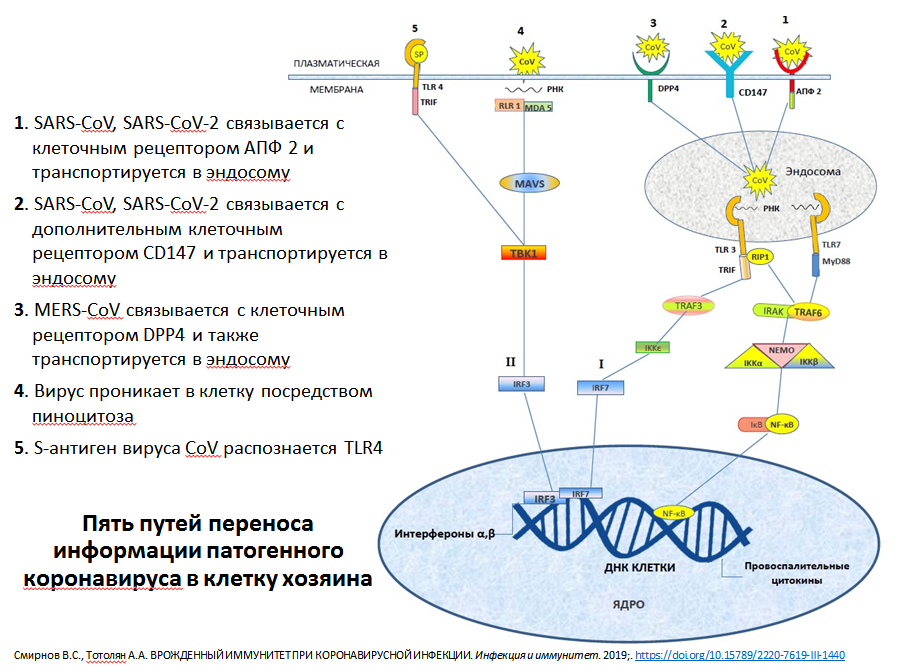
Схема путей переноса информации патогенного коронавируса в клетку хозяина. Из презентации А.А. Тотоляна
Этот белок располагается на поверхности или мембране клетки.
Против него уже существует моноклональное антитело — то есть
лекарственный препарат, который применяют при лечении некоторых
онкологических заболеваний. Поэтому в ряде зарубежных странах
были инициированы клинические исследования этого препарата как
возможного кандидата для лечения COVID-19. Исследования
продолжаются, но пока результатов нет. Если этот препарат
окажется эффективным, то это значительно упростит ситуацию, а
главное — сэкономит время.
Вернемся к вопросу. Вирус, проникая в клетку, запускает целый ряд
механизмов, которые приводят к развитию дефектов. Нормальная
клетка при проникновении чужеродного микроорганизма ведет себя
соответствующим образом. Одно из проявлений ее поведения связано
с выработкой интерферона.
— Что собой представляет интерферон и каково его
место в иммунной системе?
— Интерфероны — это семейство белковых молекул, которые
продуцируются различными клетками организма человека и
обеспечивают, в том числе, противовирусный иммунитет. При этом
интерфероны обладают неспецифической активностью, то есть
действуют не на возбудителя какого-то конкретного заболевания, а
на любые вирусные частицы в целом. На сегодняшний день известно
целое семейство интерферонов — 20 разных молекул, объединенных
одним названием.
Наиболее известными являются три интерферона: альфа, бета и
гамма. Об остальных говорить не буду. Даже если читатели запомнят
три указанных представителя семейства интерферонов, этого вполне
достаточно для общего понимания. Интерферон-альфа обладает
истинной противовирусной активностью, чуть слабее — интерферон
бета. Интерферон гамма напрямую не обладает противовирусной
активностью. У него другая функция — иммунорегулирующая. Он
принимает самое активное участие в регуляции иммунного ответа, во
взаимодействии врожденного и адаптивного иммунитета.
Поэтому, в первую очередь, нас интересует интерферон альфа. По
идее эпителиальные клетки должны были вырабатывать интерферон
альфа и гамма при встрече с коронавирусом. Но в отношении
интерферона альфа этого не происходит. Почему? Дело в том,
что у вируса SARS-CoV-2 есть определенные механизмы, с помощью
которых он подавляет не только продукцию интерферона, но и сам
синтез.
— Как ему это удается?
— Эти процессы происходят на молекулярном уровне. Они приводят к
дефекту эпителиальной клетки, после чего она не может
продуцировать интерферон альфа. Этот факт имеет множество
последствий для организма. Чтобы не допустить этого, специалисты
проводят заместительную терапию с помощью препаратов на основе
интерферона альфа, которые позволяют восполнить дефицит.
— Так мы помогаем иммунитету?
— Да, верно. Мы вводим интерферон извне, тем самым компенсируя
дефект, вызванный вирусом. Препараты на основе интерферона альфа
особенно должны быть эффективны на ранних этапах, пока инфекция
не спустилась в нижние отделы дыхательных путей.
А интерферон гамма, напротив, важен на поздних этапах, когда
инфекция сопровождается пневмонией и так называемым цитокиновым
штормом.
Дело в том, что клетки иммунной системы «общаются» между собой с
помощью самых разных молекул, которые называются цитокинами. В
ответ на инфекцию они, естественно, синтезируются более активно.
Поначалу эти молекулы выполняют защитную функцию, привлекая в
очаг воспаления всё больше иных молекул и клеток. Но наступает
момент, когда ситуация выходит из под контроля, и цитокины
продуцируются в огромном количестве, тем самым нанося вред самому
организму. И именно здесь важную роль играет интерферон гамма,
который как раз запускает синтез целого ряда цитокинов. Поэтому
целесообразно применять терапию с помощью антицитокиновых
препаратов, чтобы нормализовать этот процесс.
Если цитокинового шторма нет, применять препараты для
антицитокиновой терапии нельзя. Ведь так мы добьемся диаметрально
противоположного результата. Выключение любого нормально
функционирующего компонента иммунной системы приводит к развитию
иммуносупрессии — дефекта иммунной системы.

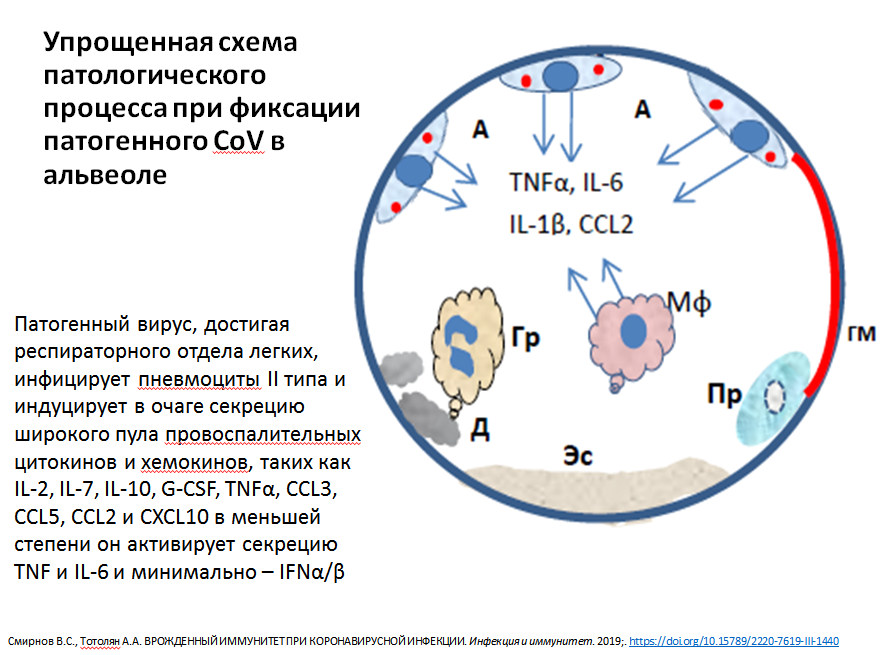
Схема патологического процесса при фиксации вируса в альвеоле. Из презентации А.А. Тотоляна
Другие схемы представлены в презентации академика
Арега Тотоляна.
— Давайте поговорим об особенностях протекания
болезни COVID-19. Почему она поражает именно легкие? Вирусу
комфортнее в этой среде или есть какие-то другие
объяснения?
— Просто вирусу проще попасть в организм через нос или рот, а
затем в легкие. А в ряде случаев, как я уже упоминал, он попадает
в желудочно-кишечный тракт.
Иммунная система очень многогранна и распространена по всему
организму, имея «представительства» практически во всех органах и
тканях. Если иммунная система желудочно-кишечного тракта не
справляется с ситуацией, значит, вирус с большей вероятностью там
поселится. Такая же ситуация обстоит с почками. Скажем, если
пациент страдает сахарным диабетом, то его почки также находятся
в поврежденном состоянии. Следовательно, вирус может задержаться
именно в почках.
— Сейчас многие научные коллективы ищут вакцину и
лекарство против нового коронавируса. На чем они будут
основаны?
— Начнем с вакцин. Сегодня как минимум 8 коллективов в России
занимаются разработкой вакцины. Если ее удастся создать, то она
поможет нам со второй волной пандемии. По разным оценкам, вирус
может приобрести сезонный характер.
Я не думаю, что мы успеем использовать вакцину в нынешней
ситуации. Скорее всего, пандемия завершится до того, как вакцина
получит путевку в жизнь. Это работа, прежде всего, на
перспективу. По сути, вакцина — это долгосрочная профилактика. Ее
появление позволит нам быстро сформировать иммунизированную
прослойку, которая будет защищать остальных.
Ведь мы не можем иммунизировать всех подряд. Существуют
определенные ограничения, которые не позволяют использовать одну
и ту же вакцину для всех. Есть также пациенты с иммунодефицитом,
приобретенным или врожденным. Для таких групп пациентов некоторые
вакцины просто противопоказаны. Именно поэтому 100%-я вакцинация
не достигается. Но она, по существу, и не нужна. Согласно теории
коллективного иммунитета, достаточно 70% населения с иммунитетом
к вирусу, чтобы избежать пандемии.
Если говорить о лечении, то наиболее эффективными специфичными
против вируса иммунопрепаратами должны стать терапевтические
моноклональные антитела — антитела, вырабатываемые иммунными
клетками, принадлежащими к одному клеточному клону, то есть
произошедшими из одной плазматической клетки-предшественницы.
Пока таких препаратов в нашем распоряжении нет, клиницисты идут
другим путем: переливают плазму реконвалесцентов, то есть
выздоравливающих людей. В крови выздоровевших имеются
специфические антитела. Их плазму крови вводят тем, кто наиболее
тяжело переносит заболевание.
— Какие препараты, разрабатываемые сегодня, будут
наиболее перспективными?
— На первое место я бы поставил терапевтические антитела.
Моноклональные антитела, как я уже говорил, это препараты,
которые обладают высокой селективностью в отношении молекулярной
мишени. Антитела обладают способностью точно связываться с
антигеном благодаря специальным антигенсвязывающим участкам,
имеющим к нему высокую специфичность. Это определяет
селективность лекарств на основе антител в отношении конкретной
мишени.
Вторые по значимости — пептиды, которые могут обладать
активностью против вируса. В своих исследованиях мы решили пойти
как раз по этому пути. Как нам кажется, результаты могут
оказаться весьма перспективными.
Это то, что касается перспектив иммунотерапии. Пациенты, особенно
с тяжелыми формами заболевания, получают самое разнообразное
лечение и в части применяемых препаратов, и в части медицинских
технологий. В этом вопросе «карты в руки» клиницистам, которые
непосредственно ведут этих пациентов, прежде всего,
реаниматологам и пульмонологам.
Интервью осуществлено при поддержке Министерства науки и
высшего образования РФ и Российской академии наук
