Механизмы распознавания чужого в иммунитете

До конца 80-х годов прошлого столетия предполагали, что узнавание чужого состоит в распознавании индивидуальных молекул (антигенов) рецепторами лимфоцитов. Считалось, что миелоидные клетки не отличают «свое» и «чужое» и уничтожают любые клетки, не обладающие механизмами защиты от фагоцитоза. Новые представления о распознавании в системе врожденного иммунитета были сформированы в рамках концепции Ч. Дженеуэя (Ch. Janeway) о взаимодействии врожденного и адаптивного иммунитета. Основой этих представлений, разработанных Ч. Дженеуэем совместно с Р. Меджитовым, стало понятие «распознавания паттернов». Оно означает распознавание не индивидуальных молекул или химических групп, а общих структурных особенностей, свойственных группам молекул. Эти особенности обозначают практически непереводимым английским словом pattern (паттерн), в качестве эквивалента которого Р. Меджитов предлагает русское слово «образ». При этом имеется в виду, что многоклеточные организмы распознают «образы» во-первых — чужеродных, во-вторых — опасных микроорганизмов-патогенов. Такие структуры можно назвать образами патогенности, или патогенассоциированными молекулярными паттернами (буквальный перевод оригинального словосочетания — Pathogen-associated molecular pattern — PAMP).
Главные особенности PAMP: чужеродность (не столько для данного организма, сколько для вида, к которому он принадлежит), связь с патогенностью микроорганизмов и консервативность. Эта комбинация свойств создает для иммунной системы возможность, распознавая ограниченное число молекул, выявлять опасность, представляемую организмом-носителем PAMP, задолго до ее реального проявления.
В главе 1 уже были сопоставлены наиболее фундаментальные свойства рецепторов врожденного и адаптивного иммунитета (см. табл. 1.3). В результате этого сопоставления можно заключить, что распознавание паттернов, сформированное в процессе длительной эволюции, организовано более просто, надежно и менее опасно (не возникают ошибки, приводящие к аутоагрессии), чем распознавание антигенов. Однако распознавание паттернов не приводит к формированию иммунологический памяти. Учение о распознавании паттернов охватывает, наряду с новыми, недавно открытыми сведениями о паттернраспознающих рецепторах, некоторые давно известные данные о рецепторах и гуморальных факторах врожденного иммунитета (например, компонентах комплемента, белках острой фазы и т.д.).
В рамках такого расширенного толкования распознавания паттернов рецепторы врожденного иммунитета разделяют на 3 группы — мембранные, внутриклеточные (цитозольные) и секретируемые (табл. 2.8). Первые — клеточные рецепторы в традиционном понимании, обеспечивающие не только распознавнаие PAMP, но и немедленное «оповещение» о произошедшем распознавании (т.е. передачу сигнала внутрь клетки). Внутриклеточные рецепторы — как цитозольные, так и расположенные на мембранах цитоплазматических гранул, выполняют сходную функцию, взаимодействуя не с внеклеточными, а с внутриклеточными патогенами и их PAMP. Растворимые рецепторы распознают PAMP, связываясь с ними на поверхности патогенов. Такие комплексы распознаются клетками врожденного иммунитета.
Таблица 2.8. Классификация паттернраспознающих рецепторов
| Типы и виды рецепторов | Лиганды | Функции |
| Мембранные | ||
| Толл-подобные рецепторы (TLR 1-11) | Образы патогенности (PAMP) | Активация клеток врожденного иммунитета |
| С-лектины | Углеводные остатки | Интернализация |
| Scavenger-рецепторы («мусорщики») | Липопротеины, липополисахарид, липотейхоевая кислота, апоптотические клетки | Интернализация |
| Интегрины | Рецепторы из суперсемейства иммуноглобулинов, белки межклеточного матрикса | Адгезия, подвижность |
| Внутриклеточные | ||
| NOD-подобные (NLR) | Пептидогликаны | Активация клеток врожденного иммунитета |
| RIG-подобные (RLR) | РНК | То же |
| DAI | ДНК | То же |
| Растворимые Декретируемые) | ||
| Пентраксины | PAMP, иммуноглобулины, компонент комплемента C1q, полиэлектролиты, белки межклеточного матрикса, гепарин, гистоны | Активация комплемента, хемотаксис |
| Коллектины | Fc-Ig, углеводные остатки | Активация комплемента |
| Компоненты системы комплемента | Белки и полисахариды | Опсонизация, цитолиз, хемотаксис и т.д. |
| Фиколины | TGF-p, мембранные белки, полисахариды | Опсонизация |
Известно, что в отличии от адаптивной иммунной системы, распознающей также структуры каждого конкретного антигена, факторы врожденного иммунитета такой специфичностью не обладает, но способны первыми распознать все чужое. Недавно выяснилось, что клетки врожденной иммунной системы имеют рецепторы, распознающие определенные молекулярные структуры, общие для различных групп патогенов. Эти структуры консервативны и мало изменились в процессе эволюции. Главное, что подобных структур нет в макроорганизмах и поэтому воспринимаются, как чужие. Они получили название «патогенассоциированные молекулярные образцы», а соответствующие им рецепторы на клетках врожденной иммунной системы — «образ — распознающие рецепторы» (pattern — recognition receptor — PRR). [6] Наиболее известными патогенассоциированными молекулярными образами — PAMP являются структуры различных патогенов: липополисахарид, пептидоглюкан, липотейхоевые кислоты, маннаны, бактериальная ДНК, а также двуспиральная РНК вирусов и глюканы грибов и др.
PAMP синтезируются только микроорганизмами. Поэтому они распознаются как чужие каким — либо из образ — распознающих рецепторов — PRR, находящимися на клетках врожденной иммунной системы: макрофагах, микрофагов, естественных киллеров, эпителиальных и дендритных клетках, а также на B — лимфоцитах. [6,7]
Рецепторы клеток врожденной иммунной системы
Большое значение в реализации первичного иммунного ответа играют «патогенассоциированные молекулярные образы», РАМР(patogen-associated molecular patterns), и соответствующие им рецепторы врожденной иммунной системы- «образраспознающие рецепторы»,или РRR (pattern-recognition receptors). РАМР синтезируются только микроорганизмами и являются сигналом о наличии в организме хозяина инфекции. К рецепторам распознающие патогены относят Scavenger («захватчики» или «мусорщики»), NOD (распознающие внутриклеточные патогены) и Toll-like рецепторы (TLR). PRR, подразделяясь на несколько классов белковых молекул, по функции делятся на эндоцитозные и сигнальные (табл.3.1.1.).
Эндоцитозные экспрессированы на поверхности антиген- представляющих клеток (фагоцитов, эпителиальных клеток и др.). После распознавания соответствующего РАМР они опосредуют поглощение и доставку к лизосомам патогена, где и происходит его разрушение с образованием антигенных детерминант, которые в комплексе с молекулами главного комплекса гистосовместимости класса II представляются клеткам адаптивной иммунной системы и запускают классический иммунный ответ. (рис.3.1.2.)TLR также способны распознавать микробные структуры и активировать эволюционно древний сигнально трансдуктивный путь, участником которого является фактор транскрипции NF-kB- эффектор транскрипции, активирующий синтез провоспалительных цитокинов. У человека идентифицировано 13 генов, кодирующих синтез TLR. Они обнаружены на макрофагах, ДК, эозинофилах, тучных клетках, естественных киллерах, Т- и В- лимфоцитах, интестинальных эпителиоцитах. Большинство TLR располагаются на поверхности клеток, реже- в цитоплазме, в области аппарата Гольджи. На мембране клеток обычно находятся рецепторы, которые связываются с бактериями, простейшими и грибами. На распознавание вирусов и внутриклеточных микробов направлены TLR, расположенные на внутренних структурах клеток. В результате активации ядерных факторов начинается транскрипция РНК с последующим синтезом белков. Клетка активируется, в ней начинается активный синтез разных цитокинов. Сигнал с TLR NOD- рецепторов инициирует синтез ИЛ-1,2,6,8,12, ФНО — б, ИФН — ?, гранулоцитарно-макрофагального колониестимулирующего фактора.. Помимо цитокинов, мишенями служат гены молекул адгезии, острофазных белков, молекул МНС, ферментов воспаления Таким образом, активация синтеза и секреции перечисленных молекул приводит к развитию воспалительной реакции с подключением всех имеющихся систем защиты от патогенов . [6,15]
Таблица 3.1.1. Классификация и специфичность рецепторов врожденной иммунной системы
Тип PRR | PRR | ЛИГАНДЫ | Тип патогена |
Эндоцитозные | Маннозные | Углеводы и гликопротеиды | грам- {+} |
с высоким содержанием маннозы | грам- {+} | ||
(маннаны) | грибы | ||
Скавенджер | ЛПС,пептидогликаны, | грам- {+} | |
Липотейхоевые кислоты | грам- } | ||
Сигнальные | TLR-1 | Триациллипопротеиды,модулин, | грам- {+} |
M.tuberculosis | грам- { | ||
TLR-2 | Лиопротеиды большинства патогенов, | грам- {+} | |
пептидогликаны,липотейхоевые и маннуровые кислоты, | грам- {+} | ||
порины Neisseria,атипичные ЛПС, факторы вирулентностиYersinia, CMV | Грибы | ||
вирионы CM, зимозин. | Вирусы | ||
TLR-3 | Двунитчатая РНК | Вирусы | |
TLR-4 | ЛПС грам- бактерий,HSP60 полимерные маннурованные к-ты, | грам- {+} | |
флаволипиды,тейхуроновые к-ты пневмолизин,оболочечный | грам- } | ||
белок RSV | Вирусы | ||
TLR-5 | Флагеллин | грам- {+} | |
TLR-6 | Диациллипопротеиды,модулин,липотейхоевая к-та,зимозин | грам- {+} | |
TLR-7 | Однонитчатая РНК,синтетические вещества | Вирусы | |
TLR-8 | Однонитчатая РНК,синтетические вещества | Вирусы | |
TLR-9 | Неметилированная CpG ДНК | грам- {+} | |
грам- { | |||
TLR-10 | Неизвестны | ||
TLR-11 | Уропатогенные бактерии | ||
NOD 1 | Пептидогликаны (GM-TriDap) | грам- {+} | |
NOD 2 | Пептидогликаны (ГМДП) | грам- {-} | |
{ 6} |
Рис.3.1.2.Доставка к лизосомам патогена, с помощью эндоцитарного образ-распознающего рецептора, и последующая активация адаптивного иммунного ответа.

Характеристика сигналов и их реализация: синтез провоспалительных цитокинов и активация фагоцитоза
Поврежденные кожные и слизистые покровы являются наиболее доступными воротами для инфекционных агентов. Проникшие патогены индуцируют комплексную реакцию воспаления. Которая направлена на локализацию и уничтожение микроорганизмов в месте внедрения. В организации этого процесса участвуют все клеточные и гуморальные факторы врожденного иммунитета, которые первыми реагируют на внедрение чужеродного агента. Толл — рецепторы эпителия и макрофагов данной ткани распознают «образы» патогенов, взаимодействуют с ними и передают сигналы внутрь клетки.(рис.3.1.1.1.)

Рис.3.1.1.1. Активация генов провоспалительных цитокинов через TLR.
Сигнал направлен на активацию транскрипционного фактора -NF- kB через который происходит активация генов провоспалительных цитокинов. Сигнальные толл-рецепторы инициируют синтез ИЛ-1,2,4,6,8,12. Помимо цитокинов инициируется синтез острофазовых белков, простагландина, пептидов малой плотности, активируется система комплемента, происходит дегрануляция тучных клеток. Выделяющиеся из их гранул биологически активные вещества — БАВ ( гистамин, серотонин и др.) вызывают расширение капилляров и повышение их проницаемости, что способствует выходу из сосудов плазмы, содержащей различные медиаторы воспаления ( экссудация). Эти процессы приводят к покраснению и отеку воспалительного очага. При этом в очаг воспаления проникают и клеточные элементы крови: нейтрофилы, моноциты, лимфоциты, базофилы. Миграция клеток происходит под влиянием хемокинов и осуществляется с помощью адгезивных молекул (селектины, интегрины). Проникновение клеток в очаг воспаления можно разделить на 3 этапа: этап атаки, адгезии, трансмиграции.(рис.3.1.1.2.) [15]
ь Этап атаки:
Под влиянием цитокинов на поверхности эндотелия и лейкоцитов появляются молекулы семейства селектинов. При их взаимодействии лейкоцит замедляет движение, приближается к эндотелию и «катится» по его поверхности.
ь Этап адгезии (прикрепление):
По мере приближения (под влиянием хемокинов) к месту воспаления лейкоциты прилипают к эндотелию, останавливаются распластываются.
ь Этап трансмиграции:
С помощью молекул интегринов лейкоциты проникают между клетками эндотелия и попадают в ткань.

Рис.3.2. Роль адгезивных молекул в миграции клеток при развитии воспаления.
 ïðåäûäóùåì ïîñòå ÿ ðàññêàçàë î ïðîôåññèîíàëüíûõ àíòèãåíïðåçåíòèðóþùèõ è äåíäðèòíûõ êëåòêàõ. À òåïåðü ñäåëàéòå ãëóáîêèé âäîõ è ïðèãîòîâüòåñü ê äëèííîïîñòó 🙂
Òàíåö îäíîé äåíäðèòíîé êëåòêè (ïîëíîå âèäåî çäåñü)
Äåíäðèòíàÿ êëåòêà ñîáèðàåò ÷óæåðîäíûå àíòèãåíû è ñïåøèò â ëèìôîóçåë. ×òî æå ïðîèñõîäèò ñ àíòèãåíàìè, êîòîðûå äåíäðèòíàÿ êëåòêà ïðèíåñëà â ëèìôàòè÷åñêèé óçåë? Ïðèøëî âðåìÿ ïîçíàêîìèòüñÿ ñî âòîðîé ãðóïïîé ëåéêîöèòîâ, ó÷àñòâóþùèõ â èììóíèòåòå. Ëèìôîöèòû. Ýâîëþöèîííî áîëåå ìîëîäàÿ è áîëåå ñëîæíàÿ ñèñòåìà çàùèòû îðãàíèçìà îò âòîðæåíèÿ. Åñëè íåéòðîôèëû, áàçîôèëû è ýîçèíîôèëû — ýòî ïåõîòà, êîòîðàÿ ñòîèò â àâàíãàðäå çàùèòû, òî ëèìôîöèòû — áîëåå ìåäëåííàÿ, íî è áîëåå ïðèöåëüíàÿ (òî÷íàÿ) çàùèòà îò âðàãà.
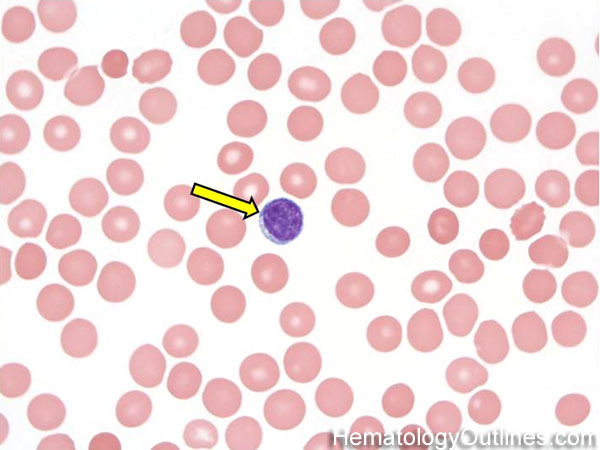
Ëèìôîöèòû íå èìåþò ñïåöèàëüíûõ ãðàíóë è õàðàêòåðèçóþòñÿ áîëüøèì îêðóãëûì ÿäðîì.
Ëèìôîöèòû îòíîñÿòñÿ ê àãðàíóëîöèòàì èëè íåçåðíèñòûì ëåéêîöèòàì. Îíè ñîñòàâëÿþò 25 — 40 (45) % îò îáùåãî ÷èñëà ëåéêîöèòîâ (19 — 37 % â êðîâè). Íå âñå ëèìôîöèòû îäèíàêîâûå — òî÷íî òàê æå, êàê è âîéñêà: åñòü ñóõîïóòíûå, åñòü âîçäóøíûå. Êëàññè÷åñêè èõ äåëÿò íà T-ëèìôîöèòû è B-ëèìôîöèòû (åùå åñòü è 0-ëèìôîöèòû). Îáà âèäà êëåòîê îáðàçóþòñÿ â êîñòíîì ìîçãå èç ñòâîëîâîé êëåòêè êðîâè. Àíãëèéñêèå áóêâû T è B îçíà÷àþò Thymus (òèìóñ) è Brain/Bursa (ìîçã/ñóìêà ó ïòèö) — ìåñòà, â êîòîðûõ ïðîèñõîäèò ñîçðåâàíèå ëèìôîöèòîâ.
Ìàëî òîãî, ÷òî ëèìôîöèòû äåëÿòñÿ íà Ò è Â êëåòêè, òàê êàæäûé èç íèõ òîæå äðîáèòñÿ íà ãðóïïû.
Âîîáùå, êàê âû óáåäèëèñü, ñóùåñòâóåò áîëüøîå êîëè÷åñòâî èììóííûõ êëåòîê. Êðîìå òîãî, îíè ìîãóò íàõîäèòüñÿ íà ðàçíîé ñòàäèè ðàçâèòèÿ. ×òîáû êàê-òî ñ ýòèì ðàçîáðàòüñÿ, ïðèäóìàëè ñïåöèàëüíóþ íîìåíêëàòóðó ìàðêåðîâ, ïî êîòîðûì ìîæíî ðàçëè÷àòü ðàçíûå ëåéêîöèòû. Ìàðêåð — ýòî îñîáûé áåëîê (ðåöåïòîð) íà ïîâåðõíîñòè êëåòêè, êîòîðûé íàçûâàåòñÿ êëàñòåðîì äèôôåðåíöèðîâêè èëè cluster of differentiation, ñîêðàùåííî — CD. Êàæäûé áåëîê èìååò ñâîé íîìåð: CD1, CD2, CD3, CD4  íàñòîÿùåå âðåìÿ èõ èçâåñòíî áîëåå 370. Êàæäûé ëåéêîöèò èìååò ñâîé íàáîð CD ìàðêåðîâ.
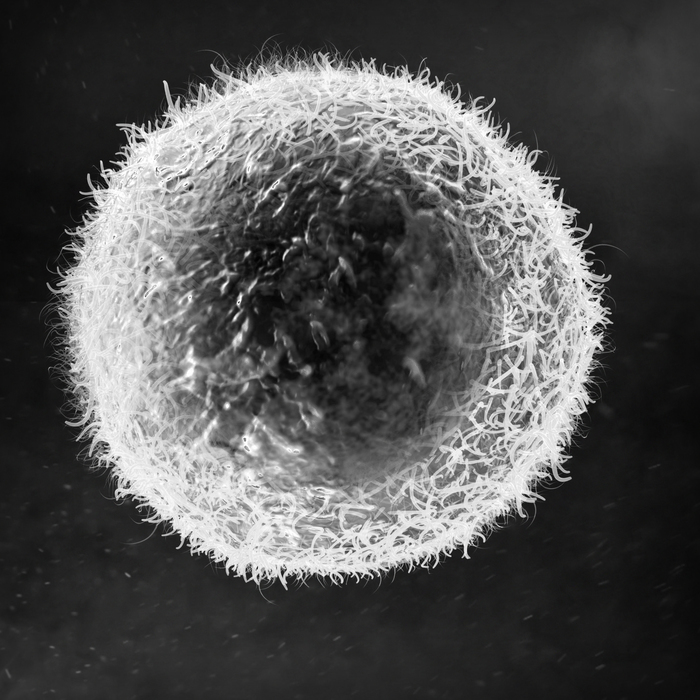
Ò-ëèìôîöèò ïîä ýëåêòðîííûì ìèêðîñêîïîì.
Ñåãîäíÿ íàñ èíòåðåñóþò CD8 êëåòêè èëè öèòîòîêñè÷åñêèå Ò-ëèìôîöèòû. Åù¸ èõ íàçûâàþò Ò-êèëëåðû. Äóìàþ, èç ïîñëåäíåãî íàçâàíèÿ ìîæíî äîãàäàòüñÿ, ÷åì îíè çàíèìàþòñÿ. Çàäà÷à Ò-êèëëåðîâ — óáèâàòü ñâîè êëåòêè, ïîðàæåííûå âíóòðèêëåòî÷íûìè ïàðàçèòàìè èëè îïóõîëüþ.
Êàê è ëþáîé èììóííîé êëåòêå, Ò-êèëëåðó òðåáóåòñÿ îïîçíàâàòåëüíàÿ ìåòêà èëè íåêèé ïðèçíàê, êîòîðûé óêàæåò åìó íà âðàãà. Åñëè äëÿ êëåòîê âðîæäåííîãî èììóíèòåòà òàêèìè ïðèçíàêàìè ÿâëÿþòñÿ ÷óæåðîäíûå óçîðû, òî äëÿ ëèìôîöèòîâ ñèãíàë òðåâîãè — ýòî àíòèãåí. Îäíàêî ëèìôîöèòó ìàëî îäíîãî àíòèãåíà, åìó íóæíî åù¸ è ïðåäîñòàâèòü ýòîò àíòèãåí. Ñàì ïî ñåáå êèëëåð íå óìååò âçàèìîäåéñòâîâàòü ñ âðàãîì. Äàæå åñëè íà Ò-ëèìôîöèò óïàäåò âèðóñ èëè áàêòåðèÿ, îí íè÷åãî íå ñìîæåò ïîäåëàòü. Íî çàòî îí óìååò ñâÿçûâàòüñÿ ñ MHC 1 êîìïëåêñîì è ïðîâåðÿòü, ÷òî æå òàì íàõîäèòñÿ. À íàõîäèòñÿ òàì àíòèãåí. Êàê ïðîèñõîäèò ýòî âçàèìîäåéñòâèå?
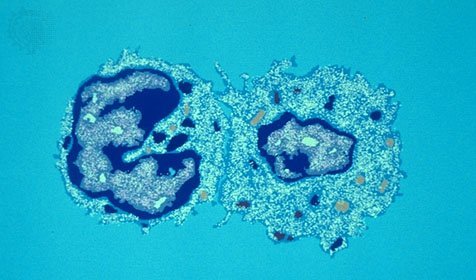
Ò-êèëëåð (ñëåâà) ïîéìàë êëåòêó, èíôèöèðîâàííóþ âèðóñîì
Ëèìôîöèòû-óáèéöû èìåþò íà ñâîåé ïîâåðõíîñòè ñïåöèàëüíûå ðåöåïòîðû, êîòîðûå óìåþò óçíàâàòü àíòèãåíû â ñîñòàâå MHC 1 ìîëåêóë. Ðåöåïòîðû òàê è íàçûâàþòñÿ — Ò-êëåòî÷íûå ðåöåïòîðû èëè TCR (T-cell receptors). Èìåííî áëàãîäàðÿ èì ïðîèñõîäèò íà÷àëüíîå âçàèìîäåéñòâèå T-êèëëåðà è êëåòêè ñ MHC 1.
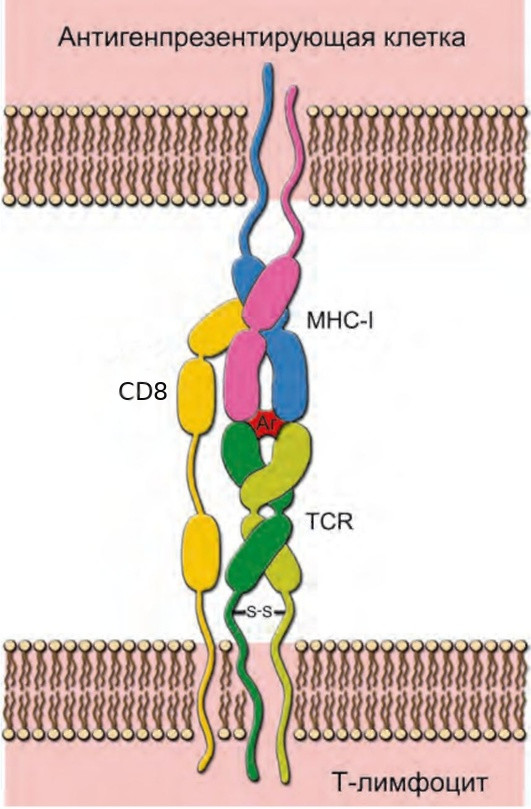
Ýòî î÷åíü îáùàÿ ñõåìà, êàê ïðîèñõîäèò ñâÿçü TCR è MHC 1. Ðåöåïòîð ëèìôîöèòà óõâàòèëñÿ çà àíòèãåí (êðàñíîå ïÿòíî ñ áóêâàìè Àã). Êàê âèäèòå, äëÿ âçàèìîäåéñòâèÿ ñ MHC 1 ëèìôîöèòó åù¸ íóæåí è CD8 ðåöåïòîð.
Êàæäûé Ò-êèëëåð íåñåò íà ñâîåé ïîâåðõíîñòè ñòðîãî ñïåöèôè÷íûé òèï ðåöåïòîðîâ — òî åñòü òàêîé ðåöåïòîð, êîòîðûé ìîæåò ðàñïîçíàòü îäèí îïðåäåëåííûé àíòèãåí (èëè íåñêîëüêî ïîõîæèõ àíòèãåíîâ). Òàê êàê àíòèãåíîâ ìîæåò áûòü îãðîìíîå ìíîæåñòâî, òî è Ò-ëèìôîöèòîâ ñ óíèêàëüíûìè ðåöåïòîðàìè ìîæåò áûòü î÷åíü ìíîãî (ìèëëèàðäû). Öèòîòîêñè÷åñêèé ëèìôîöèò áóäåò âñþ æèçíü èñêàòü ñâîé îñîáåííûé àíòèãåí, ñëîâíî äîáðûé ìîëîäåö — åäèíñòâåííóþ âîçëþáëåííóþ. Êàê èìåííî ôîðìèðóåòñÿ òàêîå ìíîãîîáðàçèå ëèìôîöèòîâ, ÿ ðàññêàæó â ñëåäóþùåì ïîñòå.
Îäíàêî âçàèìîäåéñòâèå ëèìôîöèòà è êëåòêè íå çàêàí÷èâàåòñÿ òîëüêî ñîåäèíåíèåì MHC 1 c Ò-êëåòî÷íûì ðåöåïòîðîì. Ìíå íå õî÷åòñÿ, ÷òîáû ÷èòàòåëè äóìàëè, áóäòî èììóííàÿ ñèñòåìà — ýòî íåêèé îòíîñèòåëüíî ïðîñòîé ìåõàíèçì, êîòîðûé äîñòàòî÷íî óêðåïèòü êàêèìè-òî âîëøåáíûìè òàáëåòêàìè, ëèìîíàìè, èìáèðÿìè, âèòàìèíàìè è ïðî÷èìè ñíàäîáüÿìè.
Ïîýòîìó âîò âàì áîëåå ïîäðîáíàÿ ñõåìà 🙂
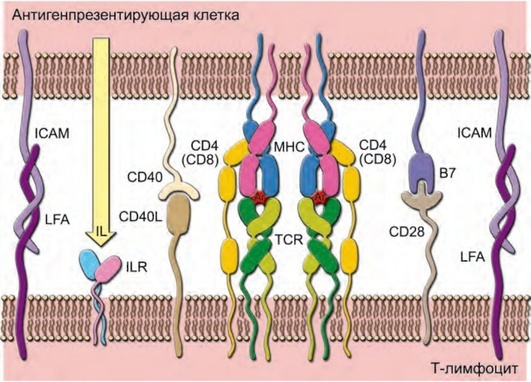
Ñèíàïñ ìåæäó ëèìôîöèòîì è àíòèãåíïðåçåíòèðóþùåé êëåòêîé. Ñèëüíî âíèêàòü íå ñòÎèò 🙂
È ýòî òîæå äàëåêî íå ïîëíûé ñïèñîê âñåõ ó÷àñòíèêîâ ïðîöåññà. Êîíå÷íî, ìû íå áóäåì óãëóáëÿòüñÿ â äåáðè ïðîèñõîäÿùåãî, èíà÷å âû ñîâñåì ïåðåñòàíåòå ÷èòàòü ìîè ïîñòû 🙂 Îäíàêî íóæíî ïîíèìàòü, ÷òî íàø îðãàíèçì — ýòî ïîëèöåéñêîå ãîñóäàðñòâî. Êàæäàÿ äåñÿòàÿ êëåòêà òåëà ïðåäñòàâëåíà ëèìôîöèòîì. Ïîýòîìó ðàáîòà òàêîé ñèñòåìû çàäåéñòâóåò îãðîìíîå êîëè÷åñòâî ìåõàíèçìîâ. Êðîâü è ëèìôà îìûâàþò âñå òêàíè îðãàíèçìà, è âìåñòå ñ ýòèì ëèìôîöèòû íåóñòàííî êóðñèðóþò âîêðóã òêàíåé, ïðîâåðÿÿ èõ öåëîñòíîñòü. ×åðåç êàæäûé ëèìôàòè÷åñêèé óçåë çà îäèí ÷àñ ïðîõîäèò ïðèìåðíî îäèí ìèëëèàðä ëèìôîöèòîâ.
À âíóòðè áëèæàéøåãî ëèìôàòè÷åñêîãî óçëà äåíäðèòíàÿ êëåòêà, ñïåøíî ïðèòàùèâøàÿ àíòèãåíû, ïðåçåíòèðóåò ÷óæåðîäíûå ïåïòèäû Ò-ëèìôîöèòàì. Òîò êèëëåð, êîòîðûé íàøåë ñâîé åäèíñòâåííûé àíòèãåí, àêòèâèðóåòñÿ è íà÷èíàåò àêòèâíî äåëèòüñÿ, ïîðîæäàÿ òûñÿ÷è êîïèé ñåáÿ (êëîíû). Ïîëó÷àåòñÿ àðìàäà áîéöîâ, íàöåëåííûõ íà îäèí êîíêðåòíûé àíòèãåí. Äåíäðèòíàÿ êëåòêà ïðèíîñèò íå îäèí àíòèãåí, à ìíîãî, ïîòîìó ÷òî ÷óæàê â íàøåì îðãàíèçìå îñòàâëÿåò ìíîãî ñëåäîâ. Íà êàæäûé ñëåä íàïàäàåò ñâîé êëîí ëèìôîöèòîâ. Åñëè äåíäðèòíàÿ êëåòêà àêòèâèðîâàëà CD8-ëèìôîöèò àíòèãåíàìè èç èíôèöèðîâàííîé êëåòêè — ãîðå åé!
Çäåñü âñòðå÷àþòñÿ ãîëóáîé ëèìôîöèò è îðàíæåâàÿ äåíäðèòíàÿ êëåòêà. Âèäåî áåññîâåñòíî âûðåçàíî îòñþäà
Àêòèâèðîâàííûå ëèìôîöèòû ïîêèäàþò ëèìôîóçåë è ñëåäóþò ê î÷àãó âîñïàëåíèÿ, âåäîìûå çàïàõîì âîéíû (öèòîêèíû, õåìîàòòðàêòàíòû è äðóãèå âåùåñòâà). Ïðè âñòðå÷å ñ èíôèöèðîâàííîé êëåòêîé, êîòîðàÿ âûñòàâèëà íà ñâîåé ïîâåðõíîñòè MHC 1 ñ àíòèãåíîì, Ò-êèëëåð çàäåéñòâóåò ðàçíûå ìåõàíèçìû óíè÷òîæåíèÿ ýòîé êëåòêè. Íî ñíà÷àëà êèëëåð óñòðàèâàåò óáèéñòâåííûå îáíèìàøêè — îí ïðèêðåïëÿåòñÿ ê êëåòêå, îáðàçóÿ ïëîòíûé êîíòàêò. Èìåííî ÷åðåç ùåëü â ýòîì êîíòàêòå ëèìôîöèò áóäåò âçàèìîäåéñòâîâàòü ñ ïîðàæåííîé êëåòêîé.
Ò-êèëëåð êîíòàêòèðóåò ñ êëåòêàìè, ïîêà íå âñòðåòèò òó, íà ïîâåðõíîñòè êîòîðîé åñòü «òîò îñîáûé» àíòèãåí.
 ýòó êîíòàêòíóþ ùåëü Ò-êèëëåð âûäåëÿåò ðàçëè÷íûå âåùåñòâà (ïåðôîðèíû, ãðàíçèìû, öèòîëèçèíû), âûçûâàþùèå íåêðîç èëè àïîïòîç êëåòêè. Ëèìôîöèò ìîæåò âûçâàòü çàïðîãðàììèðîâàííóþ ãèáåëü (àïîïòîç) èëè æå ñôîðìèðîâàòü ïîðû â ìåìáðàíå, â ðåçóëüòàòå ÷åãî êëåòêà íàáóõàåò è ëîïàåòñÿ (òî÷íåå, ëèçèðóåòñÿ). Ìåõàíèçì îáðàçîâàíèÿ ïîð ïîõîæ íà ìåìáðàíîàòàêóþùèé êîìïëåêñ êîìïëåìåíòà, î ÷åì ÿ ïèñàë â ïîñòå ïðî êîìïëåìåíò. Âàæíî òî, ÷òî ñîñåäíèå êëåòêè Ò-êèëëåð íå òðîãàåò, ðàáîòàåò î÷åíü òî÷íî è ïðèöåëüíî.  ýòîì, íàïðèìåð, ìîæíî óâèäåòü ðàçíèöó ïðè ñðàâíåíèè ñ ìàêðîôàãàìè è íåéòðîôèëàìè. Ïîñëåäíèå âûäåëÿþò ðàçëè÷íûå âåùåñòâà, êîòîðûå ïîâðåæäàþò ñîñåäíèå çäîðîâûå êëåòêè. À Ò-êèëëåð âñåãäà ðàçðóøàåò òîëüêî òó êëåòêó, ê êîòîðîé ïðèöåïèëñÿ. Óíè÷òîæèâ îäíó êëåòêó, îí ïîïîëçåò äàëüøå â ïîèñêàõ íîâîé æåðòâû.
Ò-êèëëåð, ñëîâíî áåçóìíûé îãíåííûé øàð, àòàêóåò ðàêîâóþ êëåòêó. Ïîëíîå âèäåî ñ îáúÿñíåíèÿìè çäåñü
Èòàê, ëèìôîöèòû — ýòî âèä ëåéêîöèòîâ, êîòîðûå îòíîñÿòñÿ ê àäàïòèâíîìó èììóíèòåòó. Èõ ïîâûøåíèå (ëèìôîöèòîç) îçíà÷àåò òåêóùóþ èëè íåäàâíþþ âèðóñíóþ èíôåêöèþ (ãðèïï, êîðîíàâèðóñ, êðàñíóõà, êîðü è ò.ä.), êîêëþø, íà÷àëüíóþ ñòàäèþ ÂÈ×. Ïîíèæåíèå ëèìôîöèòîâ (ëèìôîïåíèÿ) ïðîèñõîäèò ïðè îñòðûõ áàêòåðèàëüíûõ èíôåêöèÿõ è èììóíîäåôèöèòàõ (íàïðèìåð, ïðè ÂÈ×).
Îñîáûé âèä ëèìôîöèòîâ, Ò-êèëëåðû, çàíèìàåòñÿ ïîèñêîì è óíè÷òîæåíèåì èíôèöèðîâàííûõ è îïóõîëåâûõ êëåòîê. Àêòèâàöèÿ Ò-êèëëåðà ïðîèñõîäèò â ðåçóëüòàòå âçàèìîäåéñòâèÿ ñ äåíäðèòíîé êëåòêîé, êîòîðàÿ âûõâàòèëà ÷óæåðîäíûé àíòèãåí è ïðåçåíòîâàëà åãî öèòîòîêñè÷åñêîìó ëèìôîöèòó. Òàê êàê âçàèìîäåéñòâèå ëèìôîöèòîâ è àíòèãåíïðåçåíòèðóþùèõ êëåòîê ïðîèñõîäèò â ëèìôîóçëàõ, îíè ìîãóò óâåëè÷èâàòüñÿ â ðàçìåðàõ (íàïðèìåð, óâåëè÷åíèå ëèìôàòè÷åñêèõ óçëîâ ïðè àíãèíå).
Ñïàñèáî âñåì, êòî èìåë ìóæåñòâî äî÷èòàòü äî êîíöà 🙂 Àäàïòèâíûé èììóíèòåò — äîâîëüíî ñëîæíàÿ òåìà, íî, íàäåþñü, âàì ñòàëî ÷óòî÷êó ïîíÿòíåå.  ñëåäóþùåì ïîñòå ÿ ïîäðîáíåå ðàññêàæó î ðàçâèòèè T-ëèìôîöèòîâ è çà÷åì íàì íóæåí òèìóñ. Âñåì õîðîøåãî íàñòðîåíèÿ è òî÷íûõ ýôôåêòèâíûõ êèëëåðîâ!
