Механизмы врожденного иммунитета цитокины
Цитокины — составная часть молекулярных механизмов как врожденного, так и адаптивного иммунитета.
Это белковые молекулы, которые продуцируются всеми клетками иммунной системы, причем не только гематопоэтического, но и стромального происхождения. Цитокины могут действовать на те же или на другие клетки через высокоаффинные рецепторы, запуская каскады внутриклеточной сигнализации, которые способны приводить к активации или репрессии, запуску дифференцировки или апоптоза и т. д. Цитокины могут действовать дистально и системно (как это делают гормоны, причем цитокины структурно родственны некоторым классам белковых гормонов), но могут действовать местно и даже только на те клетки, которые находятся в непосредственном контакте с клеткой-продуцентом, а также аутокринно. Одни цитокины секретируются, а другие заякорены на мембране клетки-продуцента, и только при определенных условиях могут быть высвобождены.
Мы более подробно рассмотрим цитокины, важные именно для системы врожденного иммунитета, хотя многие цитокины мультифункциональны (плейотропны) и такой упрощенной классификации не подчиняются.
Так, система цитокина ИЛ 1 (в действительности, три лиганда — два разных цитокина: ИЛ-1 альфа и — гораздо более важный — ИЛ-1 бета и «блокирующий» лиганд, называемый антагонистом рецептора, ИЛ-1 РА) вкупе с рецепторами семейства ИЛ-1, а также системы ИЛ-18 и ИЛ — 33, имеют прямое сходство с механизмами передачи сигнала в одной из центральных ветвей врожденного иммунитета — в Toll-подобных рецепторах. Подмножеством важных регуляторных и эффекторных генов, активируемых при врожденном иммунном ответе, оказались гены цитокинов, например провоспалительных (таких, как ФИО, ИЛ-6 или тот же ИЛ-1) или хемотактичсских (таких, как ИЛ-8 или МСР1). После продукции цитокины действуют на те же или другие клетки (аутокринно, паракринно или системно) через высокоаффинные рецепторы.
Напомним общие принципы передачи сигнала от цитокинов через цитокиновые рецепторы. Именно по типу передаваемого сигнала (что прямо связано со структурой внутриклеточной части рецептора) и следует классифицировать многочисленные семейства клеточных рецепторов цитокинов. Повторим, что многие структурные и биохимические парадигмы, лежащие в основе механизмов передачи внутриклеточного сигнала, справедливы и для нецитокиновых рецепторов (например, они справедливы и для рецепторов NK-клеток, рассмотренных выше).
У большинства цитокиновых рецепторов (кроме хемокиновых, об этом — дальше) передача сигнала основана на серии высокоаффинных белок-белковых взаимодействий в цитоплазме с участием адаптерных белков (в некоторых случаях адаптерные белки обладают белок-киназными активностями). В результате конформационных изменений в молекуле рецептора под действием связавшегося цитокина происходит одно из следующих событий:
(а) сближаются цитоплазматические домены рецепторов, которые обычно состоят из 2 или 3 отдельных полипептидных цепей (субъединиц). В результате образуется новая трехмерная молекулярная поверхность (иногда используют термин «молекулярная платформа»), на которую с большим сродством присоединяются специфичные для данного вида сигнализации адаптерные белки. В некоторых случаях адаптерные белки уже предассоциированы с рецептором, но связывание цитокина сближает их так же, как сближает сами субъединицы рецептора, с образованием новых платформ, на которые могут быть рекрутированы адаптерные белки «второй волны» или белок-киназы;
(б) адаптерный белок может иметь киназную активность (обычно — способность фосфорилировать другие белки по тирозину), и после сближения эта активность индуцируется, что приводит с специфическому фосфорилированию цитоплазматических частей рецептора или адаптерных молекул, или того и другого. Наличие заряженной и достаточно крупной фосфатной группы приводит к изменениям молекулярных поверхностей белкового комплекса, у которых появляется сродство к следующему белку сигнального каскада (это может быть адаптерный белок «второй волны», киназа или предшественник транскрипционного фактора).
При изучении сигнализации рецепторов иммунной системы (как клеточно-мембранных, так и цитоплазматических) были открыты белковые модули, которым свойственна гомотипичсская олигомеризация (по принципу «подобное липнет к подобному»), причем такая олигомеризация, во-первых, приводит с образованию новых молекулярных платформ, а, во-вторых, если адаптерный белок имеет 2 таких (но разных!) модуля, он может одним модулем связываться с предсуществующим комплексом, а другим — рекрутировать в комплекс следующие белки сигнального каскада.
Некоторые такие модули (которые получили «звонкие» названия, например упоминавшиеся раньше «домены смерти»), они участвуют как в передаче сигнала для активации транскрипционных факторов, так и в активации каспаз, особого вида протеаз. Последние способны запускать каскады программируемой клеточной смерти, хотя в случае каспазы-1 важным для механизмов врожденного иммунитета событием является расщепление предшественника ИЛ-1 бета, который после секреции через свой рецептор запускает провоспалительный каскад.
Кроме того, одним из относительно недавно понятых общих механизмов внутриклеточной регуляции (это полностью справедливо и для клеток иммунной системы) является регулируемая деградация белков, причем одним из «поцелуев смерти» для белка является присоединение убиквитина (об этом речь шла при рассмотрении сигналов от TLR). В большинстве сигнальных путей имеются белки-регуляторы, которые по умолчанию ингибируют дальнейшую передачу сигнала. Соответственно, их деградация в результате регулируемого убиквитинирования может приводить к активации сигнального каскада.
В других случаях рецепторы могут обходиться без дополнительных адаптерных белков и непосредственно привлекать и связывать киназы (например, JAK-киназы) на своих цитоплазматических доменах. Наконец, существует несколько семейств рецепторов, которые содержат киназные активности (тирозиновую или серин-трсониновую) прямо внутри своих цитоплазматических доменов. Механизмы дальнейшей передачи сигнала у таких рецепторов, как правило, отличаются от приведенной выше парадигмы.
Теперь рассмотрим примеры конкретных семейств рецепторов и особенности их сигналлинга.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 июля 2019;
проверки требуют 3 правки.
Цитокины — небольшие пептидные информационные молекулы.
Цитокины имеют молекулярную массу, не превышающую 30 кD.
Цитокин выделяется на поверхность клетки А и взаимодействует с рецептором находящейся рядом клетки В. Таким образом, от клетки А к клетке В передается сигнал, который запускает в клетке В дальнейшие реакции.
Их основными продуцентами являются лимфоциты.
Кроме лимфоцитов их секретируют макрофаги, гранулоциты, ретикулярные фибробласты, эндотелиальные клетки и другие типы клеток.
Они регулируют межклеточные и межсистемные взаимодействия, определяют выживаемость клеток, стимуляцию или подавление их роста, дифференциацию, функциональную активность и апоптоз, а также обеспечивают согласованность действия иммунной, эндокринной и нервной систем в нормальных условиях и в ответ на патологические воздействия.
Термин предложен Стэнли Коэном (англ. S. Cohen) в 1974 г.[1]
Цитокины активны в очень малых концентрациях. Их биологический эффект на клетки реализуется через взаимодействие со специфическим рецептором, локализованным на клеточной цитоплазматической мембране. Образование и секреция цитокинов происходит кратковременно и строго регулируется.
Все цитокины, а их в настоящее время известно более 30, по структурным особенностям и биологическому действию делятся на несколько самостоятельных групп. Группировка цитокинов по механизму действия позволяет разделить цитокины на следующие группы:
- провоспалительные, обеспечивающие мобилизацию воспалительного ответа (интерлейкины 1,2,6,8, ФНОα, интерферон γ);
- противовоспалительные, ограничивающие развитие воспаления (интерлейкины 4,10, TGFβ);
- регуляторы клеточного и гуморального иммунитета — (естественного или специфического), обладающие собственными эффекторными функциями (противовирусными, цитотоксическими).
Спектры биологических активностей цитокинов в значительной степени перекрываются: один и тот же процесс может стимулироваться в клетке более чем одним цитокином. Во многих случаях в действиях цитокинов наблюдается синергизм. Цитокины — антигеннеспецифические факторы, поэтому специфическая диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью определения уровня цитокинов невозможна. Но определение их концентрации в крови даёт информацию о функциональной активности различных типов иммунокомпетентных клеток; о тяжести воспалительного процесса, его переходе на системный уровень и о прогнозе заболевания.
Цитокины регулируют активность гормональной оси гипоталамус-гипофиз-надпочечники:[2] например, Интерлейкин 1, воздействуя на гипоталамус, усиливает синтез кортиколиберина, что, в свою очередь, повышает выработку АКТГ.
См. также[править | править код]
- Фактор некроза опухоли (ФНО, англ. TNF)
- Остеопонтин
Примечания[править | править код]
Ссылки[править | править код]
- Научно-практический журнал «Цитокины и Воспаление»
- Цитокины — причина парадонтита (недоступная ссылка)
- Все о цитокинах — Иммунинфо
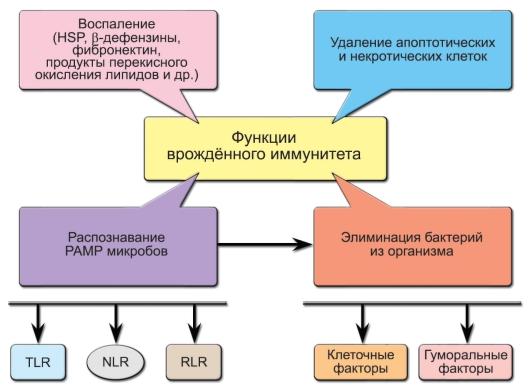
Врождённый
иммунитет — наиболее ранний защитный
механизм как в эволюционном плане (он
существует практически у всех
многоклеточных), так и по времени ответа,
развивающегося в первые часы и дни после
проникновения чужеродного материала
во внутреннюю среду, т.е. задолго до
развития адаптивной иммунной реакции.
Значительную часть патогенов инактивируют
именно врождённые механизмы иммунитета,
не доводя процесс до развития иммунного
ответа с участием лимфоцитов. И только
если механизмы врождённого иммунитета
не справляются с проникающими в организм
патогенами, в «игру» включаются лимфоциты.
При этом адаптивный иммунный ответ
невозможен без вовлечения механизмов
врождённого иммунитета. Кроме того,
врождённый иммунитет играет главную
роль в удалении апоптотических и
некротических клеток и реконструировании
повреждённых органов. В механизмах
врождённой защиты организма важнейшую
роль играют первичные рецепторы для
патогенов, система комплемента, фагоцитоз,
эндогенные пептиды-антибиотики и факторы
защиты от вирусов — интерфероны. Функции
врождённого иммунитета схематично
представлены на рис. 3-1.
Рецепторы распознавания «чужого»
На
поверхности микроорганизмов
присутствуют повторяющиеся
молекулярные углеводные и липидные
структуры, которые
в подавляющем большинстве случаев
отсутствуют на клетках организма
хозяина. Особые рецепторы, распознающие
этот «узор» на поверхности патогена, —
PRR (Pattern
Recognition Receptors –РRP-рецептор)
— позволяют клеткам врождённого иммунитета
обнаруживать микробные клетки. В
зависимости от локализации выделяют
растворимые и мембранные формы PRR.
• Циркулирующие
(растворимые) рецепторы для
патогенов — белки сыворотки крови,
синтезируемые печенью: липополисахаридсвязывающий
белок (LBP — Lipopolysaccharide
Binding Protein), компонент
системы комплемента C1q и белки острой
фазы MBL и С-реактивный белок (СРБ). Они
непосредственно связывают микробные
продукты в жидких средах организма и
обеспечивают возможность их поглощения
фагоцитами, т.е. являются опсонинами.
Кроме того, некоторые из них активируют
систему комплемента.

Рис.
3-1. Функции
врождённого иммунитета. Обозначения:
PAMP (PathogenAssociated
Molecular Patterns) —
молекулярные структуры микроорганизмов,
HSP (Heat
Shock Proteins) —
белки теплового шока, TLR (Toll-Like
Receptors), NLR (NOD-Like
Receptors), RLR (RIG-Like
Receptors) —
клеточные рецепторы
— СРБ, связывая
фосфорилхолин клеточных стенок ряда
бактерий и одноклеточных грибов,
опсонизирует их и активирует систему
комплемента по классическому пути.
— MBL принадлежит
к семейству коллектинов. Имея сродство
к остаткам маннозы, экспонированным на
поверхности многих микробных клеток,
MBL запускает лектиновый путь активации
комплемента.
— Белки
сурфактанта лёгких — SP-A и SP-D принадлежат
к тому же молекулярному семейству
коллектинов, что и MBL. Они, вероятно,
имеют значение в опсонизации (связывании
антител с клеточной стенкой микроорганизма)
лёгочного патогена — одноклеточного
грибка Pneumocystis
carinii.
• Мембранные
рецепторы. Эти
рецепторы расположены как на наружных,
так и на внутренних мембранных структурах
клеток.
— TLR (Toll-Like
Receptor —
Toll-подобный рецептор; т.е. сходный с
Toll-рецептором дрозофилы). Одни из них
непосредственно связывают продукты
патогенов (рецепторы для маннозы
макрофагов, TLR дендритных и других
клеток), другие работают совместно с
иными рецепторами: например, CD14 молекула
на макрофагах связывает комплексы
бактериального липополисахарида (ЛПС)
с LBP, а TLR-4 вступает во взаимодействие с
CD14 и передаёт соответствующий сигнал
внутрь клетки. Всего у млекопитающих
описано 13 различных вариантов TLR (у
человека пока только 10).
• Цитоплазматические
рецепторы:
— NOD-рецепторы (NOD1
и NOD2) находятся в цитозоле и состоят из
трёх доменов: N-концевого CARD-домена,
центрального NOD-домена (NOD — Nucleotide
Oligomerization Domain —
домен олигомеризации нуклеотидов) и
C-концевого LRR-домена. Различие между
этими рецепторами заключается в
количестве CARD-доменов. Рецепторы NOD1 и
NOD2 распознают мурамилпептиды — вещества,
образующиеся после ферментативного
гидролиза пептидогликана, входящего в
состав клеточной стенки всех бактерий.
NOD1 распознаёт мурамилпептиды с концевой
мезодиаминопимелиновой кислотой
(meso-DAP), которые образуются только из
пептидогликана грамотрицательных
бактерий. NOD2 распознаёт мурамилдипептиды
(мурамилдипептид и гликозилированный
мурамилдипептид) с концевым D-изоглутамином
или D-глутаминовой кислотой, являющиеся
результатом гидролиза пептидогликана
как грамположительных, так и
грамотрицательных бактерий. Кроме того,
NOD2 имеет сродство к мурамилпептидам с
концевым L-лизином, которые есть только
у грамположительных бактерий.
— RIG-подобныерецепторы (RLR, RIG-Like
Receptors): RIG-I (Retinoic
acid-Inducible Gene I),
MDA5 (Melanoma
Differentiation-associated Antigen 5)
и
LGP2 (Laboratory
of Genetics and Physiology 2).
Все
три рецептора, кодируемые этими генами,
имеют сходную химическую структуру и
локализуются в цитозоле. Рецепторы
RIG-I и MDA5 распознают вирусную РНК. Роль
белка LGP2 пока неясна; возможно, он
выполняет роль хеликазы, связываясь с
двуцепочечной вирусной РНК, модифицирует
её, что облегчает последующее распознавание
с помощью RIG-I. RIG-I распознаёт односпиральную
РНК с 5-трифосфатом, а также относительно
короткие (<2000 пар оснований) двуспиральные
РНК. MDA5 различает длинные (>2000 пар
оснований) двуспиральные РНК. Таких
структур в цитоплазме эукариотической
клетки нет. Вклад RIG-I и MDA5 в распознавание
конкретных вирусов зависит от того,
образуют ли данные микроорганизмы
соответствующие формы РНК.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
ИММУНИТЕ́Т животных и человека (от лат. immunitas – освобождение, избавление), способность организма поддерживать свою целостность и биологическую индивидуальность путём распознавания и удаления чужеродных веществ и клеток. Учение об И. родилось из необходимости преодолеть инфекц. болезни, эпидемии которых (чума, холера, оспа и др.) до кон. 19 в. уносили большое число жизней людей. В связи с этим под термином «И.» долгое время понимали невосприимчивость организма к инфекц. заболеваниям. Дальнейшие исследования показали, что И. – это также устойчивость организма к пересаживаемым органам и тканям, к изменившимся собств. клеткам, включая раковые, а также к чужеродным веществам животного и растит. происхождения. В поддержании И. участвуют защитные механизмы врождённого (неспецифического) и приобретённого (специфического, или адаптивного) иммунитета.
Формы врождённого и приобретённого иммунитета и их взаимосвязь
Врождённый И. присущ всем многоклеточным животным, осуществляется специализир. клетками, развивающимися вне зависимости от поступления в организм чужеродных и потенциально опасных агентов; его неспецифич. защитные механизмы реализуются после кратковременной активации специализир. клеток. Приобретённый И. характерен для хрящевых и костных рыб, земноводных, пресмыкающихся, птиц и млекопитающих, его основой является иммунный ответ – цепь реакций иммунной системы, которая включается чужеродными агентами (антигенами) и приводит к формированию клеток и молекул, удаляющих эти агенты или продукты их разрушения из организма. В отличие от врождённого И., реакции которого универсальны в отношении разл. чужеродных агентов, иммунный ответ приобретённого И. специфичен (направлен против агентов, включивших этот иммунный ответ). Обе формы И. тесно взаимосвязаны: иммунный ответ развивается лишь при условии предварит. активации врождённого И., а продукты приобретённого И. повышают эффективность врождённого И. Реакции И. осуществляются спец. клетками – иммуноцитами. У высших животных, напр., это лейкоциты, которые созревают в кроветворных органах и некоторое время циркулируют в крови, а затем заселяют ткани. Реакции врождённого И. обеспечивают миелоидные клетки (нейтрофильные и эозинофильные гранулоциты, моноциты и их тканевые формы – макрофаги, дендритные и тучные клетки) и частично – лимфоидные дендритные клетки. Реакции приобретённого И. реализуются Т- и В-лимфоцитами.
Процесс распознавания чужеродных агентов в организме: рецепторы врождённого и приобретённого иммунитета
Распознавание чужеродных молекул в организме осуществляется с помощью спец. белковых рецепторов. Рецепторы врождённого И. имеют сродство к небольшому числу молекул, характерных для болезнетворных микроорганизмов (патогенов), но отсутствующих в организме данного вида. Такие молекулы (бактериальные липополисахариды, гликолипиды, пептидогликаны, нуклеиновые кислоты бактерий и вирусов и др.) называют молекулярными «образами», связанными с патогенами (PAMP – от pathogen-associated molecular patterns); они сигнализируют о потенциальной опасности со стороны патогенов. Распознавание РАМР осуществляют неск. типов рецепторов (т. н. Toll- и NOD-рецепторы, лектиновые рецепторы), которые представлены небольшим числом вариантов (ок. 10) и располагаются на поверхности или внутри клеток системы врождённого И.; такое распознавание надёжно, поскольку детерминируется генами зародышевой линии. Связывание РАМР с рецепторами приводит к активации клеток системы врождённого иммунитета.
Гл. особенность распознавания рецепторов в рамках приобретённого И. состоит в том, что каждый рецептор распознаёт конкретную чужеродную молекулу, называемую антигеном, точнее фрагмент антигена – его эпитоп, или антигенную детерминанту. При этом разные лимфоциты несут на своей поверхности рецепторы к разным эпитопам. Т. о., каждая клетка способна распознать только один эпитоп (или группу структурно сходных эпитопов) и лишь популяция лимфоцитов в целом способна обеспечить распознавание всего разнообразия чужеродных молекул, для чего требуется 105–107 вариантов рецепторов. В геноме животных содержится неск. сотен вариантов генов, кодирующих антигенраспознающие рецепторы лимфоцитов. Их вариабельность сильно возрастает при дифференцировке лимфоцитов в процессе перестройки соответствующих генов. Последняя происходит в каждой клетке автономно, в результате чего каждый лимфоцит и его потомство (клон) располагают индивидуальным по специфичности рецептором. Существует три типа антигенраспознающих рецепторов – два варианта (белковые димеры αβ и γδ , родственные иммуноглобулинам) в субпопуляциях Т-лимфоцитов и один (мембранный иммуноглобулин) в популяции В-лимфоцитов. Рецепторы В-лимфоцитов распознают эпитопы нативных молекул антигена, а Т-лимфоцитов – эпитопы, предварительно выщепленные из целой молекулы и включённые в состав молекулы главного комплекса гистосовместимости. Такую обработку антигена осуществляют антигенпредставляющие клетки. Для активации Т-лимфоцитов при этом требуется дополнит. стимуляция (костимуляция) с помощью молекул, образующихся при активации врождённого И. В отсутствии костимуляции формируется анергия (неотвечаемость) Т-лимфоцитов. При стимуляции В-лимфоцитов источником костимулирующих сигналов служит Т-лимфоцит (в частности, Т-хелпер, или клетка-помощник). Активация лимфоцитов – условие их последующей пролиферации (для обеспечения количества клеток, достаточного для осуществления защиты) и дифференцировки в эффекторные (исполнительные) клетки, которые обеспечивают реакции приобретённого иммунитета.
Механизмы удаления чужеродных агентов из организма при врождённом и приобретённом иммунитете
Удаление чужеродных агентов из организма осуществляется с использованием комплекса механизмов, бо́льшая часть которых формируется в рамках врождённого И. Эффекторные механизмы И. разделяют на клеточные и гуморальные. Клеточные механизмы врождённого И. приводят к цитолизу (разрушению клеток). Из трёх вариантов последнего (внутриклеточный, внеклеточный и контактный) наиболее эффективен внутриклеточный цитолиз, реализуемый в процессе фагоцитоза: чужеродная клетка захватывается фагоцитами (нейтрофилами, макрофагами и др. клетками) и, оказавшись внутри фаголизосомы, сначала убивается активными формами кислорода, оксидом азота и бактерицидными пептидами, а затем расщепляется ферментами. Внеклеточному цитолизу бактерицидными факторами, секретируемыми лейкоцитами (в т. ч. эозинофилами), подвергаются, напр., клетки многоклеточных паразитов, контактному цитолизу – инфицированные вирусом или опухолевые клетки с помощью т. н. NK-клеток (от англ. natural killer – естественный истребитель). В зоне контакта последних с клетками-мишенями формируется микрополость, в которую NK-клетка секретирует вещества, одни из которых формируют поры в мембране клетки-мишени, а другие, проникнув через эти поры, включают процесс апоптоза – активной формы гибели клетки. Гуморальными факторами врождённого И., способствующими удалению чужеродных агентов, являются бактерицидные пептиды (дефензины, кателицидины), белки острой фазы воспаления, компоненты системы комплемента, цитокины. Активируемые компоненты комплемента вызывают опсонизацию – облегчение фагоцитоза микроорганизмов или их лизис в результате формирования поры в мембране. Белки острой фазы (в т. ч. С-реактивный белок) опсонизируют чужеродные клетки и активируют комплемент. Цитокины обеспечивают формирование воспалит. реакции, в рамках которой реализуется врождённый И.; относящиеся к ним интерфероны оказывают противовирусное и противоопухолевое действие.
Осн. эффекторными факторами приобретённого И. служат цитотоксические Т-лимфоциты, цитокины, секретируемые Т-хелперами, и антитела. Цитотоксические Т-лимфоциты образуются в процессе клеточного иммунного ответа. Они реализуют своё действие с помощью механизма контактного цитолиза или апоптоза клеток-мишеней. Мишенью цитотоксических Т-лимфоцитов являются лишь те клетки, которые экспрессируют антигенные эпитопы, распознаваемые Т-лимфоцитами, т. е. их действие более прицельно, чем действие естеств. киллеров. Участие Т-хелперов в реализации эффекторной фазы иммунного ответа связано с секрецией цитокинов, прежде всего интерферона. При его действии на макрофаги (особенно в сочетании с фактором некроза опухоли) резко повышается бактерицидная активность последних и разрушаются даже те патогены (микобактерии, простейшие), которые не могут быть убиты без участия цитокинов. Т. о., гуморальные продукты Т-хелперов усиливают внутриклеточный цитолиз, осуществляемый в рамках врождённого И. Антитела, секретируемые плазматич. клетками, которые дифференцируются из В-лимфоцитов, представляют собой растворимую форму их антигенраспознающих рецепторов. Обладая способностью связываться с антигенами как в растворимой, так и в мембраносвязанной формах, они могут блокировать антигены и несущие их патогены. Результатом блокады может быть утрата микробными клетками подвижности, способности к адгезии, предотвращение инфицирования клеток вирусами. При связывании токсинов или ферментов антитела нейтрализуют их активность. Однако бо́льшая часть эффектов антител обусловлена привлечением эффекторных клеток и молекул. При взаимодействии с антигеном (см. Антиген – антитело реакция) демаскируются участки молекулы антитела, распознаваемые компонентами комплемента (C1q) и Fc-рецепторами эффекторных клеток – фагоцитов и естеств. киллеров. Связывание C1q приводит к активации комплемента с опсонизацией и/или лизисом чужеродной клетки. Связывание с Fc-рецептором макрофага или иного фагоцита облегчает фагоцитоз (опсонизацию). Распознавание антител, фиксированных на клетках-мишенях, Fc-рецепторами естеств. киллеров облегчает осуществление контактного цитолиза. Т. о., бóльшая часть проявлений эффекторной активности антител, как и клеточных факторов приобретённого И., состоит в повышении эффективности реакций врождённого И. и придании им специфичности в отношении конкретных антигенов.
В ходе иммунного ответа формируется иммунологическая память, не свойственная врождённому И. Её субстратом служат Т- и В-лимфоциты иммунологич. памяти, которые дифференцируются при первичном иммунном ответе, не принимая в нём участия, и затем длительно сохраняются в организме. Реакция этих клеток на антиген при его повторном поступлении (вторичный иммунный ответ) осуществляется более быстро и эффективно, чем реакция лимфоцитов при первом контакте с антигеном. На этом основано создание искусственного И. к возбудителям заболеваний путём вакцинации: ослабленный, убитый патоген или выделенные из него антигены вызывают формирование клеток памяти без развития инфекц. процесса, что повышает эффективность иммунной защиты при поступлении в организм активного патогена, несущего те же антигенные молекулы. Аналогичные подходы используют для создания И. к опухолевым клеткам с помощью онковакцин.
Патология иммунитета
может быть обусловлена его ослаблением (иммунодефициты) или извращённым проявлением (аутоиммунитет, аллергия). Иммунодефициты могут проявляться как самостоят. заболевания, обусловленные дефектом генов (первичные иммунодефициты), или как синдромы, сопутствующие др. заболеваниям или действию повреждающих факторов (вторичные иммунодефициты). Аутоиммунные болезни являются следствием развития иммунного ответа на собств. антигены организма. Основой аллергии служит неадекватно усиленная реакция И. на определённые антигены (аллергены); её причиной является выброс активных субстанций из тучных клеток при взаимодействии аллергена с IgE-антителами, фиксированными на поверхности этих клеток. К патологии И. могут быть отнесены также иммунологич. осложнения беременности (реакция на антигены плода). Особое место занимает реакция организма на трансплантаты чужеродных тканей, а также реакция иммуноцитов, содержащихся в трансплантате, на антигены организма (реакция трансплантат-против-хозяина). Необходимость предупреждения и лечения извращённых проявлений И. породила задачу ослабления И. путём «ингибирующей» вакцинации (аллерговакцины, вакцины против аутоиммунитета), что дополнило традиц. способы усиления И. против воздействия патогенных факторов (см. Иммунизация). Поиски путей направленной иммунокоррекции в значит. степени определяют прикладную значимость изучения И. и обусловливают обществ. интерес к иммунологич. проблемам. Наука об иммунитете называется иммунологией. См. также Иммунопатология.
