Механизмы врожденного иммунитета схема
Врождённый
иммунитет — наиболее ранний защитный
механизм как в эволюционном плане (он
существует практически у всех
многоклеточных), так и по времени ответа,
развивающегося в первые часы и дни после
проникновения чужеродного материала
во внутреннюю среду, т.е. задолго до
развития адаптивной иммунной реакции.
Значительную часть патогенов инактивируют
именно врождённые механизмы иммунитета,
не доводя процесс до развития иммунного
ответа с участием лимфоцитов. И только
если механизмы врождённого иммунитета
не справляются с проникающими в организм
патогенами, в «игру» включаются лимфоциты.
При этом адаптивный иммунный ответ
невозможен без вовлечения механизмов
врождённого иммунитета. Кроме того,
врождённый иммунитет играет главную
роль в удалении апоптотических и
некротических клеток и реконструировании
повреждённых органов. В механизмах
врождённой защиты организма важнейшую
роль играют первичные рецепторы для
патогенов, система комплемента, фагоцитоз,
эндогенные пептиды-антибиотики и факторы
защиты от вирусов — интерфероны. Функции
врождённого иммунитета схематично
представлены на рис. 3-1.
Рецепторы распознавания «чужого»
На
поверхности микроорганизмов
присутствуют повторяющиеся
молекулярные углеводные и липидные
структуры, которые
в подавляющем большинстве случаев
отсутствуют на клетках организма
хозяина. Особые рецепторы, распознающие
этот «узор» на поверхности патогена, —
PRR (Pattern
Recognition Receptors –РRP-рецептор)
— позволяют клеткам врождённого иммунитета
обнаруживать микробные клетки. В
зависимости от локализации выделяют
растворимые и мембранные формы PRR.
• Циркулирующие
(растворимые) рецепторы для
патогенов — белки сыворотки крови,
синтезируемые печенью: липополисахаридсвязывающий
белок (LBP — Lipopolysaccharide
Binding Protein), компонент
системы комплемента C1q и белки острой
фазы MBL и С-реактивный белок (СРБ). Они
непосредственно связывают микробные
продукты в жидких средах организма и
обеспечивают возможность их поглощения
фагоцитами, т.е. являются опсонинами.
Кроме того, некоторые из них активируют
систему комплемента.

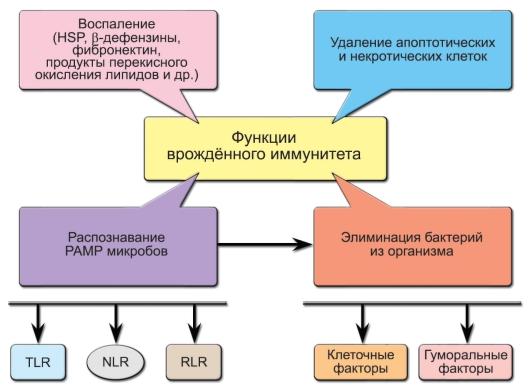
Рис.
3-1. Функции
врождённого иммунитета. Обозначения:
PAMP (PathogenAssociated
Molecular Patterns) —
молекулярные структуры микроорганизмов,
HSP (Heat
Shock Proteins) —
белки теплового шока, TLR (Toll-Like
Receptors), NLR (NOD-Like
Receptors), RLR (RIG-Like
Receptors) —
клеточные рецепторы
— СРБ, связывая
фосфорилхолин клеточных стенок ряда
бактерий и одноклеточных грибов,
опсонизирует их и активирует систему
комплемента по классическому пути.
— MBL принадлежит
к семейству коллектинов. Имея сродство
к остаткам маннозы, экспонированным на
поверхности многих микробных клеток,
MBL запускает лектиновый путь активации
комплемента.
— Белки
сурфактанта лёгких — SP-A и SP-D принадлежат
к тому же молекулярному семейству
коллектинов, что и MBL. Они, вероятно,
имеют значение в опсонизации (связывании
антител с клеточной стенкой микроорганизма)
лёгочного патогена — одноклеточного
грибка Pneumocystis
carinii.
• Мембранные
рецепторы. Эти
рецепторы расположены как на наружных,
так и на внутренних мембранных структурах
клеток.
— TLR (Toll-Like
Receptor —
Toll-подобный рецептор; т.е. сходный с
Toll-рецептором дрозофилы). Одни из них
непосредственно связывают продукты
патогенов (рецепторы для маннозы
макрофагов, TLR дендритных и других
клеток), другие работают совместно с
иными рецепторами: например, CD14 молекула
на макрофагах связывает комплексы
бактериального липополисахарида (ЛПС)
с LBP, а TLR-4 вступает во взаимодействие с
CD14 и передаёт соответствующий сигнал
внутрь клетки. Всего у млекопитающих
описано 13 различных вариантов TLR (у
человека пока только 10).
• Цитоплазматические
рецепторы:
— NOD-рецепторы (NOD1
и NOD2) находятся в цитозоле и состоят из
трёх доменов: N-концевого CARD-домена,
центрального NOD-домена (NOD — Nucleotide
Oligomerization Domain —
домен олигомеризации нуклеотидов) и
C-концевого LRR-домена. Различие между
этими рецепторами заключается в
количестве CARD-доменов. Рецепторы NOD1 и
NOD2 распознают мурамилпептиды — вещества,
образующиеся после ферментативного
гидролиза пептидогликана, входящего в
состав клеточной стенки всех бактерий.
NOD1 распознаёт мурамилпептиды с концевой
мезодиаминопимелиновой кислотой
(meso-DAP), которые образуются только из
пептидогликана грамотрицательных
бактерий. NOD2 распознаёт мурамилдипептиды
(мурамилдипептид и гликозилированный
мурамилдипептид) с концевым D-изоглутамином
или D-глутаминовой кислотой, являющиеся
результатом гидролиза пептидогликана
как грамположительных, так и
грамотрицательных бактерий. Кроме того,
NOD2 имеет сродство к мурамилпептидам с
концевым L-лизином, которые есть только
у грамположительных бактерий.
— RIG-подобныерецепторы (RLR, RIG-Like
Receptors): RIG-I (Retinoic
acid-Inducible Gene I),
MDA5 (Melanoma
Differentiation-associated Antigen 5)
и
LGP2 (Laboratory
of Genetics and Physiology 2).
Все
три рецептора, кодируемые этими генами,
имеют сходную химическую структуру и
локализуются в цитозоле. Рецепторы
RIG-I и MDA5 распознают вирусную РНК. Роль
белка LGP2 пока неясна; возможно, он
выполняет роль хеликазы, связываясь с
двуцепочечной вирусной РНК, модифицирует
её, что облегчает последующее распознавание
с помощью RIG-I. RIG-I распознаёт односпиральную
РНК с 5-трифосфатом, а также относительно
короткие (<2000 пар оснований) двуспиральные
РНК. MDA5 различает длинные (>2000 пар
оснований) двуспиральные РНК. Таких
структур в цитоплазме эукариотической
клетки нет. Вклад RIG-I и MDA5 в распознавание
конкретных вирусов зависит от того,
образуют ли данные микроорганизмы
соответствующие формы РНК.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Общие положения
Определение 1
Врожденный, или неспецифический иммунитет является более ранним механизмом защиты организма, как по времени ответа, так и в эволюционном плане.
Иммунный ответ при врожденном иммунитете развивается в первые несколько часов или дней после контакта с патогенным антигеном. Большая часть патогенов запускают механизмы врожденного иммунитета до развития иммунного ответа с присутствием лимфоцитов.
Организм-хозяин обладает различными механизмами врожденного иммунитета, эффективность которого при повторном контакте с возбудителем инфекции не возрастает.
Основную роль в механизмах неспецифической защиты организма играют:
- система комплемента,
- первичные рецепторы для патогенов,
- фагоцитоз, интерфероны (факторы защиты от вирусов),
- пептиды-антибиотики.
Барьеры против инфекций
От внедрения болезнетворных микроорганизмов, чужеродных клеток, организм защищают:
- кожа,
- секрет слизистых оболочек,
- движение ресничек эпителия,
- смывающий эффект и антибактериальное действие выделяемых жидкостей,
- нормальная микрофлора.
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Бактерия, внедрившаяся в организм, разрушается под действием лизоцима и подвергается дальнейшему фагоцитозу с последующим уничтожением фагоцитарными клетками.
К основным фагоцитарным клеткам относятся:
- полиморфноядерные нейтрофилы,
- мононуклеарные макрофаги.
Фагоцитарные клетки имеют рецепторы, способные распознавать на поверхности клеток патогенных микроорганизмов определенные молекулярные структуры. Вследствие этого фагоцит может связываться с микробной клеткой.
Компоненты микробных клеток распознают трансмембранные белки $TLR$ (Toll-подобные рецепторы. Их активация инициирует секрецию провоспалительных цитокинов.
По завершении фагоцитоза в действие вступают разнообразные бактерицидные механизмы:
- образуются реакционноспособные метаболиты кислорода;
- из гранул высвобождаются многочисленные кислород-независимые факторы;
- синтезируется оксид азота.
Привлечению фагоцитов к микробным клеткам и осуществлению фагоцитоза способствует активация по каскадному механизму многокомпонентной системы комплемента.
Комплемент выполняет ряд функций:
- микроорганизмы, покрытые белком $C_3b$, связываются с рецептором для $C_3b$ ($CR_1$) на оверхности фагоцитарных клеток, что способствует фагоцитозу;
- белок $C_5a$ оказывает активирующее и хемотаксическое воздействие на нейтрофилы, аналогично белки $C_3a$ и $C_5a$ воздействуют на эозинофилы, эти белки значительно повышают проницаемость капилляров;
- встраивание ЛМК в мембрану микробной клетки вызывает ее лизис;
- фрагмент $C_3b$ способствует продукции антител В-клетками.
Острая воспалительная реакция с участием комплемента
Активация комплемента участвует в следующих процессах:
- обеспечивает привлечение и стимуляцию нейтрофилов; приток полиморфноядерных лейкоцитов и повышение сосудистой проницаемости приводят к развитию острой воспалительной реакции, которая способна оказывать сильный антимикробный эффект;
- индуцирует экспрессию молекул адгезии на эндотелиах клетках, которые обеспечивают адгезию лейкоцитов и способствуют их проникновению между эндотелиальными клетками в очаг воспаления;
- активированные пептидом $C_5a$ фагоцитарные клетки, поглощают и уничтожают внедрившиеся в организм микробы;
- активированные пептидом $C_5a$ или компонентами микробных клеток тканевые макрофаги также могут инициировать воспаление, например, эндотоксином.
Гуморальные механизмы защиты
Гуморальные механизмы обеспечивают вторую линию защиты.
К факторам гуморальной защиты относятся:
- лизоцим;
- дефензины;
- система комплемента;
- белки острой фазы (С-реактивный белок, манносвязывающий лиганд);
- интерфероны (их регулярный эффект приводит к подавлению размножения вирусов);
- коллектины связываются с углеводными структурами на поверхности микробных клеток и с рецепторами фагоцитарных клеток, способствуя фагоцитозу.
Внеклеточное уничтожение микробов
Замечание 1
Клетки-киллеры (НК-клетки) обладают рецепторами, активирующими их цитотоксическую функцию, а также доминантными ингибиторными рецепторами, распознающими молекулы главного комплекса гистосовместимости класса I на поверхности не инфицированных и не измененных клеток.
НК-клетки разрушают инфицированные вирусами клетки. Вызывая запрограммированную клеточную гибель – апоптоз. Апоптоз может быть индуцирован или цитотоксическим эффектом перфорина и гранзимов, или взаимодействием лиганда Fas клеток-киллеров с рецептором Fas клеток-мишеней.
Внеклеточное уничтожение паразитов осуществляют эозинофилы, связываясь через свои $C_3b$-рецепторы с их поверхностью, покрытой $C_3b.$ Благодаря этому многие крупные паразиты, инвазирующие потенциально восприимчивый организм-хозяин, не вызывают заболевания.
Защитной реакцией или иммунитетом называется ответ организма на внешнюю опасность и раздражители. Множество факторов в теле человека способствуют его защите от различных болезнетворных организмов. Что такое врождённый иммунитет, как происходит защита организма и в чем заключается ее механизм?
Врожденный и приобретенный иммунитет
Само понятие иммунитета связано с эволюционно приобретенными способностями организма препятствовать попаданию в него чужеродных агентов. Механизм борьбы с ними разный, так как виды и формы иммунитета отличаются своим многообразием и характеристиками. По происхождению и формированию защитный механизм может быть:
- врожденный (неспецифический, естественный, наследственный) – защитные факторы в теле человека, которые были сформированы эволюционно и помогают бороться с чужеродными агентами с самого начала жизни; также данный вид защиты обуславливает видовую невосприимчивость человека к заболеваниям, которые свойственны животным, растениям;
- приобретенный – защитные факторы, которые формируются в процессе жизни, может быть естественным и искусственным. Естественная защита формируется после перенесенного воздействия, вследствие чего организм способен приобретать антитела к данному опасному агенту. Искусственная защита связана с введением в организм готовых антител (пассивная) или ослабленной формы вируса (активная).
Свойства врожденного иммунитета
Жизненно важным свойством врожденного иммунитета является постоянное наличие в организме естественных антител, которые обеспечивают первичную реакцию на вторжение патогенных организмов. Важное свойство естественной ответной реакции – система комплимента, которая представляет собой комплекс белков в крови, которые обеспечивают распознавание и первичную защиту от чужеродных агентов. Данная система выполняет следующие функции:
- опсонизация – процесс присоединения элементов комплекса к поврежденной клетке;
- хемотаксис – совокупность сигналов посредством химической реакции, которая привлекает другие иммунные агенты;
- мембранотропный повреждающий комплекс – белки комплимента, которые разрушают защитную мембрану опсонизированных агентов.
Ключевое свойство естественной ответной реакции – первичная защита, вследствие которой организм может получить информацию о новых для него чужеродных клеток, вследствие чего создается уже приобретенный ответ, который при дальнейшем столкновении с аналогичными патогенами будет уже готов для полноценной борьбы, без привлечения других факторов защиты (воспаления, фагоцитоза и т.д.).
Формирование врожденного иммунитета
Неспецифическая защита есть у каждого человека, она закреплена генетически, способна передаваться по наследству от родителей. Видовой особенностью человека является то, что он не восприимчив к ряду болезней, характерных для других видов. Для формирования врожденного иммунитета важную роль играет внутриутробное развитие и грудное вскармливание после рождения. Мать передает своему ребенку важные антитела, которые закладывают основу его первых защитных сил. Нарушение формирования естественной защиты может привести к иммунодефицитному состоянию из-за:
- воздействия излучения;
- химических агентов;
- болезнетворных организмов в период внутриутробного развития.
Факторы врожденного иммунитета
Что такое врождённый иммунитет и в чем состоит механизм его действия? Совокупность общих факторов врожденного иммунитета призваны создать определенную линию защиты организма от чужеродных агентов. Данная линия состоит из нескольких защитных барьеров, которые выстраивает организм на пути патогенных микроорганизмов:
- Эпителий кожи, слизистые оболочки – первичные барьеры, которые обладают колонизационной резистентностью. Вследствие проникновения патогена развивается воспалительная реакция.
- Лимфатические узлы – важная защитная система, которая борется с патогеном до внедрения его в систему кровообращения.
- Кровь – при попадании инфекции в кровь развивается системный воспалительный ответ, при котором задействуются специальные форменные элементы крови. Если микробы не погибают в крови – инфекция распространяется на внутренние органы.
Клетки врожденного иммунитета
В зависимости от механизмов защиты бывает гуморальный и клеточный ответ. Совокупность гуморальных и клеточных факторов создают единую систему защиты. Гуморальная защита – ответ организма в жидкостной среде, внеклеточном пространстве. Гуморальные факторы врожденного иммунитета подразделяются на:
- специфические – иммуноглобулины, которые вырабатывают В-лимфоциты;
- неспецифические – секреты желез, сыворотка крови, лизоцим, т.е. жидкости, обладающие антибактериальными свойствами. К гуморальным факторам относят систему комплимента.
Фагоцитоз – процесс поглощения инородных агентов, происходит посредством клеточной активности. Клетки, которые участвуют в ответе организма подразделяются на:
- Т-лимфоциты – долгоживущие клетки, которые подразделяются на лимфоциты с разными функциями (натуральные киллеры, регуляторы и др.);
- В-лимфоциты – продуцируют антитела;
- нейтрофилы – содержат антибиотические белки, имеют рецепторы хемотаксиса, поэтому мигрируют к месту воспаления;
- эозинофилы – участвуют в фагоцитозе, отвечают за обезвреживание гельминтов;
- базофилы – отвечают за аллергическую реакцию в ответ на раздражители;
- моноциты – специальные клетки, которые превращаются в разные виды макрофагов (костной ткани, легких, печени и т.д.), обладают множеством функций, в т.ч. фагоцитоз, активизация комплимента, регулирование процесса воспаления.
Стимуляторы клеток врожденного иммунитета
Последние исследования ВОЗ показывают, что почти у половины населения планеты важные иммунные клетки – натуральные киллеры, находятся в дефиците. Из-за этого люди чаще подвержены инфекционным, онкологическим заболеваниям. Однако есть специальные вещества, которые стимулируют активность киллеров, к ним относятся:
- иммуномодуляторы;
- адаптогены (общеукрепляющие вещества);
- трансферфакторные белки (ТБ).
Наибольшей эффективностью обладают ТБ, стимуляторы клеток врожденного иммунитета данного вида были обнаружены в молозиве и яичном желтке. Данные стимуляторы широко используют в медицине, их научились выделять из естественных источников, поэтому трансферфакторные белки сейчас находятся в свободном доступе в виде медицинских препаратов. Их механизм действия направлен на восстановление повреждений в системе ДНК, налаживание иммунных процессов видовой особенности человека.
Видео: врожденный иммунитет
Врожденный иммунитет. Материнский подарок
Внимание! Информация, представленная в статье, носит ознакомительный характер. Материалы статьи не призывают к самостоятельному лечению. Только квалифицированный врач может поставить диагноз и дать рекомендации по лечению, исходя из индивидуальных особенностей конкретного пациента.
Нашли в тексте ошибку? Выделите её, нажмите Ctrl + Enter и мы всё исправим!
Иммунитет — (лат. immunitas — освобождение) — защита организма от генетически чужеродных организмов и веществ, к которым относятся микроорганизмы, вирусы, черви, различные белки, клетки, в том числе и собственные изменённые клетки организма.
Иммунология — наука, изучающая иммунитет.
Иммунный ответ — это реакция организма на внедрение чужеродных агентов.
Антиген — любое чужеродное вещество или организм.
Антитело — вещество организма, распознающее антигены.
Антитела (иммуноглобулины) — особый класс гликопротеинов, присутствующих на поверхности B-лимфоцитов в виде рецепторов (рис. 1). Реагируя на присутствие антигена, они отделяются от мембраны В-лимфоцита и присутствуют в сыворотке крови и тканевой жидкости в виде растворимых молекул (антител). Антитела способны избирательно связываться с конкретными видами чужеродных молекул, которые в связи с этим называют антигенами.

Рис. 1. В-лимфоцит с мембрансвязанными рецепторами
Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов.
Антигены, как правило, являются белками или полисахаридами и представляют собой части бактериальных клеток, вирусов и других микроорганизмов.
К антигенам немикробного происхождения относятся белки пыльцы растений, яичный белок и белки трансплантатов тканей и органов, а также поверхностные белки клеток крови при переливании крови.
Аллергены — это антигены, вызывающие аллергические реакции.
История изучения иммунитета
Фундамент иммунологии был заложен изобретением микроскопа, благодаря чему удалось обнаружить первую группу микроорганизмов — болезнетворные бактерии.
В конце XVIII в. английский сельский врач Эдвард Дженнер сообщил о первой удачной попытке предотвратить заболевание посредством иммунизации. Его подход вырос из наблюдений за одним интересным явлением: доярки часто заражались коровьей оспой и впоследствии не болели натуральной оспой. Дженнер ввёл маленькому мальчику гной, взятый из пустулы (нарыва) коровьей оспы, и убедился в том, что мальчик оказался иммунным к натуральной оспе.
Работа Дженнера дала начало изучению теории микробного происхождения заболеваний в XIX в. Пастером во Франции и Кохом в Германии. Они отыскали антибактериальные факторы в крови животных, иммунизированных микробными клетками.
Луи Пастер успешно выращивал различные микробы в лабораторных условиях. Как часто бывает в науке, открытие было сделано случайно при культивировании возбудителей холеры кур. Во время работы одна из чашек с микробами была забыта на лабораторном столе. Было лето. Микробы в чашке несколько раз нагревались под солнечными лучами, высохли и потеряли способность вызывать заболевание. Однако куры, получившие эти неполноценные клетки, оказались защищёнными против свежей культуры холерных бактерий. Ослабленные бактерии не только не вызывали заболевание, а, напротив, давали иммунитет.
В 1881 г. Луи Пастер разработал принципы создания вакцин из ослабленных микроорганизмов с целью предупреждения развития инфекционных заболеваний.
В 1908 г. Илья Ильич Мечников и Пауль Эрлих были удостоены Нобелевской премии за работы по теории иммунитета.
И. И. Мечников создал клеточную (фагоцитарную) теорию иммунитета, согласно которой решающая роль в антибактериальном иммунитете принадлежит фагоцитозу.
Сначала И. И. Мечников как зоолог экспериментально изучал морских беспозвоночных фауны Чёрного моря в Одессе и обратил внимание на то, что определённые клетки (целомоциты) этих животных поглощают все инородные частицы (в т. ч. бактерии), проникающие во внутреннюю среду. Затем он увидел аналогию между этим явлением и поглощением белыми клетками крови позвоночных животных микробных телец. И. И. Мечников осознал, что это явление не питание данной единичной клетки, а защитный процесс в интересах целого организма. Учёный назвал действующие таким образом защитные клетки фагоцитами — «пожирающими клетками». И. И. Мечников первым рассматривал воспаление как защитное, а не разрушительное явление.
Против теории И. И. Мечникова в начале XX в. выступали большинство патологов, так как они считали лейкоциты (гной) болезнетворными клетками, а фагоциты — разносчиками инфекции по организму. Однако работы И. И. Мечникова поддержал Луи Пастер. Он пригласил И. И. Мечникова работать в свой институт в Париже.
Пауль Эрлих открыл антитела и создал гуморальную теорию иммунитета, установив, что антитела передаются ребёнку с грудным молоком, создавая пассивный иммунитет. Эрлих разработал метод изготовления дифтерийного антитоксина, благодаря чему были спасены миллионы детских жизней.
Теория иммунитета Эрлиха говорит о том, что на поверхности клеток есть специальные рецепторы, распознающие чужеродные вещества (антигенспецифические рецепторы). Сталкиваясь с чужеродными частицами (антигенами), эти рецепторы отсоединяются от клеток и в качестве свободных молекул выходят в кровь. В своей статье П. Эрлих назвал противомикробные вещества крови термином «антитело», так как бактерий в то время называли «микроскопические тельца».
П. Эрлих предполагал, что ещё до контакта с конкретным микробом в организме уже есть антитела в виде, который он назвал «боковыми цепями». Теперь известно, что он имел в виду рецепторы лимфоцитов для антигенов.
В 1908 г. Паулю Эрлиху вручили Нобелевскую премию за гуморальную теорию иммунитета.
Чуть раньше Карл Ландштейнер впервые доказал наличие иммунологических различий индивидуумов в пределах одного вида.
Питер Медавар доказал удивительную точность распознавания иммунными клетками чужеродных белков: они способны отличить чужеродную клетку всего по одному изменённому нуклеотиду.
Френк Бёрнет постулировал положение (аксиома Бёрнета), что центральным биологическим механизмом иммунитета является распознавание своего и чужого.
В 1960 г. Нобелевскую премию по физиологии и медицине получили Питер Медавар и Френк Бёрнет за открытие иммунологической толерантности (лат. tolerantia — терпение) — это распознавание и специфическая терпимость к некоторым антигенам.
Уничтожение генетически изменённых клеток
Одна из функций иммунной системы — это уничтожение генетически изменённых (мутантных) клеток организма. В процессе клеточного деления постоянно происходят ошибки, и одна из миллиона образовавшихся клеток становится мутантной, т. е. генетически чужеродной. В организме человека благодаря мутациям в каждый конкретный момент должно быть более 10 миллионов мутантных клеток. Мутации приводят к изменению функций клетки. Большинство мутантных клеток не способны выполнять свои функции, а многие выходят из-под контроля организма (например, при нарушении апоптоза) и становятся раковыми клетками. Появление таких клеток может привести к возникновению серьёзных заболеваний и гибели организма.
Один из механизмов иммунитета, осуществляемый лимфоцитами (НК-лимфоцитами), направлен на уничтожение именно раковых клеток.
Виды иммунитета
Иммунитет можно разделить на клеточный и гуморальный (рис. 2)
Рис. 2. Клеточный и гуморальный иммунитет
Все разнообразные формы иммунного ответа можно разделить на два типа: врождённый иммунитет и приобретённый иммунитет (рис. 3).
Рис. 3. Классификация иммунитета
Приобретённый иммунитет — это специфический индивидуальный иммунитет, т. е. это иммунитет, который имеется конкретно у определённых индивидуумов и к определённым возбудителям или агентам.
Главными характеристиками приобретённого иммунитета являются специфичность и иммунологическая память. Чем чаще организм встречается с патогеном, тем быстрее и активнее вырабатываются антитела, следовательно — сильнее защита.
Врождённый иммунитет с самого рождения (ещё до первой встречи с антигеном) защищает организм против всего чужеродного, т. е. он не специфичен.
Таким образом, повторная встреча с тем или иным патогенным микроорганизмом не приводит к изменениям врождённого иммунитета, но повышает уровень приобретённого.
Врождённый иммунитет активируется при первом появлении патогена быстрее, но распознаёт патоген с меньшей точностью. Он реагирует не на конкретные специфические антигены, а на определённые классы антигенов, характерные для патогенных организмов (белки вирусного капсида, продукты метаболизма глистов и т. п.).
Врождённый иммунитет может быть наследственным (видовым) и индивидуальным.
Наследственный (видовой) иммунитет — это невосприимчивость всех представителей данного вида к определённому антигену, приобретённая в процессе эволюции:
болезни, которыми болеет человек, но не болеют животные и птицы (корь, натуральная оспа, проказа, вирусный гепатит, холера, гонорея, дизентерия, брюшной тиф и др.);
болезни, которыми болеют животные, но не болеет человек (чума крупного рогатого скота, пироплазмоз собак);
болезни, которыми болеют птицы, но не болеет человек (куриная холера);
болезни, которыми болеют животные и человек, но не болеют птицы (сибирская язва, бешенство и др.).
Индивидуальный врождённый иммунитет определяется теми особенностями, которые передаются организму с родительскими генами и в процессе эмбрионального развития.
В процессе эмбрионального развития через плаценту плоду передаются антитела матери, которые противостоят инфекциям. Передача антител от мамы к ребёнку происходит в основном в последнем триместре беременности.
Иммунитет подразделяется на естественный и искусственный.
Естественный иммунитет возникает самостоятельно в процессе жизни организма.
Естественный иммунитет делится на активный (после перенесённых заболеваний) и пассивный (например, с молоком матери).
До 6 месяцев малыша защищают антитела, передающиеся от матери с грудным молоком. Поэтому важным является исключительно грудное вскармливание. Иммунитет матери защищает ребёнка. Дети, которые находятся на искусственном вскармливании, слабо защищены, т. к. собственных антител у них мало. Только к 6 месяцам организм самостоятельно начинает вырабатывать антитела. Собственный иммунитет ребёнка формируется только к концу первого года жизни.
Искусственный иммунитет организм приобретает в результате применения медицинских препаратов (вакцин и сывороток).
Вакцина — медицинский препарат, содержащий ослабленные или убитые микроорганизмы.
Вакцина вводится абсолютно (!) здоровому человеку для предотвращения заболевания в будущем.
Сыворотка — медицинский препарат плазмы крови без фибриногена, содержащий готовые антитела к определённому патогену (заражающему микроорганизму). Сыворотку получают из крови заражённого данным заболеванием животного (коровы, лошади и т. п.).
Сыворотка с чужими антителами вводится заболевшему человеку в случае, когда организм не способен произвести достаточное количество антител.
