Местный иммунитет секреторные иммуноглобулины
Иммуноглобулин А. Секреторный IgA в иммунитете слизистых оболочек.
Известно, что степень защиты от локальных вирусных инфекций респираторного и желудочно-кишечного трактов прежде всего зависит от содержания в организме специфического секреторного IgA, а не от наличия сывороточного IgG к энтеропатогенным или пневмотропным вирусам.
Стабильная структура, выраженный аффинитет к поверхности слизистых оболочек, преобладающее содержание в секрете молочной железы обусловливают биологическую роль секреторного IgA в защите организма от неблагоприятного воздействия различных патогенных агентов, в том числе вирусов.
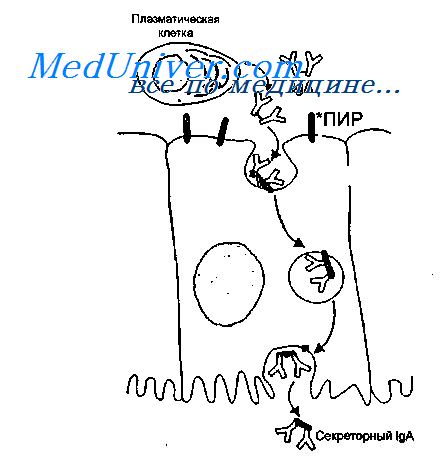
IgA синтезируется в димерной форме в клетках lamina propria и после связывания с иммуноглобулиновым рецептором, синтезированным в эпителиальных клетках, транспортируется на поверхность слизистой оболочки. В момент выхода IgA в просвет кишечника рецептор частично расщепляется, в результате чего в составе IgA остается фрагмент рецептора, который называют секреторным компонентом.
Таким образом, секреторный IgA является продуктом кооперации двух типов клеток — плазматических и эпителиальных.

Секреторный IgA образуется не только в димерной, но и в тетрамерной форме, что усиливает его вируснейтрализующую способность. Секреторный компонент предохраняет IgA от расщепления протеолитическими ферментами, что обусловливает его значительные преимущества перед антителами других классов. Секреторный IgA нейтрализует вирус не только в просвете кишечника, но и при транспортировке его внутрь клетки. Димер IgA может нейтрализовать вирус в подслизистой оболочке кишечника, а затем, связавшись с рецептором, транспортировать его в просвет кишечника.
Димерные иммуноглобулины класса A (US IgA), соединенные посредством j-цепи в единую структуру с секреторным компонентом, представляют собой уникальный пример эволюционной адаптации иммуноглобулинов на слизистых покровах для эффективного функционирования в условиях постоянного воздействия антигенов различной природы.
Исходя из способности к локальному синтезу молекул секреторного компонента, а также димерной формы IgA-местно расположенными плазматическими клетками, ткани слизистых покровов можно разделить на три основных класса.
В слизистых оболочках индуктивная и продуктивная фазы гуморального иммунного ответа разобщены пространственно в большей степени, чем в других отделах иммунной системы.
Клеточные и гуморальные превращения, связанные с появлением IgA во внешних секретах, представлены на рисунке.
В молоко и, по-видимому, в другие внешние секреты молекулы IgA поступают из двух главных источников. Большая часть IgA, выделяемого со слюной, секретами слезной и молочной желез, а также пищеварительного и респираторного трактов, образуется плазматическими клетками. Однако IgA, обнаруживаемые в различных внешних секретах, могут иметь и системное происхождение. Продуцируясь клетками слизистых оболочек одних органов, они поступают в кровь и переносятся в слизистые покровы других органов.
Антиген после проникновения внутрь пейеровой бляшки активирует Т- и В-лимфоциты, которые по лимфатическому протоку поступают в мезентериальный лимфатический узел, а затем в кровь, селезенку, снова в кровь и селективно локализуются в лимфатических образованиях всех слизистых оболочек и экзокринных секреторных железах — молочных, слюнных и слезных. При этом Т-лимфоциты локализуются преимущественно между эпителиальными клетками слизистой оболочки, обеспечивая клеточный иммунный ответ, а В-лимфоциты — в lamina propria, где они дифференцируются в плазматические клетки и синтезируют IgA.
Около 90% плазматических клеток в lamina propria продуцируют IgA, в то время как в лимфатических узлах доля таких клеток составляет всего 2—5%.
Уникальна в этом отношении роль печени. Имеются убедительные данные, свидетельствующие о том, что гепатоциты избирательно связывают и в последующем транспортируют IgA в желчь, тем самым усиливая систему секреторного IgA кишечника.
Возможной функцией печени также является удаление комплексов антиген — IgA из циркулирующей крови с желчью в кишечник. Изучение противовирусного иммунитета убедительно продемонстрировало, что степень защиты респираторного и желудочно-кишечного трактов от локальных вирусных инфекций прямо коррелирует с уровнем специфических секреторных IgA, а не с уровнем антител сыворотки крови. В основе противовирусного действия секреторного IgA лежит инактивация вируса.
— Также рекомендуем «Кишечник и иммунитет. Роль кишечника в работе иммунной системы человека.»
Оглавление темы «Патогенез и механизмы противовирусной защиты организма.»:
1. Иммунная система слизистых оболочек. Слизистая оболочка и вирусная инфекция.
2. Строение иммунной системы слизистых. Концепция общей иммунной системы слизистых оболочек.
3. Иммуноглобулин А. Секреторный IgA в иммунитете слизистых оболочек.
4. Кишечник и иммунитет. Роль кишечника в работе иммунной системы человека.
5. Респираторные органы и вирусная инфекция. Роль дыхательной системы в противовирусном иммунитете.
6. Молочная железа и вирусная инфекция. Роль молочной железы в противовирусном иммунитете.
7. Особенности иммунитета при вирусных инфекциях. Патогенез противовирусного иммунного ответа.
8. Разрушение эффекторных клеток иммунитета и макрофагов вирусами. Устранение действия цитокинов вирусами.
9. Индукция иммунологической толерантности вирусами. Иммуносупрессия при вирусной инфекции.
10. Гуморальный противовирусный иммуннитет. Клеточный противовирусный иммунный ответ.
Секреторные
иммуноглобулины препятствуют адгезии
микроорганизмов на эпителиальных
клетках слизистых оболочек полости
рта, кишечника, респираторных и
мочевыводящих путей. В агрегированной
форме активирует комплимент по
альтернативному пути, что приводит к
стимуляции местной фагоцитарной защиты.
Препятствуют адсорбции и репродукции
вирусов в эпителиальных клетках слизистой
оболочки, например, при кори, полиомиелите.
Иммуноглобулины
женского молока:
они представлены классами G,
M
и А, однако доминирующим является
секреторный IgА (SIgA)
SIgA
синтезируется В-лимфоцитами в лимфоидных
тканях молочной железы женщины и
поступает в молоко. Незадолго до конца
беременности в молочную железу мигрируют
иммунокомпетентные В-клетки из лимфоидных
образований кишечника, дых. Путей и др.
локализации. В лимфоидной ткани молочной
железы они размножаются и начинают
активно синтезировать SIgA антитела той
же специфичности, что и раньше – против
возбудителей острых инфекций кишечного,
респираторного тракта, мочеполовых
путей.
Защитная
роль SIgA заключается
в экранировании эпителия пищеварительного
тракта от чужеродных Аг инфекционного
и неинфекционного порядка. Эта фун-ия
реализуется путем специфического
связывания секреторными Ат бактерий,
вирусов, токсинов. В результате
предотвращается адгезия и колонизация
бактерий, проникновение в клетки и
кровоток вирусов и некоторых инвазивных
микробов.
Секреторные
Ат класса IgA – главный фактор местного
иммунитета пищеварительного тракта
против разнообразных энтеропатогенных
бактерий, вирусов и токсинов
Усилению
барьерной фун-ии слизистой кишечника
ребенка также способствует и др.
гуморальные факторы грудного молока –
лизоцим, лактоферрин, комплемент,
пропердин, лактопероксидаза. В грудном
молоке ак же содержатся сывороточные
Ig класса М, G,
A,
макрофаги, ЕК-кл-ки, В- и Т-лимфоциты,
иммуноцитокины (интерлейкины, интерферон)
Вместе
с тем замечено, что вскармливание
нативным грудным молоком существенно
активирует процесс становления иммунного
статуса ребенка, из крови быстрее
элиминируются малодифференцированные
формы клеток, созревание лимфоцитов
протекает более энергично.
19. Клеточный иммунный ответ.
Субпопуляции:
СD4+
лимфоциты: мембранные молекулы СD4 несут
различные популяции клеток, условно
разделяемые на регуляторные (хелперы)
и эффекторные (Тгтз)
Т-хелперы:
спецефически распознают Аг и взаимодействуют
с макрофагами и В-клетками в ходе индукции
гуморального иммунного ответа.
Аг-распознающие Т-лимфоциты «узнают»
чужеродный эпитоп вирусного или
опухолевого Аг в комплексе с молекулой
МНС на плазматической мембране
клетки-мишени.
Тгтз
(Т-эффекторные реакции гиперчувствительности
замедленного типа) опосредуют реакции
ГТЗ.
СD8+
лимфоциты: мембранные Аг СD8 экспрессируют
субпопуляции Т-клеток, разделяемые на
регуляторные (супрессорв) и эффекторные
(цитотоксические Т-лимфоциты)
Т-супрессоры:
регулируют интенсивность иммунного
ответа, подавляя активность СD4+ клеток.
Т-супрессоры предотвращают развитие
аутоиммунных реакций, защищают организм
от нежелательных последствий иммунных
реакций. Эти клетки обеспечиваю
толерантность матери к чужеродным Аг,
представленным на клетках вынашиваемого
плода. Это дает возможность развиваться
чужеродному в иммунном отношении плоду
в организме матери. Активация супрессоров
находится вне контроля МНС и представления
Аг макрофагом не требуется. Аутоантигены
могут стимулировать развитие
ауторегуляторных Т-супрессоров.
Чужеродные Аг в неиммунногенной форме
(гаптены) или иммуногенные Аг в очень
высокой концентрации также способны
индуцировать специфическую супрессерную
активность клеток. После распознавания
Аг зрелые лимфоциты препяттвуют развитию
иммунного ответа, действуя непосредственно
на клетки или секретируя супрессорные
факторы.
Цитотоксические
Т-лимфоциты (ЦТЛ) или Т-киллеры лизируют
клетки-мишени, несущие чужеродные или
видоизмененные аутоантигены (напр.
Клетки опухолей, трансплантатов,
инфицированные вирусами, клетками,
несущие поверхностные вирусные Аг). ЦТЛ
распознает чужеродный вирусный,
опухолевый или трансплантационный Аг
в комплексе с молекулой МНС I
на мембране клетки-мишени. Индукция
цитотоксических свойств клетки-предшественницы
Т-киллера происходит под действие двух
сигналов. Первый сигнал включает
взаимодействие между двумя комплексами:
поверхностной молекулой CD8
лимфоцита и комплексом эпитоп-молекула
МНС
I на клетке-мешени. Второй сигнал: ИЛ,
секретируемые близлежащими макрофагами
и т-клетками. Т-хелпер играет ключевую
роль в активации ЦТЛ в качестве источника
необходимых цитокинов, усиливающих их
пролиферацию и созревание до функционально
активных ЦТЛ. Цитотоксический эффект
Т-киллеров реализуется через образование
в клетках-мишенях пор под действие
особых белков-перфоринов. Нарушение
осмотического баланса с внеклеточной
средой приводит к гибели клетки.
Т-клетки
памяти: образуются при первичном иммунном
ответе. Специфически распознают Аг и
участвуют в иммунном ответе при вторичном
попадании Аг. Большинство клеток памяти
обладают функциями Т-клеток, экспрессируют
CD4 и рестригированы по молекулам МНС
II,
т.е. узнают Аг только на Аг-представляющих
клетках в связи с молекулой
МНС
II.
Возрастные
особенности клеточного иммунитета
Для
периода новорожденности характерен
слабый иммунный ответ на Аг из-за
незрелости Т-лимфоцитов, а также в связи
слабой функциональной слабостью
фагоцитоза (мала концентрация опсонинов
в крови, снижен процессинг Аг макрофагами,
что ведет к невыразительной антигенной
презентации). Еще недостаточно развиты
естественные киллеры
(ЕК-клетки).
Этим, в частности, объясняется низкий
уровень гамма-интерферона.
К
концу 1-го года концентрация лимфоцитов
в крови достигает максимума, хелперная
функция уже доминирует над супрессерной.
Так же реакция замедленной
гиперчувствительности достигает полного
развития.
В
12-13 лет уменьшается масса лимфоидных
органов, что связано с пубертатным
скачком роста и веса детей. Подавляется
функция Т-системы (клеточный иммунитет),
стимулируется функция В-системы
(гуморальный иммунитет).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
Поскольку первый этап взаимодействия организма с биологическими агентами происходит на поверхности тела, сообщающимися с внешней средой (кожа, слизистые оболочки глаз, дыхательная, пищеварительная и мочеполовая системы), в процессе эволюции путем естественного отбора закрепился комплекс защитных приспособлений, часть из которых является анатомо-физиологической особенностью этих органов.
Весь этот комплекс защитных приспособлений делится на 3 группы.
- Одну из них можно охарактеризовать как неспецифические приспособления: особенности строения носа, барьерная функция слизистых оболочек, роговицы, двигательная активность реснитчатого псевдомногослойного эпителия дыхательного аппарата. Неспецифическими они названы потому, что в равной мере защищают органы и системы от инфицированных и неинфицированных частиц, пыли, различных физических воздействий.
- Вторую группу составляют приспособления, предупреждающие поражение организма от чужеродных агентов. Эти приспособления, которые можно подразделить на клеточные и секреторные, в совокупности это материальный субстрат местного неспецифического иммунитета. К клеточным неспецифическим защитным факторам относится поглотительная функция макро- и микрофагов, а к секреторным — антибактериальные и антивирусные вещества внешних секретов: лактоферрин, лизоцим и интерферон, некоторые другие еще недостаточно изученные вещества.
- Третью группу приспособлений местной невосприимчивости составляют факторы, определяющие особенности местного специфического иммунитета. Специфический иммунитет также обеспечивается клеточным и секреторным субстратом. Клеточную основу специфического местного иммунитета составляют Т-лимфоциты, а секреторную — антитела, относящиеся главным образом к особой форме иммуноглобулина А.
Основная функция местной невосприимчивости — это поддержание гомеостаза внутренней среды организма. Но помимо этого организм имеет свои только ему присущие черты: обеспечение структурной и функциональной целостности тканей, соприкасающихся с внешней средой, предупреждение передачи возбудителей инфекции от больного к здоровому.
Два основных доказательства подтверждают необходимость выделения «местного иммунитета» в особую защитную систему организма:
- данные, что значительная часть специфических и неспецифических веществ, осуществляющих функции местной устойчивости (антитела, ингибиторы), синтезируются клетками, находящимися в непосредственной близости от защищаемых поверхностей, при этом указанные вещества весьма часто по своей структуре отличаются от таковых, принимающих участие в формировании как общей резистентности организма, так и специфического иммунитета;
- взаимодействие факторов местного иммунитета с чужеродными агентами, бактериями и вирусами происходит в иных физико-химических условиях, резко отличающихся от условий внутренней среды.
Клеточные и гуморальные основы местного иммунитета
Согласно последним сведениям, нет принципиальных различий между местным и общим клеточным иммунитетом. Его материальным субстратом являются, как известно, три системы клеток: Т- и В-лимфоциты, макрофаги.
Перечисленные типы клеток важны в местном иммунитете. Однако и другие клеточные системы принимают деятельное участие в реализации местной защиты. К ним относятся нейтрофильные гранулоциты, которые благодаря присущему им фагоцитозу очищают дистальные участки легких от проникающих чужеродных частиц. Фагоцитарными свойствами обладают и лишенные ресничек клетки бронхиол — клетки Клара. В местной защите значительную роль играют также эпителиальные клетки, которые продуцируют ряд протеинов, гликопротеинов, обладающих противомикробным действием.
Роль Т-лимфоцитов в местном иммунитете
Одними из важных функций многочисленных Т-клеток, инфильтрирующих стенки слизистых оболочек дыхательной и пищеварительной систем, являются способность Т-лимфоцитов-хелперов регулировать продукцию В-клетками секреторных антител, а также осуществление клеточного иммунитета.
Исследованию местного клеточного иммунитета дыхательной системы посвящены работы R. Waldman. Было установлено, что у кроликов скорость спонтанного синтеза ДНК лимфоцитами, содержащимися в смывах бронхов, значительно возрастает в ответ на локальную иммунизацию. Гиперчувствительность замедленного типа (ГЗТ) у животных, перенесших аэрогенную инфекцию, носит локальный характер. Скорость развития местного клеточного иммунитета в дыхательной системе зависит от природы инфекции. Однако локальность клеточного иммунитета как дыхательной, так и других систем организма, не сообщающихся с внешней средой, не является абсолютной. Если антиген достаточно вирулентен и активен, то при аэрозольном его введении одновременно с местной развивается и системная ГЗТ.
Роль В-лимфоцитов в местном иммунитете
Накопленные в настоящий момент сведения позволяют установить, что в непосредственной близости к эпителиальной выстилке органов, сообщающихся с внешней средой, сосредоточено значительное количество плазмоцитов (В-лимфоцитов), продуцирующих иммуноглобулины всех классов. Вблизи слизистых оболочек желез преобладают клетки, содержащие и синтезирующие IgA, а на поверхности их отмечалось равное количество плазмоцитов, вырабатывающих IgA, IgG.
Важная роль в формировании секреторных антител принадлежит миндалинам.
В настоящее время считается бесспорным тот факт, что основным носителем специфической противовирусной и антибактериальной активности большинства наружных секретов является IgA, точнее его особая секреторная форма (SIgA). Однако, помимо IgA, которые обнаруживаются во всех внешних секретах, важные функции выполняют и IgG, которые определяются в отделяемом дистальных участков дыхательной системы и в пищеварительном аппарате, а также IgM (в молозиве и кишках) и IgE (в отделяемом дыхательной, пищеварительной систем). Последние Ig, несмотря на ничтожное их количество, имеют определяющее значение в патогенезе аллергических заболеваний и в предупреждении рецидивирующих воспалительных заболеваний дыхательной системы.
Известно, что строение иммуноглобулинов внешних секретов, за исключением IgA, практически не отличается от структуры молекул в крови. Молекулы секреторной формы IgA имеют особое строение. В отличие от сывороточного IgA, большая часть которого является 75-глобулином, молекула секреторного IgA двумерная и имеет константу седиментации — 11S.
Помимо аминокислотных остатков, все основные структурные субъединицы IgA включают и углеводы. Секреторный компонент (SC) является гликопротеином. SC ответствен за ряд важнейших иммунологических и биологических свойств секреторного IgA, а именно: торможение роста микробов, агглютинацию частиц, нейтрализацию токсинов и блокирование антигена.
Доказана независимость синтеза SC от продукции полипептид- ных цепей IgA. SC продуцируется серозным типом секреторных эпителиальных клеток и концентрируется в их цитоплазме в области аппарата Гольджи. Особое строение SIgA, сложившееся в процессе эволюции, имеет глубокий биологический смысл. SC блокирует «точки приложения» активных групп ферментов, поэтому SIgA значительно устойчивее к протеолитическим ферментам, чем другие иммуноглобулины. Помимо того имеются данные с вируснейтрализующей и антибактериальной активности секреторных антител класса IgA.
Взаимосвязь синтеза сывороточных и секреторных IgA еще полностью не выяснена. Повреждение слизистых оболочек пищеварительной и дыхательной систем сопровождается повышением SIgA в крови. Объясняют это явление не повреждением слизистых оболочек, а повышением проницаемости клеточных мембран и увеличением местного синтеза SIgA. В норме SIgA и SC содержатся лишь в слизистом секрете, в сыворотке крови отсутствуют. Следовательно, можно предполагать, что в норме SIgA способен ограничивать абсорбцию некоторых веществ, контактирующих со слизистыми оболочками дыхательной и пищеварительной систем. Они указывают на выраженную зависимость между сывороточными и секреторными IgA.
Кроме антител SIgA важную роль в местном иммунитете играют антитела, относящиеся к IgG, М и Е.
IgG содержатся в большом количестве в дистальных участках дыхательной системы. Биологический смысл этого явления можно представить следующим образом. В альвеолах содержатся макрофаги, составляющие основу устойчивости легких к бактериям. Секреторные антитела класса G стимулируют функцию макрофагов; помимо того, комплексы антител этого класса Ig с антигенами, присоединяясь к макрофагам, активизируют лизосомальные ферменты, повреждающие легочную ткань.
IgG биологически активны. Они агглютинируют ядовитые вещества, осуществляют лизис грамотрицательных бактерий, опсонируют бактерии, активируют комплемент. Эти свойства Ig проявляются и в сыворотке, и в бронхиальном содержимом.
IgM в связи с высокой молекулярной массой только в небольшом количестве могут попадать в секреты путем диффузии. IgM является вторым после IgA избирательно секретируемым иммуноглобулином.
У лиц с дефицитом IgA в секретах обнаруживается IgM, связанный с SC. Увеличение IgM в секрете у лиц с частичной недостаточностью IgA может быть компенсаторным. Однако, избирательный транспорт IgA и IgM в секреты определяют не SC, а структурные особенности тяжелых цепей этих иммуноглобулинов.
IgE, содержащийся в отделяемом носа, бронхов и в секретах органов пищеварительной системы, также синтезируется локально. Наличие плазматических клеток, синтезирующих этот класс Ig в ткани слизистых оболочек, свидетельствует о его местном происхождении.
IgE — реагины, как известно, важны в патогенезе аллергических заболеваний дыхательной и пищеварительной систем, так как при контакте аллергена с клетками, адсорбировавшими IgE (в основном это базофильные гранулоциты, тканевые базофилы), освобождается гистамин, вызывающий сокращение гладких мышц.
Местный иммунитет легких
Необходимо отметить, что механизмы местного иммунитета превалируют над общими защитными реакциями, когда инфекция не очень вирулентна, носит более доброкачественный характер и вызываемые ею повреждения тканей менее глубокие.
В основе устойчивости дыхательной системы к чужеродным биологическим агентам лежат ее анатомо-физиологические приспособления, сложившиеся в процессе эволюции: особенности строения верхних дыхательных путей, дренажная функция ресничек эпителия. К факторам местного неспецифического иммунитета относятся поглотительная активность альвеолярных макрофагов, бактерицидная, бактериостатическая и вируснейтрализующая активность различных веществ, присутствующих в секрете. Местный специфический иммунитет обеспечивается В- и Т-системой лимфоцитов.
Под действием факторов разной природы, при всевозможных физических и химических повреждениях дыхательного аппарата, снижается двигательная активность ресничек, что ведет к задержке слизи, созданию условий, благоприятствующих инфекции. При указанных патологических условиях происходит микробная инвазия из нормально заселенной бактериями верхней части дыхательных путей в нижнюю, что при нарушении других факторов местного иммунитета приводит к возникновению нагноительных поражений в легких, часто хронического характера.
Материальную основу неспецифического местного иммунитета легких составляют интерферон, лизоцим, различные ингибиторы и клеточные элементы (эпителий и макрофаги). Фагоцитоз является важнейшим механизмом устойчивости респираторной системы к различным бактериальным инфекциям. Альвеолярные макрофаги важны в выведении частиц из бронхиальных пространств нижних дыхательных путей. Этот эффективный механизм фагоцитоза и поглощения бактерий и других токсических агентов поддерживает чистоту воздушных пространств. Недостаточность фагоцитарной функции этих клеток уменьшает возможность очищения легких, способствует развитию инфекции.
Под влиянием микробных антигенов и иммунных комплексов макрофаги секретируют: кислые гидролазы, нейтральные протеазы (коллагеназы, активатор плазминогена, лизоцим), пироген, простагландины, а также факторы, угнетающие бласттрансформацию Т-лимфоцитов и стимулирующие функцию В-клеток.
Как свидетельствуют многочисленные литературные данные, подавление активности альвеолярных макрофагов — основное звено патогенеза многих инфекционных патологических процессов, развивающихся в дыхательной системе, на фоне которых, как известно, возникают бронхоспастические явления.
Отмечается и нарушение местного синтеза различных химических субстанций, продуцируемых железами бронхов или эпителиальными клетками. Медики наблюдали изменения активности лизоцима секрета бронхов при хронических поражениях бронхов и легких. Эти изменения выражались в угнетении продукции данного фермента в пораженном и здоровом легком, что обусловлено сильным антигенным раздражением.
Основное внимание в работах, посвященных выяснению роли местной невосприимчивости, уделено факторам специфического иммунитета, а именно содержанию различных классов иммуноглобулинов в секретах дыхательного аппарата. Местный клеточный специфический иммунитет изучен недостаточно.
Не совсем однозначны сведения в литературе и о концентрации различных классов иммуноглобулинов в секрете бронхов.
Изучение механизмов местного иммунитета, которые в первую очередь включаются в защиту организма от различных антигенных влияний, позволит не только более полно представить патогенез заболеваний, но и разработать рациональные методы профилактики и терапии.
Статью подготовил и отредактировал: врач-хирург Пигович И.Б.
