Методы изучения антитоксического иммунитета

У большинства россиян представление об иммунитете складывается под влиянием рекламных роликов. Средства для его поддержания и укрепления предлагают в виде йогуртов, творожков, витаминов, употребляя которые можно начисто забыть обо всех болячках. На самом деле, состояние иммунной системы зависит не только от приема кисломолочного продукта или биологической добавки. Более того, при изобилии всех широко рекламируемых средств для укрепления иммунитета, особенно лекарственных, таких как иммуномодуляторы и иммуностимуляторы, к их применению нужно подходить крайне осторожно. Зачастую громкие слова о чудодейственных продуктах — просто ловкий рекламный ход.
Понятие иммунитета
Иммунитет — это механизм действия иммунных клеток, направленный на поддержание постоянства внутренней среды организма, сформированный с целью защиты от инфекций и вирусов и выработки методов противостояния воздействию последних при их проникновении.
Виды иммунитета
Виды иммунитета имеют множество классификаций по различным признакам.
В первую очередь, разделяют врожденный и приобретенный виды иммунитета.
Врожденный тип обусловлен наследственностью, передается через плаценту с кровью матери, при грудном вскармливании с молоком.
Приобретенный иммунитет формируется на протяжении жизни человека. Факторами влияния являются окружающая среда с ее бактериями, перенесенные инфекции. Данный вид предполагает деление на активный иммунитет, который модулируется при помощи запоминания иммунными клетками возбудителя заболевания, и пассивный, когда в организм вводятся уже готовые антитела при помощи вакцин и сывороток.
Локально иммунитет подразделяют на общий и местный. Общая иммунная система охватывает защитой весь организм, местная — определенный орган.
По действию различают гуморальный и клеточный иммунитет.
По направлениям выделяют противоинфекционный, противоопухолевый и трансплантационный иммунитет.
К одному из видов противоинфекционного иммунитета относят иммунитет антитоксический.
Антитоксический тип иммунной реакции
Антитоксический иммунитет направлен на обезвреживание отравляющих веществ, выделяемых возбудителями таких заболеваний как дифтерия, столбняк, газовая гангрена, ботулизм, полиомиелит, дизентерия. Его защитные свойства основаны на действии иммуноглобулина G. Именно он строит защиту от токсического воздействия зловредных микроорганизмов, вырабатывая к каждому свои определенные антитела. Иммуноглобулин G также обладает памятью, и если в организм повторно подвергся интоксикации одним и тем же вирусом, он достаточно быстро удалит его.
Способ воздействия и особенности антитоксинов
Антитоксический иммунитет обусловлен действиями антитоксинов, которые вырабатываются в ответ на отравляющее влияние токсинов, выделяемых микроорганизмами-разносчиками инфекции, подавляя активность их токсических свойств.
Немецкий ученый П. Эрлих разработал схему, которая отображает принцип действия антитоксинов на токсины. Отравляющее действие токсина происходит в том случае, когда он сумел прицепиться к живому веществу в крови. Если такое соединение произошло, живой элемент крови подвергается ядовитому влиянию токсина.

Звенья живого элемента с присоединившимся чуждым токсином действуют в организме далеко не в этом направлении, поэтому соединяющие части, занятые токсинами, иммунная система начинает заменять новыми. Эти новые звенья и есть антитоксины. В спайке с токсином, они подавляют действие последнего на живое вещество.
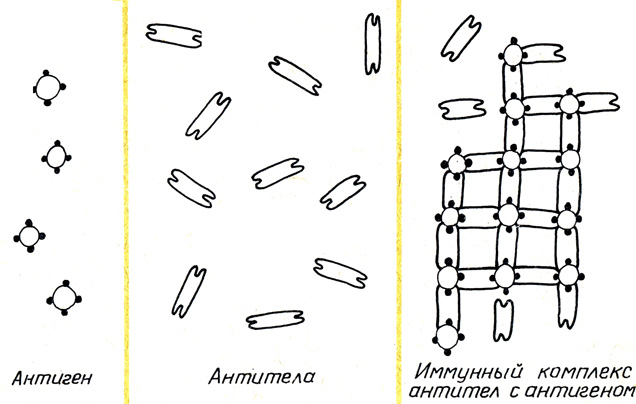
Отсюда была выведена главная особенность антитоксического иммунитета: антитела (антитоксины) не убивают антиген, а нейтрализуют его токсические свойства. Исследования Эрлиха дали новую характеристику видам иммунитета. Он стал разделяться на клеточный (открытый ранее И. Мечниковым) и гуморальный, который образуется в плазме крови.
Использование антитоксинов в медицине
Не всегда вырабатываемых самим организмом антител хватает на подавление токсического воздействия антигенов. Немецким иммунологом-микробиологом А. Берингом и французом Э. Ру на основе исследований Эрлиха была изобретена антитоксическая сыворотка. На ранних стадиях такого заболевания как дифтерия пациенту вводятся антитела к дифтерийному токсину, и при их помощи больной успешно справляется с болезнью.
В общих чертах, антидифтерийная сыворотка представляет собой жидкость, содержащую большое число антитоксинов. Добывается она при участии лошадей, устойчивых к дифтерии. Животному впрыскивается дифтерийный антиген до тех пор, пока животное не начинает вырабатывать огромное количество антител к нему. Такая кровяная сыворотка с высокой концентрацией антител к дифтерии является мощным оружием против этой ядовитой инфекции.

Такой же метод лечения используется и при остальных инфекционных заболеваниях, таких как столбняк, дизентерия и др. Больным вводится сыворотка с высоким содержанием антитоксинов к отравляющим антигенам болезни.
Механизмы выработки антитоксической иммунной реакции
Эта форма иммунной реакции не является наследственной, способной передаваться от матери плоду. Антитоксический иммунитет — приобретенный, вырабатывается при внедрении отравляющих антигенов естественным или искусственным путем. Естественным образом антитоксическая защита приобретается при перенесении высокотоксикогенных инфекционных заболеваний, когда самостоятельная выработка организмом антитоксинов является ответом на ядовитое воздействие возбудителей.
Искусственно антитоксический иммунитет вырабатывается при введении вакцин или анатоксина, а также иммунных сывороток.
Напряженность иммунитета
Риск поражения организма инфекционным заболеванием зависит от количества антител, вырабатываемых в жидкой части крови против этого заболевания. Устойчивость организма к возбудителям называют напряженностью иммунитета.
Уровень устойчивости анализируется отдельно к каждой болезни и определяется количеством производимых антитоксинов. К примеру, если 1/30 в составе 1 мл крови составляет антитоксин против дифтерии, то можно уверенно говорить об отсутствии риска поражения инфекцией.
В заключении надо отметить, что иммунологией антитоксическому иммунитету отводится свое почетное место, поскольку изучение его механизмов действия и выработки дало возможность избавления человечества от таких смертельно опасных заболеваний как дифтерия, столбняк, дизентерия, ботулизм, газовая гангрена и др.
ЗАНЯТИЕ 25
Тема: Микробиологическая диагностика дифтерии.
Цель: На основе знаний биологии коринебактерий дифтерии, особенностей их взаимодействия с макроорганизмом уметь обосновать тактику микробиологической диагностики, профилактику и терапию вызываемого ими заболевания.
Знать:
1. Классификацию и морфобиологические особенности возбудителя дифтерии.
2. Экологию, особенности патогенеза и иммунитета при дифтерии.
3. Материал и методы микробиологической диагностики дифтерии.
4. Методы определения антитоксического иммунитета при дифтерии.
5. Специфическую профилактику и терапию дифтерии.
Уметь:
1. Проводить забор материала из зева, носа и его посев на кровяно-теллуритовый агар с целью выявления бактерионосительства возбудителя дифтерии.
2. Идентифицировать и дифференцировать возбудителя дифтерии от дифтероидов.
3. Окрасить препарат из культуры возбудителя дифтерии по методу Нейссера, промикроскопировать и интерпретировать полученный результат.
4. Учитывать, оценивать результаты РП в геле для определения токсигенности коринебактерий дифтерии.
5. Определять уровень антитоксического иммунитета (РНГА).
Контрольные вопросы:
1. Классификация и морфобиологические особенности возбудителя дифтерии.
2. Фактор патогенности возбудителя дифтерии и механизм его действия.
3. Источники инфекции, пути заражения, особенности патогенеза и иммунитета при дифтерии.
4. Определение антитоксического иммунитета при дифтерии (РНГА).
5. Материал и методы микробиологической диагностики дифтерии.
6. Цель, техника постановки и оценка результатов РП в геле при диагностике дифтерии.
7. Специфическая профилактика и терапия дифтерии.
Задания, выполняемые в ходе занятия (УИРС):
1. Провести бактериологическое исследование на дифтерию у обследуемых с клиническим диагнозом «дифтерия ротоглотки», для чего:
1.1. Изучить посевы отделяемого из зева и носа на кровяно-теллуритовом агаре, отобрать и описать характерные изолированные колонии.
1.2. Изучить характер роста и морфотинкториальные свойства культур (окраска по Граму и Нейссеру), выделенных из характерных колоний на сывороточном агаре от тех же больных.
1.3. Учесть и оценить результаты посева исследуемых культур на «пестрый ряд» (глюкоза, сахароза, крахмал, мочевина, цистин).
1.4. Учесть и оценить РП в геле исследуемых культур с антитоксической противодифтерийной сывороткой.
На основании полученных результатов определить вид выделенной культуры, ее токсигенность; заполнить бланк-направление и бланк-ответ из бак. лаборатории.
2. Продолжить бактериологическое исследование на бактерионосительство коринебактерий дифтерии у студентов, для чего:
2.1. Изучить посевы отделяемого из зева на кровяно-теллуритовом агаре, отобрать и описать характерные изолированные колонии.
2.2. Из отобранных колоний приготовить препараты, окрасит по Граму и Нейссеру, промикроскопировать.
На основании полученных результатов сформулировать вывод.
3. Поставить, учесть и оценить РНГА с сыворотками обследуемых и эритроцитарным дифтерийным антигенным диагностикумом для определения антитоксического иммунитета.
4. Охарактеризовать биопрепараты: АКДС, АДС, АДС-М, антитоксическая противодифтерийная сыворотка.
Методические указания к выполнению исследовательского задания:
I. Проведите бактериологическое исследование по выделению возбудителя дифтерии от больных с клиническим диагнозом «дифтерия ротоглотки»:
1 этап. Успех бактериологического исследования зависит от своевременного и правильного взятия материала. От больных с ангинами и с подозрением на дифтерию забор материала необходимо проводить в течение 3-4 часов с момента обращения в ЛПУ до начала какой-либо терапии.
Материалом служит слизь и пленки с миндалин из зева и носа. Взятие материала должны производить специально обученные медицинские работники.
Материал забирают стерильными ватными сухими тампонами отдельно для зева и носа. Материал из зева забирают натощак или не ранее, чем через 2 часа после еды; при хорошем освещении с использованием шпателя, не касаясь тампоном языка, слизистых щек и зубов. При наличии налетов материал следует брать с границы пораженных и здоровых тканей, слегка нажимая на них тампоном. Для взятия материала из носа используют один тампон, который вводят сначала в один, а потом в другой носовой ход, не касаясь крыльев носа снаружи.
Посев от одного обследуемого производят на одну чашку с кровяно-теллуритовым агаром (КТА), используя при этом одну половину для посева материала из зева, вторую — для посева материала из носа.
При посеве материал втирают в среду со всех сторон тампоном на участке площадью 2х1 см2, а затем этим же тампоном, не меняя положения, производят посев отрывными линиями. Чашки инкубируют при температуре 37°С 24-48 ч.
Посев следует производить на чашки с КТА, согретые при комнатной температуре или в термостате в течение 15-20 мин.
На 2 этапеоцените результаты посева исследуемого материала из зева и носа тех же больных на КТА. Дайте характеристику выросшим колониям, отберите и опишите в протоколе те колонии, характеристика которых совпадает с таковой предполагаемого возбудителя. Сформулируйте ответ.
На КТА C. diphtheriae v. gravis образуют серовато-черные колонии диаметром 2-3 мм, плоские, с радиальной исчерченностью (R-форма); C. diphtheriae v. mitis — черные, матовые, диаметром 1-2 мм, выпуклые, с ровными краями (S-форма). В препаратах коринебактерии дифтерии — это грамположительные полиморфные, прямые и слегка изогнутые палочки, расположенные под углом или в виде растопыренных пальцев, а также образуют скопления, напоминающие войлок. При окраске по Нейссеру выявляются темно-синие зерна волютина, расположенные на концах клеток. Дифтероиды, в основном, располагаются «частоколом» и обычно лишены зерен волютина.
Характерные колонии отсевают на скошенный сывороточный агар, среду Пизу и ставят РП на токсигенность. Посевы помещают в термостат при 37°С на 18-24 часа.
На 3 этапе учтите результаты РП в геле и пробы Пизу. В случае положительной РП и пробы Пизу на цистиназу, выдают ответ лечащему врачу, что выделена токсигенная дифтерийная культура.
Изучите рост культуры, отсеянной из колоний предполагаемого возбудителя, на скошенном сывороточном агаре. Приготовьте фиксированный препарат из исследуемой культуры, окрасьте по Нейссеру (уксусно-кислая синька Нейссера — 60 с, смыть; раствор Люголя – 30 с, слить; хризоидин — 10-15 с, смыть; высушить) и промикроскопируйте. Полученные результаты внесите в протокол.
Выделенную чистую культуру засевают на среды Гисса с глюкозой, сахарозой, крахмалом, цистином (проба Пизу) и мочевиной (проба Закса), а также ставят снова РП.
На 4 этапе учтите и оцените результаты работы на 3 этапе исследования:
— биохимическую активность выделенной культуры на средах Гисса, среде Пизу (цистиназа) и среде Закса (уреаза);
— РП в агаровом геле, обратив внимание на достоверность полученных результатов.
По результатам всех этапов исследования установите вид возбудителя, его биовар; определите его токсигенность и заполните бланк-направление и бланк-ответ из бак. лаборатории.
II. Продолжите бактериологическое исследование на бактерионосительство коринебактерий дифтерии у студентов, для чего:
Изучите посевы отделяемого из зева и носа на кровяно-теллуритовом агаре, отберите и опишите характерные изолированные колонии.
Из отобранных колоний приготовьте препараты, окрасьте по Граму и Нейссеру, промикроскопируйте.
На основании полученных результатов сформулируйте вывод.
III. Поставьте, учтите и оцените РНГА с сыворотками обследуемых и эритроцитарным дифтерийным антигенным диагностикумом для определения антитоксического иммунитета.
Определение уровня антитоксического иммунитета осуществляется для оценки эффективности и качества проведения прививочной работы. С этой целью обследуется индикаторная группа населения, включающая в себя лиц, имеющих документально подтвержденных прививочный анамнез и получивших последнюю прививку за 6-18 мес. до обследования.
Для этой цели ставится РНГА в полистироловых планшетах (см. таблицу №1).
Таблица 1
Схема постановки РНГА для определения антитоксического иммунитета
Экспозиция 30-40 мин при комнатной температуре
В дез. р-р
Планшеты оставляют на ровной поверхности при Т-20°С; их перемещение до учета результатов реакции не допустимо!
Учет результатов РНГА осуществляется визуально в крестах по степени агглютинации эритроцитов (см. занятие №10). В контролях должен отсутствовать феномен гемагглютинации. Титром сыворотки является последнее разведение, дающее реакцию гемагглютинации не менее ++. Для оценки результатов используют защитный титр, равный 1:20.
IV. Ознакомьтесь и опишите в протоколе биопрепараты, указав, что они содержат, для чего и как применяются.
Дата добавления: 2016-12-17; просмотров: 1023 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org — Контакты — Последнее добавление
Беринг еще только готовил свое открытие к научной публикации, а Эрлих — этот «неисчерпаемый творец руководящих идей» (так говорил о нем сам И. И. Мечников) — узрел в новом факте проблему большой биологической значимости. Впрыскивая животным растительные яды — рицин, касторовое масло, абрин, Эрлих убедился, что во всех этих случаях в крови образуются антитоксины.
Итак, из экспериментального наблюдения, сделанного в соседней комнате, Эрлих вывел учение об антитоксическом иммунитете. Он показал, что такой иммунитет может быть наследственным, так как мать передает его потомству через плаценту и с молоком. Развивая далее идею, Эрлих выдвигает объяснение, подсказанное его опытами с красителями тканей. Он утверждает, что процессы питания клеток и реакции иммунитета — эти два основополагающих процесса жизни происходят по единому механизму. Клеточное ядро, по Эрлиху, имеет многочисленные группы атомов, которые могут отщепляться от ядра и присутствовать в протоплазме клетки и даже на ее поверхности. Исследователь дает им название «боковых цепей», «рецепторов» (от recipio — воспринимать). Заметим, что термин «рецептор» является одним из наиболее распространенных в сегодняшней иммунологии. Соединение клетки с питательными веществами зависит от присутствия в ней специальных рецепторов, имеющих сродство с химической структурой питательных веществ. Другие рецепторы воспринимают токсины или иные антигены, и только вступив в прочный химический контакт 45 клеткой, они побуждают ее вырабатывать противоядие — антитоксины.
Антитоксины
Антитоксины — антитела, возникающие в сыворотке крови при попадании в организм токсинов или анатоксинов. Способны взаимодействовать с токсинами , нейтрализуя их активность. Антитоксины могут синтезироваться в результате естественного контакта организма с токсинами, при искусственном введении их в организм животных в сублетальных дозах и при иммунизации анатоксинами человека или животных. Широкое применение в медицине имеют антитоксические сыворотки против токсинов, выделяемых патогенными микроорганизмами (палочками дифтерии, столбняка, газовой гангрены и ботулизма), используемые для профилактики и лечения этих болезней, а также сыворотки против ядов змей, насекомых. Антитоксины, применяемые в медицинской практике в виде антитоксических сывороток, получают путем гипериммунизации лошадей возрастающими дозами токсинов. Антитоксины против ботулизма и газовой гангрены поливалентны, то есть содержат антитела к нескольким токсинам. Сила антитоксинов измеряется количеством антитоксических единиц (АЕ) в 1 мл, способ определения которых зависит от вида антитоксина. Сыворотки, содержащие антитоксины, высушивают в вакууме и сохраняют при низкой температуре.Антитоксины (от греч. anti — против + токсины) — антитела, которые образуются в организме животных и человека в ответ на появление токсинов микробного, растительного или животного происхождения, специфически обезвреживают соответствующие токсины и являются мощным фактором антитоксического иммунитета . Наибольшее значение имеют антитоксины, которые вырабатываются против экзотоксинов или растворимых токсинов микробов — возбудителей высокотоксигенных инфекций: дифтерии, столбняка, газовой гангрены, ботулизма, а также дизентерийных бактерий Григорьева—Шига, скарлатинозного стрептококка, стафилококка. Антитоксический иммунитет может быть воспроизведен искусственно активной иммунизацией анатоксинами или пассивной иммунизацией антитоксическими сыворотками.
Содержание антитоксинов в антитоксических сыворотках выражается в антитоксических единицах (АЕ). О напряженности антитоксического иммунитета можно судить по содержанию антитоксинов в сыворотке крови. Наличия в 1 мл крови 1/30 АЕ дифтерийного антитоксина достаточно, чтобы обеспечить невосприимчивость ребенка к дифтерии; при этом реакция Шика у него будет отрицательной. Защита от столбняка, по данным Регамея (R. Н. Regamey, 1965), обеспечивается присутствием в 1 мл крови 0,005 АЕ противостолбнячного антитоксина.
Антитоксины применяются в медицинской практике в виде антитоксических сывороток (противодифтерийная, противостолбнячная, противодизентерийная Григорьева—Шига, противогангренозные, противоботулинические, противоскарлатинозная, противостафилококковая), которые готовят путем гипериммунизации лошадей возрастающими дозами соответствующих токсинов или анатоксинов. В жидких сыворотках антитоксины довольно лабильны: они разрушаются при t° 100° и ослабляются при 60—70°; инактивируются под влиянием прямого действия солнечных лучей. После лиофильного высушивания под вакуумом при низких температурах А. становятся более стабильными и хорошо сохраняются в течение многих лет.
За 1 АЕ дифтерийного А., по предложению Эрлиха (P. Ehrlich), принимается такое количество противодифтерийной сыворотки, которое в смеси с Lt (Limes tod) дифтерийного токсина вызывает смерть морской свинки весом 250 г в течение 96 час.
Lt дифтерийного токсина устанавливается в опытах на морских свинках при помощи стандартной противодифтерийной антитоксической сыворотки. Интернациональные антитоксические единицы (АЕ) содержатся в определенных количествах (мг) эталонных сывороток, выпускаемых международной лабораторией биологических стандартов Института сывороток в Копенгагене. Производственные институты СССР снабжаются стандартными антитоксическими сыворотками из Института контроля медико-биологических препаратов им. Л. А. Тарасевича.
Реакция флоккуляции нашла применение лишь для определения титра противодифтерийной сыворотки (по последним данным, образование флоккулята при взаимодействии антитоксической сыворотки с токсином следует отнести за счет присутствия в сыворотке побочных антител, поэтому результаты реакции флоккуляции могут не всегда совпадать с результатами определения титра A. in vivo).
Антитоксины обычно связаны с ү- и β2-глобулинами противодифтерийной сыворотки. Нортроп (L. Н. Northrop, 1941) изолировал дифтерийный антитоксин в виде кристаллического глобулина с мол. весом (мол. массой) 90 500, однако химическая структура А. до сих пор остается неустановленной. При переваривании пепсином молекула иммунного глобулина расщепляется на две половины, из которых одна — пассивный белок — лишена антитоксических свойств и легко коагулируется теплом, а другая — носитель антитоксина — гораздо более резистентна к пепсину и прогреванию. На этом принципе основан метод очистки антитоксинов «диаферм» (А. В.. Бейлинсон), в результате которой их анафидактогенные свойства (см. Анафилаксия) ослабляются. При применении очищенных антитоксинов симптомы сывороточной болезни (см.) реже наблюдаются и она легче протекает.
В соответствии с теорией Борде (J. Вогdet), которая нашла подтверждение в опытах с чистыми токсинами и А., реакция токсин — антитоксин протекает по законам адсорбции. В организме больного А. нейтрализуют лишь свободный токсин, который еще не связан с чувствительными тканями. Поэтому эффективность серотерапии зависит от срока применения антитоксической сыворотки. При подозрении на заболевание дифтерией, столбняком, ботулизмом и другими токсигенными инфекциями антитоксическую сыворотку следует вводить возможно скорее, чтобы антитоксин нейтрализовал свободный токсин до фиксации его восприимчивыми тканями. Отсюда понятно, почему серопрофилактика столбняка, ботулизма и других токсигенных инфекций оказывается эффективнее серотерапии. Выраженными антитоксическими свойствами обладают иммунные сыворотки против змеиных ядов.
А. сохраняют значение и в эпоху антибиотиков, так как последние, оказывая бактериостатическое действие на микробы, не обезвреживают их токсины. Поэтому при таких заболеваниях, как дифтерия, столбняк, ботулизм, при которых имеет место токсемия и патологический процесс почти всецело обусловлен повреждающим действием токсина на чувствительные ткани, серотерапия специфическими А. безусловно показана наряду с антибиотикотерапией и другими способами лечения.
