Молекулярные механизмы клеточного иммунитета

Клеточный иммунитет: активация Т-лимфоцитов и элиминация внутриклеточных микробов. Наивные Т-лимфоциты активируются антигеном и костимуляторами в периферических лимфоидных органах, пролиферируют и дифференцируются в эффекторные клетки, которые мигрируют в любой участок организма, где присутствует антиген.
Одной из наиболее ранних реакций хелперных Т-клеток CD4+ является секреция цитокина IL-2 и экспрессия его высокоаффинных рецепторов. IL-2 представляет собой фактор роста, который действует на эти Т-лимфоциты и стимулирует их пролиферацию, приводя к повышению числа антиген-специфических лимфоцитов.
Функции хелперных Т-клеток опосредованы комбинированным действием лиганда CD40 (CD40L) и цитокинов. После распознавания антигенов, презентированных макрофагами или В-лимфоцитами, хелперные Т-клетки CD4+ экспрессируют CD40L, взаимодействующий с CD40 на макрофагах или В-клетках и активирующий их.
Некоторые из потомков размножившихся Т-клеток дифференцируются в эффекторные клетки, секретирующие различные наборы цитокинов и тем самым выполняющие различные функции. Лучше всего исследованы субпопуляции Тh1-клеток и Тh2-клеток — дифференцированных хелперных Т-клеток CD4+. Тh1 -клетки секретируют цитокин IFN-y, сильный активатор макрофагов.
Сочетание процессов активации, опосредованных CD40 и IFN-y, приводит к индукции микробицидных веществ в макрофагах, разрушающих поглощенные ими микробы. Тh2-клетки образуют IL-4, который стимулирует дифференцировку В-клеток в секретирующие IgE плазматические клетки, и IL-5, активирующий эозинофилы.
Эозинофилы и тучные клетки связываются с покрытыми IgE патогенами (например, с паразитическими гельминтами) и элиминируют паразитов. Третья субпопуляция Т-клеток CD4+, открытая недавно, получила название «субпопуляция Тh17-клеток», поскольку эти клетки продуцируют цитокин IL-17. Эти клетки характеризуются выраженной способностью мобилизовать нейтрофилы и моноциты и тем самым играют главную роль в некоторых воспалительных заболеваниях.
Также клетки осуществляют защиту от некоторых инфекций, вызываемых бактериями и грибами, при которых существенное значение имеет нейтрофильное воспаление. Образование и функции этих субпопуляций Т-клеток подробнее будут рассмотрены при обсуждении реакции гиперчувствительности.
Активированные лимфоциты CD8+ дифференцируются в цитотоксические Т-лимфоциты, которые уничтожают клетки, содержащие микробы. Разрушая инфицированные клетки, цитотоксические Т-лимфоциты устраняют резервуар инфекции.
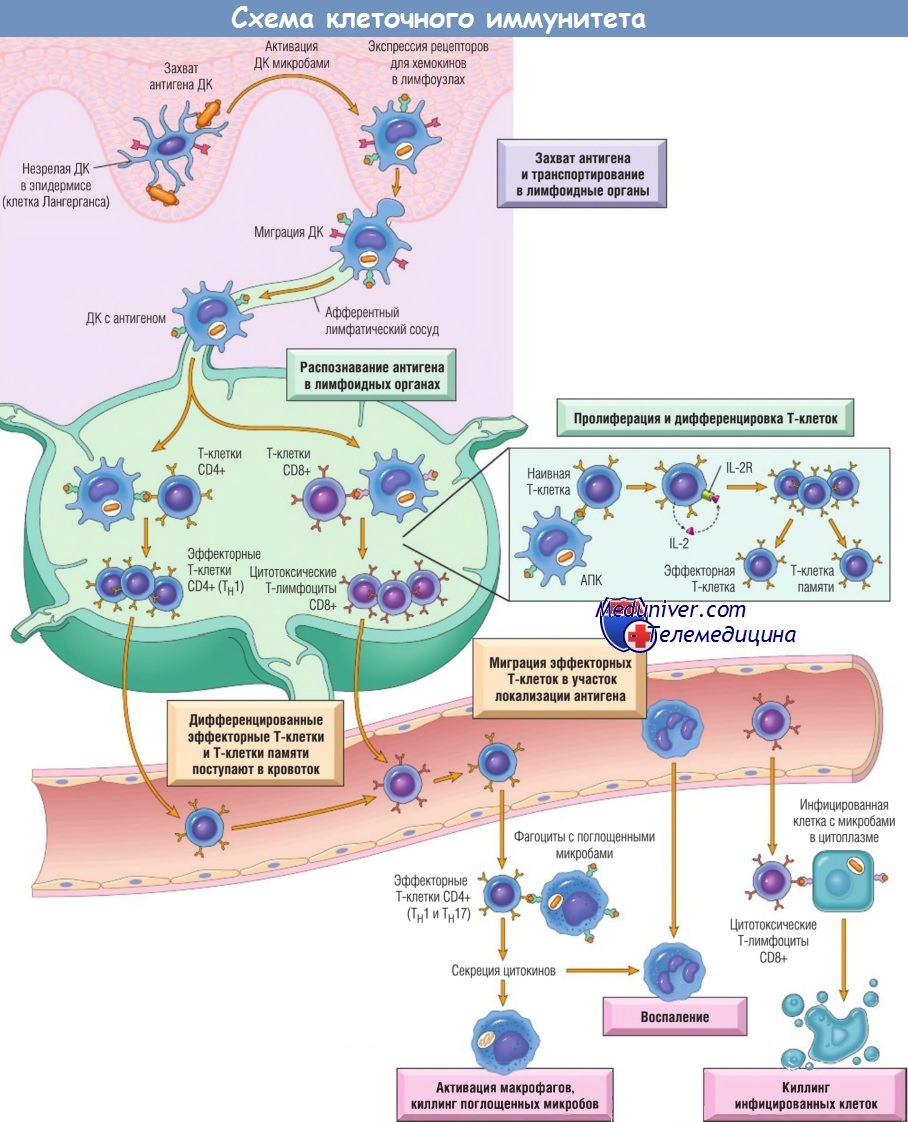
Клеточно-опосредованный иммунитет.
Дендритные клетки (ДК) захватывают микробные антигены в эпителии и тканях и транспортируют их в лимфоузлы.
В течение этого процесса ДК созревают и экспрессируют на высоком уровне молекулы МНС и костимуляторы.
Наивные Т-клетки распознают ассоциированные с МНС пептидные антигены, презентированные ДК.
Т-клетки активируются, пролиферируют и дифференцируются в эффекторные Т-клетки и Т-клетки памяти, мигрирующие в очаг инфекции и выполняющие разнообразные функции.
Эффекторные Т-клетки CD4+ субпопуляции ТН1 распознают антигены микробов, поглощенных фагоцитами, активируют их и индуцируют воспаление.
Цитотоксические Т-лимфоциты CD8+ убивают инфицированные клетки, содержащие микробы в цитоплазме.
На рисунке не показаны Тh2-клетки, имеющие особое значение в защите от гельминтов. Некоторые активированные Т-клетки дифференцируются в долгоживущие Т-клетки памяти.
Тh — хелперные Т-клетки; АПК — антиген-презентирующая клетка.
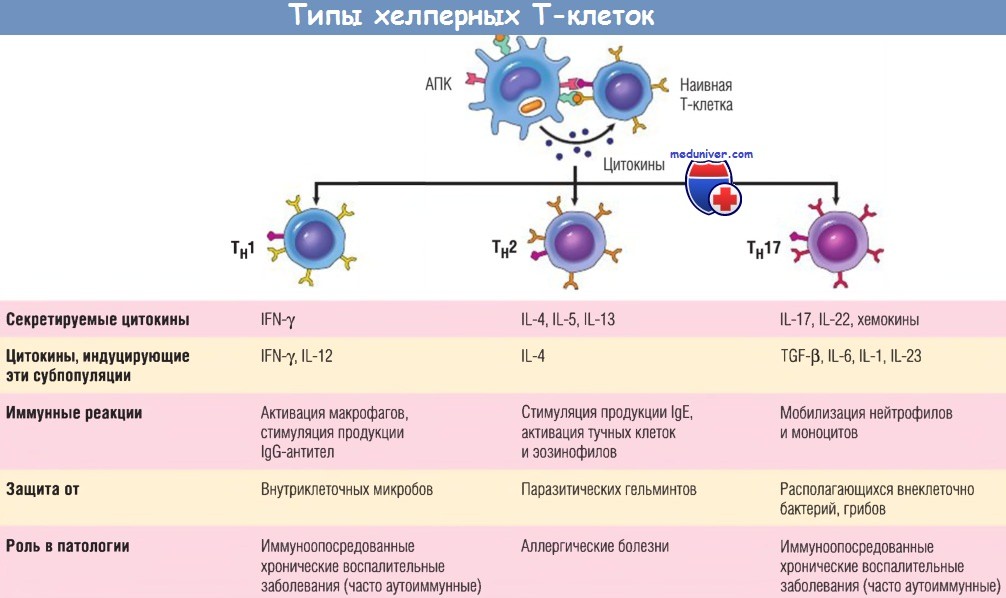
Субпопуляции хелперных Т-клеток (Тн).
В ответ на стимуляцию (осуществляемую главным образом цитокинами) во время распознавания антигена наивные Т-клетки CD4+ могут дифференцироваться в популяции эффекторных клеток, продуцирующих различные наборы цитокинов и выполняющих разные функции.
На рисунке в суммарном виде представлены основные иммунные реакции, вызываемые каждой субпопуляцией, и их роль в защите организма и при иммунологических заболеваниях.
IFN — интерферон; Ig — иммуноглобулин; IL — интерлейкин; TGF — трансформирующий фактор роста; АПК — антигенпрезентирующая клетка.
— Рекомендуем ознакомиться со следующей статьей «Механизмы гуморального иммунитета»
Оглавление темы «Реакции иммунного ответа»:
- Цитокины иммунной системы
- Механизм презентации и распознавания антигенов лимфоцитами
- Механизмы клеточного иммунитета
- Механизмы гуморального иммунитета
- Механизмы затухания иммунного ответа и иммунологической памяти
- Механизмы и типы реакций гиперчувствительности
- Механизмы гиперчувствительности немедленного типа (I типа)
- Примеры гиперчувствительности I типа (немедленного)
- Механизмы гиперчувствительности опосредованной антителами (II типа)
- Механизмы гиперчувствительности опосредованной иммунными комплексами (III типа)
Иммунитет — (лат. immunitas — освобождение) — защита организма от генетически чужеродных организмов и веществ, к которым относятся микроорганизмы, вирусы, черви, различные белки, клетки, в том числе и собственные изменённые клетки организма.
Иммунология — наука, изучающая иммунитет.
Иммунный ответ — это реакция организма на внедрение чужеродных агентов.
Антиген — любое чужеродное вещество или организм.
Антитело — вещество организма, распознающее антигены.
Антитела (иммуноглобулины) — особый класс гликопротеинов, присутствующих на поверхности B-лимфоцитов в виде рецепторов (рис. 1). Реагируя на присутствие антигена, они отделяются от мембраны В-лимфоцита и присутствуют в сыворотке крови и тканевой жидкости в виде растворимых молекул (антител). Антитела способны избирательно связываться с конкретными видами чужеродных молекул, которые в связи с этим называют антигенами.

Рис. 1. В-лимфоцит с мембрансвязанными рецепторами
Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов.
Антигены, как правило, являются белками или полисахаридами и представляют собой части бактериальных клеток, вирусов и других микроорганизмов.
К антигенам немикробного происхождения относятся белки пыльцы растений, яичный белок и белки трансплантатов тканей и органов, а также поверхностные белки клеток крови при переливании крови.
Аллергены — это антигены, вызывающие аллергические реакции.
История изучения иммунитета
Фундамент иммунологии был заложен изобретением микроскопа, благодаря чему удалось обнаружить первую группу микроорганизмов — болезнетворные бактерии.
В конце XVIII в. английский сельский врач Эдвард Дженнер сообщил о первой удачной попытке предотвратить заболевание посредством иммунизации. Его подход вырос из наблюдений за одним интересным явлением: доярки часто заражались коровьей оспой и впоследствии не болели натуральной оспой. Дженнер ввёл маленькому мальчику гной, взятый из пустулы (нарыва) коровьей оспы, и убедился в том, что мальчик оказался иммунным к натуральной оспе.
Работа Дженнера дала начало изучению теории микробного происхождения заболеваний в XIX в. Пастером во Франции и Кохом в Германии. Они отыскали антибактериальные факторы в крови животных, иммунизированных микробными клетками.
Луи Пастер успешно выращивал различные микробы в лабораторных условиях. Как часто бывает в науке, открытие было сделано случайно при культивировании возбудителей холеры кур. Во время работы одна из чашек с микробами была забыта на лабораторном столе. Было лето. Микробы в чашке несколько раз нагревались под солнечными лучами, высохли и потеряли способность вызывать заболевание. Однако куры, получившие эти неполноценные клетки, оказались защищёнными против свежей культуры холерных бактерий. Ослабленные бактерии не только не вызывали заболевание, а, напротив, давали иммунитет.
В 1881 г. Луи Пастер разработал принципы создания вакцин из ослабленных микроорганизмов с целью предупреждения развития инфекционных заболеваний.
В 1908 г. Илья Ильич Мечников и Пауль Эрлих были удостоены Нобелевской премии за работы по теории иммунитета.
И. И. Мечников создал клеточную (фагоцитарную) теорию иммунитета, согласно которой решающая роль в антибактериальном иммунитете принадлежит фагоцитозу.
Сначала И. И. Мечников как зоолог экспериментально изучал морских беспозвоночных фауны Чёрного моря в Одессе и обратил внимание на то, что определённые клетки (целомоциты) этих животных поглощают все инородные частицы (в т. ч. бактерии), проникающие во внутреннюю среду. Затем он увидел аналогию между этим явлением и поглощением белыми клетками крови позвоночных животных микробных телец. И. И. Мечников осознал, что это явление не питание данной единичной клетки, а защитный процесс в интересах целого организма. Учёный назвал действующие таким образом защитные клетки фагоцитами — «пожирающими клетками». И. И. Мечников первым рассматривал воспаление как защитное, а не разрушительное явление.
Против теории И. И. Мечникова в начале XX в. выступали большинство патологов, так как они считали лейкоциты (гной) болезнетворными клетками, а фагоциты — разносчиками инфекции по организму. Однако работы И. И. Мечникова поддержал Луи Пастер. Он пригласил И. И. Мечникова работать в свой институт в Париже.
Пауль Эрлих открыл антитела и создал гуморальную теорию иммунитета, установив, что антитела передаются ребёнку с грудным молоком, создавая пассивный иммунитет. Эрлих разработал метод изготовления дифтерийного антитоксина, благодаря чему были спасены миллионы детских жизней.
Теория иммунитета Эрлиха говорит о том, что на поверхности клеток есть специальные рецепторы, распознающие чужеродные вещества (антигенспецифические рецепторы). Сталкиваясь с чужеродными частицами (антигенами), эти рецепторы отсоединяются от клеток и в качестве свободных молекул выходят в кровь. В своей статье П. Эрлих назвал противомикробные вещества крови термином «антитело», так как бактерий в то время называли «микроскопические тельца».
П. Эрлих предполагал, что ещё до контакта с конкретным микробом в организме уже есть антитела в виде, который он назвал «боковыми цепями». Теперь известно, что он имел в виду рецепторы лимфоцитов для антигенов.
В 1908 г. Паулю Эрлиху вручили Нобелевскую премию за гуморальную теорию иммунитета.
Чуть раньше Карл Ландштейнер впервые доказал наличие иммунологических различий индивидуумов в пределах одного вида.
Питер Медавар доказал удивительную точность распознавания иммунными клетками чужеродных белков: они способны отличить чужеродную клетку всего по одному изменённому нуклеотиду.
Френк Бёрнет постулировал положение (аксиома Бёрнета), что центральным биологическим механизмом иммунитета является распознавание своего и чужого.
В 1960 г. Нобелевскую премию по физиологии и медицине получили Питер Медавар и Френк Бёрнет за открытие иммунологической толерантности (лат. tolerantia — терпение) — это распознавание и специфическая терпимость к некоторым антигенам.
Уничтожение генетически изменённых клеток
Одна из функций иммунной системы — это уничтожение генетически изменённых (мутантных) клеток организма. В процессе клеточного деления постоянно происходят ошибки, и одна из миллиона образовавшихся клеток становится мутантной, т. е. генетически чужеродной. В организме человека благодаря мутациям в каждый конкретный момент должно быть более 10 миллионов мутантных клеток. Мутации приводят к изменению функций клетки. Большинство мутантных клеток не способны выполнять свои функции, а многие выходят из-под контроля организма (например, при нарушении апоптоза) и становятся раковыми клетками. Появление таких клеток может привести к возникновению серьёзных заболеваний и гибели организма.
Один из механизмов иммунитета, осуществляемый лимфоцитами (НК-лимфоцитами), направлен на уничтожение именно раковых клеток.
Виды иммунитета
Иммунитет можно разделить на клеточный и гуморальный (рис. 2)
Рис. 2. Клеточный и гуморальный иммунитет
Все разнообразные формы иммунного ответа можно разделить на два типа: врождённый иммунитет и приобретённый иммунитет (рис. 3).
Рис. 3. Классификация иммунитета
Приобретённый иммунитет — это специфический индивидуальный иммунитет, т. е. это иммунитет, который имеется конкретно у определённых индивидуумов и к определённым возбудителям или агентам.
Главными характеристиками приобретённого иммунитета являются специфичность и иммунологическая память. Чем чаще организм встречается с патогеном, тем быстрее и активнее вырабатываются антитела, следовательно — сильнее защита.
Врождённый иммунитет с самого рождения (ещё до первой встречи с антигеном) защищает организм против всего чужеродного, т. е. он не специфичен.
Таким образом, повторная встреча с тем или иным патогенным микроорганизмом не приводит к изменениям врождённого иммунитета, но повышает уровень приобретённого.
Врождённый иммунитет активируется при первом появлении патогена быстрее, но распознаёт патоген с меньшей точностью. Он реагирует не на конкретные специфические антигены, а на определённые классы антигенов, характерные для патогенных организмов (белки вирусного капсида, продукты метаболизма глистов и т. п.).
Врождённый иммунитет может быть наследственным (видовым) и индивидуальным.
Наследственный (видовой) иммунитет — это невосприимчивость всех представителей данного вида к определённому антигену, приобретённая в процессе эволюции:
болезни, которыми болеет человек, но не болеют животные и птицы (корь, натуральная оспа, проказа, вирусный гепатит, холера, гонорея, дизентерия, брюшной тиф и др.);
болезни, которыми болеют животные, но не болеет человек (чума крупного рогатого скота, пироплазмоз собак);
болезни, которыми болеют птицы, но не болеет человек (куриная холера);
болезни, которыми болеют животные и человек, но не болеют птицы (сибирская язва, бешенство и др.).
Индивидуальный врождённый иммунитет определяется теми особенностями, которые передаются организму с родительскими генами и в процессе эмбрионального развития.
В процессе эмбрионального развития через плаценту плоду передаются антитела матери, которые противостоят инфекциям. Передача антител от мамы к ребёнку происходит в основном в последнем триместре беременности.
Иммунитет подразделяется на естественный и искусственный.
Естественный иммунитет возникает самостоятельно в процессе жизни организма.
Естественный иммунитет делится на активный (после перенесённых заболеваний) и пассивный (например, с молоком матери).
До 6 месяцев малыша защищают антитела, передающиеся от матери с грудным молоком. Поэтому важным является исключительно грудное вскармливание. Иммунитет матери защищает ребёнка. Дети, которые находятся на искусственном вскармливании, слабо защищены, т. к. собственных антител у них мало. Только к 6 месяцам организм самостоятельно начинает вырабатывать антитела. Собственный иммунитет ребёнка формируется только к концу первого года жизни.
Искусственный иммунитет организм приобретает в результате применения медицинских препаратов (вакцин и сывороток).
Вакцина — медицинский препарат, содержащий ослабленные или убитые микроорганизмы.
Вакцина вводится абсолютно (!) здоровому человеку для предотвращения заболевания в будущем.
Сыворотка — медицинский препарат плазмы крови без фибриногена, содержащий готовые антитела к определённому патогену (заражающему микроорганизму). Сыворотку получают из крови заражённого данным заболеванием животного (коровы, лошади и т. п.).
Сыворотка с чужими антителами вводится заболевшему человеку в случае, когда организм не способен произвести достаточное количество антител.
МЕДИАТОРЫ КЛЕТОЧНОГО ИММУНИТЕТА (лат. mediator посредник; син. лимфокины) — группа макромолекулярных веществ полипептидной, белковой или гликопротеидной природы, с помощью которых Т-лимфоциты осуществляют свою эффекторную функцию.
В развитии реакции клеточного иммунитета (см.) участвуют сенсибилизированные лимфоциты, относящиеся в основном к популяции Т-лимфоцитов (см. Иммунокомпетентные клетки). Их взаимодействие со специфическим антигеном приводит к активации лимфоцитов, в результате чего образуются и выделяются лимфокины, которые оказывают стимулирующее пли угнетающее влияние на функцию других клеток (макрофагов, нейтрофильных гранулоцитов, несенсибилизированных лимфоцитов и др.), на состояние капилляров и др. При этом происходит нейтрализация и элиминация чужеродного антигена. В этом заключается защитная роль клеточного механизма иммунитета. Такой же клеточный механизм включается и при аллергических реакциях замедленного типа (см. Аллергия) или китергических реакциях по А. Д .Адо с участием сенсибилизированных Т-лимфоцитов и выделением лимфо-кинов. Однако при аллергических реакциях замедленного типа, очевидно, в связи с измененным количеством и соотношением различных М. к. и. выявляется не только защитная роль, но и повреждающее действие на ткани. В этом, очевидно, и заключается основное отличие аллергической реакции замедленного типа от реакций клеточного иммунитета.
Включение клеточного механизма иммунитета генетически детерминировано. Напр., у мышей гены, кодирующие развитие этого типа реакций, сцеплены с H—2 комплексом главной системы гистосовместимости и картированы преимущественно в H—2К + 1 областях. Генетический контроль реализуется путем детерминирования активности различных звеньев клеточного механизма иммунитета, в т. ч., очевидно, и через детерминирование образования лимфокинов.
Лимфокины были обнаружены впервые в опытах in vitro. Для их выявления культивируют исследуемые клетки в присутствии специфических антигенов или неспецифических митогенов фитогемагглютинина (ФГА), экстракта корня локаноса и других, после чего клетки осаждают и исследуют активность надосадочной жидкости. Выделение М. к. и. зависит от генотипа лимфоцитов, вида и концентрации антигена и других условий. Тестирование надосадочной жидкости проводят на клетках-мишенях. Установлено существование более 20 различных лимфокинов. Не исключена возможность, что различные проявления клеточного механизма иммунитета вызываются не соответствующими лимфокинами, а одним и тем же или комбинацией нескольких М. к. и. Остается неясным: вырабатывает ли лимфоцит один какой-либо фактор или все. Классификация и некоторые свойства М. к. и. приведены в таблице. Медиаторы считаются термолабильными, если теряют свою активность после нагревания при t° 56° в течение 30 мин., и термостабильными, если сохраняют ее при t° более 80°.
Выделение некоторых М. к. и. соответствует степени выраженности аллергической реакции замедленного типа. Поэтому для оценки состояния специфической сенсибилизации, протекающей по замедленному типу, определяют эти медиаторы. М. к. и. классифицируют по условиям, в которых выявлено их действие (in vitro или in vivo), и по действию на клетки мишени. Установлена возможность регуляции образования лимфокинов. Так, цитолитическая активность лимфоцитов (см.) может угнетаться веществами, стимулирующими p-адренергические рецепторы.
Холинергические вещества и инсулин усиливают эту активность у крысиных лимфоцитов. Глюкокортикоиды, очевидно, угнетают больше действие лимфокинов, чем их образование. Простагландины группы E изменяют активацию лимфоцитов, снижая образование митогенного и угнетающего миграцию макрофагов факторов. Возможна нейтрализация лимфокинов антисыворотками.
Наиболее изученными М. к. и. являются следующие.
Фактор, угнетающий миграцию макрофагов (МИФ или MIF — migration inhibitory factor), способствует накоплению макрофагов (см.) в области аллергической альтерации и, возможно, усиливает их активность и фагоцитоз; участвует также в образовании гранулем при инфекционноаллергических заболеваниях (см. Инфекционная аллергия) и усиливает способность макрофагов разрушать определенные виды бактерий. МИФ выделяется сенсибилизированными Т- или B-лимфоцитами под влиянием специфического антигена и несенсибилизированными лимфоцитами при действии неспецифических митогенов (конканавалина А и др.). Действие этого фактора относительно видонеспецифично, напр. МИФ из лимфоцитов морской свинки не угнетает миграции человеческих, мышиных или кроличьих макрофагов, а МИФ из лимфоцитов человека угнетает миграцию макрофагов из перитонеального экссудата морских свинок. Это свойство используется для диагностики специфической сенсибилизации замедленного типа у человека к бактериальным, вирусным, грибковым, синтетическим антигенам и аллергенам (см. Торможение миграции макрофагов).
Фактор, агрегирующий макрофаги (МАФ), выделяется одновременно с фактором, угнетающим миграцию макрофагов, и по своим свойствам похож на него. Он вызывает агрегацию макрофагов. Не исключено, что это одно из проявлений активности фактора, угнетающего миграцию макрофагов.
Фактор, индуцирующий специфическую цитотоксичность макрофагов, секретируется сенсибилизированными Т-лимфоцитами мышей. Связывается изо- и аллогенными макрофагами, индуцируя у них специфическую цитотоксичность к аллогенным клеткам-мишеням.
Фактор, стимулирующий образование эндогенных пирогенов, секретируется сенсибилизированными лимфоцитами из лимф, узлов кроликов под влиянием специфического антигена. Стимулирует образование макрофагами крови и звездчатыми ретикулоэндотелиоцитами (купферовскими клетками) кроликов эндогенных пирогенов.
Бластогенные (митогенные) факторы, образующиеся под влиянием специфического антигена, вызывают бластотрансформацию лимфоцитов (см.). Получены из лимфоцитов, лимф, узлов морских свинок, пульпы селезенки мышеи, крови человека и в смешанных культурах лимфоцитов человека.
Фактор, угнетающий синтез ДHК, выделяется лимфоцитами под влиянием специфического антигена, аллогенных клеток и ФГА. Угнетает включение меченого тимидина в ДНК лимфоцитов, не разрушая их.
Хемотакс и ческие факторы образуются лимфоцитами под влиянием специфического антигена и неспецифических митогенов. Один фактор вызывает хемотаксис макрофагов, другой — нейтрофильных и третий — эозинофильных гранулоцитов. Есть данные, что моноцитарный хемотаксический фактор у морских свинок может продуцироваться B-к летками лимф, узлов.
Фактор, угнетающий миграцию полиморфно-ядерных лейкоцитов, получен в культуре лимфоцитов крови человека под влиянием ФГА или специфического антигена.
Лимфотоксин выделяется сенсибилизированными лимфоцитами под влиянием специфического антигена через 6—8 час., а также при действии на лимфоциты неспецифических митогенов (ФГА, конканавалин-А, стафилококковый фильтрат) и в смешанных культурах лимфоцитов мышей. Вызывает повреждение или разрушение различных клеток-мишеней (мышиные L-клетки, HeLa-клетки, печеночные клетки, фибробласты, куриные эритроциты и др.). Активность различных видов лимфотоксина варьирует в зависимости от клеток-мишеней. Лимфотоксин лимфоцитов человека в высоких концентрациях неспецифичен, а в малых концентрациях его активность зависит от клеток-мишеней. Повреждающее действие лимфотоксина оценивают по его способности блокировать включение меченых аминокислот в клетки-мишени или по освобождению 51Cr или 3H-тимидина из предварительно меченых клеток.
Интерферон выделяется лимфоцитами под влиянием специфического аллергена (так наз. иммунный интерферон) и неспецифических митогенов (ФГА). Кинетика выделения иммунного интерферона отличается от таковой у интерферона, образованного под влиянием ФГА, и от интерферонов, образуемых другими клетками при действии различных интерфероногенов (см. Интерферон). Обладает видоспецифичностью. Так, лимфоцитарный интерферон человека не предупреждает инфицирования вирусами фибробластов куриных эмбрионов, мышиных L-к леток, первичных клеточных культур кроличьих почек. Действует на неинфицированные вирусами клетки и делает их устойчивыми к заражению вирусами путем стимулирования в них образования белка, блокирующего размножение вируса.
Фактор, угнетающий рост колоний, образуется лимфоцитами туберкулинчувствительных людей под влиянием специфич. антигена. Угнетает способность HeLa-к леток образовывать колонии.
Фактор, угнетающий клеточную пролиферацию, выделяется лимфоцитами крови человека иод влиянием ФГА. Угнетает включение 3H-тимидина в ДНК клеток HeLa.
Фактор, замедляющий электрофоретическую подвижность тромбоцитов. Выделен из лимфоцитов крови человека при действии ФГА.
Кожно-pеактивный фактор выделяется лимфоцитами через 6—8 час. после их контакта со специфическим антигеном пли неспецифическими митогенами. Его образование тормозится актиномицином Д и пуромицином, что свидетельствует об активном характере процесса образования фактора. Обладает антигенными свойствами. После внутрикожного введения животному через 4—6 час. развивается воспалительная реакция, к-рая достигает максимума через 16—24 часа. Гистологически в месте воспаления определяется инфильтрация незернистыми клетками с примесью значительного количества зернистых лейкоцитов. Выраженность воспалительной реакции зависит от источника кожно-реактивного фактора. Фактор видонеспецифичен. Снижение выделения кожно-реактивного фактора лимфоцитами крови больного человека свидетельствует об угнетении клеточного иммунитета.
Фактор увеличения сосудистой проницаемости обнаружен в экстракте из клеток лимф, узлов морских свинок, крыс, мышей, интактных и сенсибилизированных к туберкулину. При введении в кожу вызывает острое монофазное повышение сосудистой проницаемости, не снимаемое мепирамином.
Фактор переноса выделен впервые Лоренсом (H. S. Lawrence, 1948) из диализата лимфоцитов сенсибилизированных морских свинок и человека. При введении интактным свинкам или человеку передает «иммунологическую намять» о сенсибилизирующем антигене и сенсибилизирует организм к данному антигену. Фактор выделяется также in vitro из лимфоцитов под влиянием специфического антигена в течение первых 30 мин. Не обладает антигенными свойствами, по хим. природе, по-видимому, представляет собой молекулу двуспиральной РНК. Фактор не выделен в очищенном виде.
См. также Иммунитет, Иммунитет трансплантационный.
Таблица. Классификация и некоторые свойства медиаторов (факторов) клеточного иммунитета
Наименование фактора | Источник фактора | Молекулярный вес (в дальтонах) | Физические свойства | Действие медиаторов |
Факторы, действие которых выявлено in vitro | ||||
На макрофаги | ||||
Фактор, угнетающий миграцию макрофагов (МИФ) | Лимфоциты крови человека, лимфоциты морской свинки, мыши, | 25000—55000 | Термостабилен | Способствует накоплению макрофагов |
Фактор, вызывающий хемотаксис макрофагов | Лимфоциты морской свинки, человека, кролика | 40 000—6000 0 | Термостабилен | Усиливает движение макрофагов к меету*образования фактора |
Фактор, агрегирующий макрофаги | Лимфоциты морской свинки | 10000 | Термостабилен | Вызывает скопление макрофагов |
Фактор, индуцирующий специфическую цитотоксичность | Лимфоциты мыши | Нет данных | Термостабилен | Стимулирует у макрофагов специфическое цитотоксическое |
На лимфоцит ы | ||||
Бластогенные (митогенные) факторы | Лимфоциты морской свинки, мыши, человека | 25000 | Не диализируются | Вызывает бластную трансформацию и пролиферацию лимфоцитов |
Фактор, угнетающий синтез ДНК | Лимфоциты мыши, крови человека | Более 10000 | Термолабилен. Диализируется | Угнетает включение тимидина в различные пролиферирующие |
На полиморфно-ядерные клетки | ||||
Фактор, вызывающий хемотаксис нейтрофильных гранулоцитов | Лимфоциты морской свинки, человека | 40000—60000 | Нет данных | Вызывает движение нейтрофилов к месту образования фактора |
Фактор, вызывающий хемотаксис эозинофильных гранулоцитов | Лимфоциты мыши | 24000—56000 | Относительно термолабилен | Вызывает движение эозинофилов к месту образования фактора |
Фактор, угнетающий миграцию полиморфно-ядерных лейкоцитов | Лимфоциты крови человека | 50000 — 75000 | Термолабилен | Способствует накоплению полиморфно-ядерных лейкоцитов |
На другие к л e т к и | ||||
Лимфотоксин | Лимфоциты человека, морской свинки, мыши, кошки, хомяка, | 80 000 — 150000 | Термостабилен | Повреждает или разрушает различные клетки-мишени |
Интерферон | Лимфоциты крови человека | 25000 | Термостабилен. Не диализируется | Делает клетки устойчивыми к заражению вирусами |
Фактор, угнетающий рост колоний | Лимфоциты крови человека | Нет данных | Термолабилен | Угнетает способность клеток HeLa образовывать колонии |
Фактор, угнетающий клеточную пролиферацию | Лимфоциты крови человека | Нет данных | Относительно термостабилен. Не диализируется | Угнетает включение тимидина в ДНК |
Фактор, замедляющий электрофоретическую подвижность | Лимфоциты крови человека | 45000 | Относительно термостабилен | Возможно, участвует в тром-бообразовании |
Факторы, действие которых выявлено in vivo | ||||
Кожно-реактивный фактор | Лимфоциты крови человека, лимф, узлов и селезенки морской | 30000 — 70000 ‘ | Термостабилен | При внутрикожном введении вызывает развитие воспаления по |
Фактор увеличения сосудистой проницаемости | Клетки лимфатических узлов свинки, мыши, крысы | 100000 | Термостабилен. Не диализируется | Повышает проницаемость сосудов, способствуя развитию |
Фактор переноса | Лимфоциты морской свинки | Менее 10 000 | Инактивируется при температуре выше 90°. Диализируется | Передает «иммунологическую память» несенсибилизирован-ным |
Лимфоциты человека | Менее 10000 | Термолабилен. Диализируется | То же | |
Библиография: Адо А. Д. Общая аллергология, М., 1978; Каулен Д. Р. и Голованова Т. А. Лимфокины как возможные регуляторы клеточного иммунитета, Онтогенез, № 2, с. 99, 1979, библиогр.; Медиаторы клеточного иммунитета, под ред. М. М. Авербаха, М., 1976, библиогр.; Медуницын Н. В. Медиаторы клеточного иммунитета, Журн, микр., эпид, и иммун., № 1, с. 12, 1976, библиогр.; Методы изучения in vitro клеточного иммунитета, под ред. Б. Блума и Ф. Глэйда, пер. с англ., М., 1974; Петров Р. В. Иммунология и иммуногенетика, М., 1976, библиогр.; Bellanti J. A. Immunology, Philadelphia а. о., 1971; Cohen S. а. о. Current state of studies of mediators of cellular immunity, Cell. Immunol. (N. Y.), v. 33, p. 233, 1977, bibliogr.; First international workshop on mechanism of action and characterization of lymphocyte mediators ibid., v. 27, p. 332, 1976; L a w r e n- c e H. S. a. Y a 1 e n t i n e F. T. Transfer factor and other mediators of cellular immunity, Amer. J. Path., v. 60, p. 437, 1970 bibliogr.; W a k s m a n B. H. a. N a ml b a Y. Commentary on soluble mediators of immunologic regulation, Cell. Immunol (N. Y.), v. 21,p. 161, 1976, bibliogr.
В. И. Пыцкий.
