Молекулярные механизмы врожденного иммунитета

Общие положения
Определение 1
Врожденный, или неспецифический иммунитет является более ранним механизмом защиты организма, как по времени ответа, так и в эволюционном плане.
Иммунный ответ при врожденном иммунитете развивается в первые несколько часов или дней после контакта с патогенным антигеном. Большая часть патогенов запускают механизмы врожденного иммунитета до развития иммунного ответа с присутствием лимфоцитов.
Организм-хозяин обладает различными механизмами врожденного иммунитета, эффективность которого при повторном контакте с возбудителем инфекции не возрастает.
Основную роль в механизмах неспецифической защиты организма играют:
- система комплемента,
- первичные рецепторы для патогенов,
- фагоцитоз, интерфероны (факторы защиты от вирусов),
- пептиды-антибиотики.
Барьеры против инфекций
От внедрения болезнетворных микроорганизмов, чужеродных клеток, организм защищают:
- кожа,
- секрет слизистых оболочек,
- движение ресничек эпителия,
- смывающий эффект и антибактериальное действие выделяемых жидкостей,
- нормальная микрофлора.
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Бактерия, внедрившаяся в организм, разрушается под действием лизоцима и подвергается дальнейшему фагоцитозу с последующим уничтожением фагоцитарными клетками.
К основным фагоцитарным клеткам относятся:
- полиморфноядерные нейтрофилы,
- мононуклеарные макрофаги.
Фагоцитарные клетки имеют рецепторы, способные распознавать на поверхности клеток патогенных микроорганизмов определенные молекулярные структуры. Вследствие этого фагоцит может связываться с микробной клеткой.
Компоненты микробных клеток распознают трансмембранные белки $TLR$ (Toll-подобные рецепторы. Их активация инициирует секрецию провоспалительных цитокинов.
По завершении фагоцитоза в действие вступают разнообразные бактерицидные механизмы:
- образуются реакционноспособные метаболиты кислорода;
- из гранул высвобождаются многочисленные кислород-независимые факторы;
- синтезируется оксид азота.
Привлечению фагоцитов к микробным клеткам и осуществлению фагоцитоза способствует активация по каскадному механизму многокомпонентной системы комплемента.
Комплемент выполняет ряд функций:
- микроорганизмы, покрытые белком $C_3b$, связываются с рецептором для $C_3b$ ($CR_1$) на оверхности фагоцитарных клеток, что способствует фагоцитозу;
- белок $C_5a$ оказывает активирующее и хемотаксическое воздействие на нейтрофилы, аналогично белки $C_3a$ и $C_5a$ воздействуют на эозинофилы, эти белки значительно повышают проницаемость капилляров;
- встраивание ЛМК в мембрану микробной клетки вызывает ее лизис;
- фрагмент $C_3b$ способствует продукции антител В-клетками.
Острая воспалительная реакция с участием комплемента
Активация комплемента участвует в следующих процессах:
- обеспечивает привлечение и стимуляцию нейтрофилов; приток полиморфноядерных лейкоцитов и повышение сосудистой проницаемости приводят к развитию острой воспалительной реакции, которая способна оказывать сильный антимикробный эффект;
- индуцирует экспрессию молекул адгезии на эндотелиах клетках, которые обеспечивают адгезию лейкоцитов и способствуют их проникновению между эндотелиальными клетками в очаг воспаления;
- активированные пептидом $C_5a$ фагоцитарные клетки, поглощают и уничтожают внедрившиеся в организм микробы;
- активированные пептидом $C_5a$ или компонентами микробных клеток тканевые макрофаги также могут инициировать воспаление, например, эндотоксином.
Гуморальные механизмы защиты
Гуморальные механизмы обеспечивают вторую линию защиты.
К факторам гуморальной защиты относятся:
- лизоцим;
- дефензины;
- система комплемента;
- белки острой фазы (С-реактивный белок, манносвязывающий лиганд);
- интерфероны (их регулярный эффект приводит к подавлению размножения вирусов);
- коллектины связываются с углеводными структурами на поверхности микробных клеток и с рецепторами фагоцитарных клеток, способствуя фагоцитозу.
Внеклеточное уничтожение микробов
Замечание 1
Клетки-киллеры (НК-клетки) обладают рецепторами, активирующими их цитотоксическую функцию, а также доминантными ингибиторными рецепторами, распознающими молекулы главного комплекса гистосовместимости класса I на поверхности не инфицированных и не измененных клеток.
НК-клетки разрушают инфицированные вирусами клетки. Вызывая запрограммированную клеточную гибель – апоптоз. Апоптоз может быть индуцирован или цитотоксическим эффектом перфорина и гранзимов, или взаимодействием лиганда Fas клеток-киллеров с рецептором Fas клеток-мишеней.
Внеклеточное уничтожение паразитов осуществляют эозинофилы, связываясь через свои $C_3b$-рецепторы с их поверхностью, покрытой $C_3b.$ Благодаря этому многие крупные паразиты, инвазирующие потенциально восприимчивый организм-хозяин, не вызывают заболевания.
Врождённый
иммунитет — наиболее ранний защитный
механизм как в эволюционном плане (он
существует практически у всех
многоклеточных), так и по времени ответа,
развивающегося в первые часы и дни после
проникновения чужеродного материала
во внутреннюю среду, т.е. задолго до
развития адаптивной иммунной реакции.
Значительную часть патогенов инактивируют
именно врождённые механизмы иммунитета,
не доводя процесс до развития иммунного
ответа с участием лимфоцитов. И только
если механизмы врождённого иммунитета
не справляются с проникающими в организм
патогенами, в «игру» включаются лимфоциты.
При этом адаптивный иммунный ответ
невозможен без вовлечения механизмов
врождённого иммунитета. Кроме того,
врождённый иммунитет играет главную
роль в удалении апоптотических и
некротических клеток и реконструировании
повреждённых органов. В механизмах
врождённой защиты организма важнейшую
роль играют первичные рецепторы для
патогенов, система комплемента, фагоцитоз,
эндогенные пептиды-антибиотики и факторы
защиты от вирусов — интерфероны. Функции
врождённого иммунитета схематично
представлены на рис. 3-1.
Рецепторы распознавания «чужого»
На
поверхности микроорганизмов
присутствуют повторяющиеся
молекулярные углеводные и липидные
структуры, которые
в подавляющем большинстве случаев
отсутствуют на клетках организма
хозяина. Особые рецепторы, распознающие
этот «узор» на поверхности патогена, —
PRR (Pattern
Recognition Receptors –РRP-рецептор)
— позволяют клеткам врождённого иммунитета
обнаруживать микробные клетки. В
зависимости от локализации выделяют
растворимые и мембранные формы PRR.
• Циркулирующие
(растворимые) рецепторы для
патогенов — белки сыворотки крови,
синтезируемые печенью: липополисахаридсвязывающий
белок (LBP — Lipopolysaccharide
Binding Protein), компонент
системы комплемента C1q и белки острой
фазы MBL и С-реактивный белок (СРБ). Они
непосредственно связывают микробные
продукты в жидких средах организма и
обеспечивают возможность их поглощения
фагоцитами, т.е. являются опсонинами.
Кроме того, некоторые из них активируют
систему комплемента.
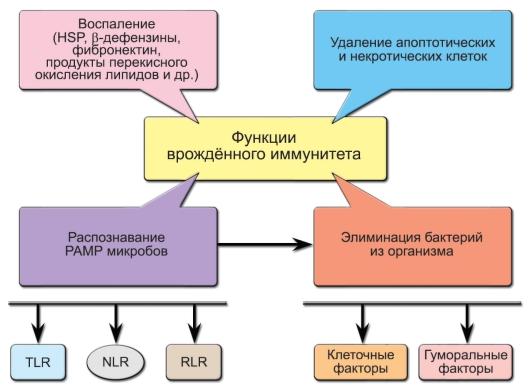
Рис.
3-1. Функции
врождённого иммунитета. Обозначения:
PAMP (PathogenAssociated
Molecular Patterns) —
молекулярные структуры микроорганизмов,
HSP (Heat
Shock Proteins) —
белки теплового шока, TLR (Toll-Like
Receptors), NLR (NOD-Like
Receptors), RLR (RIG-Like
Receptors) —
клеточные рецепторы
— СРБ, связывая
фосфорилхолин клеточных стенок ряда
бактерий и одноклеточных грибов,
опсонизирует их и активирует систему
комплемента по классическому пути.
— MBL принадлежит
к семейству коллектинов. Имея сродство
к остаткам маннозы, экспонированным на
поверхности многих микробных клеток,
MBL запускает лектиновый путь активации
комплемента.
— Белки
сурфактанта лёгких — SP-A и SP-D принадлежат
к тому же молекулярному семейству
коллектинов, что и MBL. Они, вероятно,
имеют значение в опсонизации (связывании
антител с клеточной стенкой микроорганизма)
лёгочного патогена — одноклеточного
грибка Pneumocystis
carinii.
• Мембранные
рецепторы. Эти
рецепторы расположены как на наружных,
так и на внутренних мембранных структурах
клеток.
— TLR (Toll-Like
Receptor —
Toll-подобный рецептор; т.е. сходный с
Toll-рецептором дрозофилы). Одни из них
непосредственно связывают продукты
патогенов (рецепторы для маннозы
макрофагов, TLR дендритных и других
клеток), другие работают совместно с
иными рецепторами: например, CD14 молекула
на макрофагах связывает комплексы
бактериального липополисахарида (ЛПС)
с LBP, а TLR-4 вступает во взаимодействие с
CD14 и передаёт соответствующий сигнал
внутрь клетки. Всего у млекопитающих
описано 13 различных вариантов TLR (у
человека пока только 10).
• Цитоплазматические
рецепторы:
— NOD-рецепторы (NOD1
и NOD2) находятся в цитозоле и состоят из
трёх доменов: N-концевого CARD-домена,
центрального NOD-домена (NOD — Nucleotide
Oligomerization Domain —
домен олигомеризации нуклеотидов) и
C-концевого LRR-домена. Различие между
этими рецепторами заключается в
количестве CARD-доменов. Рецепторы NOD1 и
NOD2 распознают мурамилпептиды — вещества,
образующиеся после ферментативного
гидролиза пептидогликана, входящего в
состав клеточной стенки всех бактерий.
NOD1 распознаёт мурамилпептиды с концевой
мезодиаминопимелиновой кислотой
(meso-DAP), которые образуются только из
пептидогликана грамотрицательных
бактерий. NOD2 распознаёт мурамилдипептиды
(мурамилдипептид и гликозилированный
мурамилдипептид) с концевым D-изоглутамином
или D-глутаминовой кислотой, являющиеся
результатом гидролиза пептидогликана
как грамположительных, так и
грамотрицательных бактерий. Кроме того,
NOD2 имеет сродство к мурамилпептидам с
концевым L-лизином, которые есть только
у грамположительных бактерий.
— RIG-подобныерецепторы (RLR, RIG-Like
Receptors): RIG-I (Retinoic
acid-Inducible Gene I),
MDA5 (Melanoma
Differentiation-associated Antigen 5)
и
LGP2 (Laboratory
of Genetics and Physiology 2).
Все
три рецептора, кодируемые этими генами,
имеют сходную химическую структуру и
локализуются в цитозоле. Рецепторы
RIG-I и MDA5 распознают вирусную РНК. Роль
белка LGP2 пока неясна; возможно, он
выполняет роль хеликазы, связываясь с
двуцепочечной вирусной РНК, модифицирует
её, что облегчает последующее распознавание
с помощью RIG-I. RIG-I распознаёт односпиральную
РНК с 5-трифосфатом, а также относительно
короткие (<2000 пар оснований) двуспиральные
РНК. MDA5 различает длинные (>2000 пар
оснований) двуспиральные РНК. Таких
структур в цитоплазме эукариотической
клетки нет. Вклад RIG-I и MDA5 в распознавание
конкретных вирусов зависит от того,
образуют ли данные микроорганизмы
соответствующие формы РНК.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Глава 1. ОСНОВНЫЕ ПОЛОЖЕНИЯ
Иммунитет — особое биологическое свойство многоклеточных организмов, направленное на защиту от генетически чужеродных факторов: микроорганизмов (бактерий, вирусов, простейших, грибов), инородных молекул и др. Иммунитет также обеспечивает невосприимчивость организма к инфекции при повторной встрече с патогеном. В медицинском смысле этот термин употребляли ещё до нашей эры в значениях: неприкосновенный, чистый, не затронутый заболеванием, невредимый, находящийся под хорошей защитой, устойчивый к заразной болезни.
Совокупность органных, тканевых, клеточных и молекулярных компонентов, функцией которых является осуществление иммунной защиты, называется иммунной системой. Иммунология — наука о строении и функциях иммунной системы как в норме, так и при различных патологических состояниях, в том числе и при нарушениях самой иммунной системы — иммунопатологиях.
Иммунную защиту обеспечивают два механизма: врождённый и адаптивный.
Врождённый иммунитет является присущей каждому организму с рождения, генетически закреплённой способностью противостоять инфекции. Это передовая линия обороны организма против патогенов, пытающихся проникнуть или уже проникших в покровные ткани или внутреннюю среду. Врождённый иммунитет срабатывает мгновенно или в течение первых нескольких часов после контакта с патогеном (возбудители, выделяемые ими токсины и другие чужеродные молекулы). Он включает четыре основных уровня защиты: анатомический, физиологический, фагоцитарный и воспалительный — покровные ткани, фагоциты, микробоцидные гуморальные вещества (протеазы, сильные окислители и свободные радикалы, продуцируемые фагоцитами, эндогенные противомикробные пептиды и др.), сосудистые реакции. Первичные рецепторы врождённого иммунитета — это молекулы многоклеточных, позволяющие «считывать» эволюционную память — информацию о том, чем отличаются микроорганизмы от собственных клеток.
Эти рецепторы способны распознавать консервативные молекулярные структуры — РАМР (Pathogen-Associated Molecular Patterns), характерные для групп сходных микроорганизмов. В настоящее время постоянно открывают новые патогенраспознающие рецепторы врождённого иммунитета. К ним относят мембраносвязанные паттернраспознающие рецепторы (Pattern Recognition Receptors, PRR), а также растворимые рецепторы — ряд белков сыворотки крови: C-реактивный белок (СРБ), маннозосвязывающий лектин (MBL — Mannose-Binding Lectin), компоненты комплемента.
Собственные возможности клеток врождённого иммунитета санировать организм от проникшего патогена часто недостаточны. Множество патогенов приспособилось выживать в присутствии факторов врождённой резистентности к инфекциям. Именно поэтому в процессе эволюции, начиная с челюстных рыб, к врождённому иммунитету добавился адаптивный иммунитет — специфический. Материальные носители адаптивного иммунитета — лимфоциты. Уникальное и отличительное свойство лимфоцитов как множества клеток — способность распознавать почти неограниченное (1018) разнообразие молекулярных объектов — антигенов. Лимфоциты характеризуются экспрессией Т-клеточных (TCR) или В-клеточных (BCR) рецепторов, распознающих только одну антигенную детерминанту либо небольшое число структурно очень близких детерминант, и поэтому, в отличие от PRR, обладающих высокой специфичностью (рис. 1-1).
Адаптивный (приобретённый) иммунитет формируется в течение жизни индивидуума. Активно приобретённый иммунитет — состояние невосприимчивости к инфекции после перенесённого инфекционного заболевания или после вакцинации (сам организм вырабатывает соответствующие антитела). Пассивно приобретённый иммунитет — состояние невосприимчивости к инфекции в результате поступления в организм уже готовых антител от матери или в результате инъекции (сам организм эти антитела не вырабатывает).
ИММУННЫЙ ОТВЕТ
Врождённая и адаптивная системы защиты организма включают клеточный и гуморальный компоненты и активно взаимодействуют друг с другом в процессе иммунного ответа. Иммунный ответ — многоэтапный процесс, заключающийся в распознавании и деструкции патогена и повреждённых им тканей. В его основе лежит уникальное свойство иммун-

Рис. 1-1. Сравнение врождённого и адаптивного иммунитета
ной системы отличать «свое» («sef») от «чужого» («nonself») и применять по отношению к «чужому» механизмы нейтрализации и уничтожения, а именно — иммунные реакции. Распознавание множества чужеродных антигенов происходит благодаря наличию в организме огромного разнообразия образующихся в тимусе клонов T-лимфоцитов (отбор клонов) и при помощи комплекса генов главного комплекса гистосовместимости (MHC) классов I и II. Нейтрализацию «чужого» осуществляют цирку-
лирующие в жидкостях организма антитела (гуморальный иммунитет) и цитотоксические лимфоциты (клеточный иммунитет).
Таким образом, основными характеристиками адаптивного иммунного ответа являются умение различать собственные антигены от чужеродных, специфичность и иммунная память.
• Различение «своего» и «чужого» выражается в дифференциации компонентов собственных тканей организма и чужеродных молекул. Специфическую неотвечаемость организма на собственные антигены обозначают как иммунную толерантность. Если же организм воспринимает собственные компоненты как чужеродные, развивается аутоиммунный ответ.
• Специфичность иммунного ответа проявляется в том, что иммунитет, сформировавшийся в результате контакта с определённым антигеном, будет обеспечивать защиту только против этого антигена.
• Иммунная память формируется в результате адаптивного иммунного ответа против конкретного возбудителя и сохраняется, как правило, в течение всей последующей жизни организма, защищая его от повторной инфекции, вызываемой этим же возбудителем. Такой механизм обеспечивается способностью иммунной системы к «запоминанию» антигенных детерминант патогена за счёт образования клеток иммунной памяти. Наличие иммунной памяти обусловливает развитие ускоренного и усиленного ответа (вторичный иммунный ответ) при повторном контакте с антигеном. Формирование иммунной памяти является основной целью вакцинации, т.е. процесса естественного или искусственного формирования иммунной защиты против определённой инфекции.
Схема развития иммунного ответа представлена на рис. 1-2. Содержание отдельных этапов иммунного ответа раскрыто ниже.
• Воспаление: участвуют клетки, поглощающие антигены (фагоциты, антигенпрезентирующие клетки) — в частности, дендритные клетки (ДК), макрофаги, эндотелиальные и другие клетки. Выделяются провоспалительные цитокины и хемокины.
• Переработка антигена (процессинг). После поглощения антигена антигенпрезентирующей клеткой (АПК) происходит его процессинг (расщепление и встраивание в молекулы MHC) и презентация на поверхности клетки. Это необходимо для распознавания антигена Т-лимфоцитами.
• Распознавание антигена происходит в периферических лимфоидных органах. Начало специфического иммунного ответа — про-

Рис. 1-2. Основные этапы иммунного ответа
лиферация и дифференцировка эффекторных и регуляторных лимфоцитов.
• Деструкция антигена и повреждённых патогеном тканей. При этом одни лимфоциты (помощники — хелперы) «нанимают» для выполнения эффекторных функций другие лимфоциты (эффекторные) и/или воспалительные лейкоциты (нейтрофилы, моноциты, базофилы, эозинофилы), тучные клетки, а также гуморальные литические системы типа комплемента.
• Выведение продуктов распада происходит с участием известных систем выделения.
КЛЕТКИ ИММУННОЙ СИСТЕМЫ
Клетки иммунной системы условно подразделяют на клетки врождённого и адаптивного иммунитета (рис. 1-3). Главным их различием является специфичность распознавания: низкая у первых и высокая у вторых. Существует и третья группа клеток — промежуточная, несущая черты обеих групп. Наличие этой группы показывает единство происхождения и способов защиты организма от чужеродных веществ антигенной природы.

Рис. 1-3. Клетки иммунной системы
В выполнении эффекторных иммунных функций очень важную роль играют АПК, T- и B-лимфоциты и NK-клетки (от англ. Natural Killer — естественный киллер, натуральный киллер).
• Антигенпрезентирующие клетки (АПК). К АПК относят макрофаги, дендритные клетки (включая клетки Лангерганса эпидермиса, М-клетки лимфатических фолликулов пищеварительного тракта и других слизистых оболочек, дендритные эпителиальные клетки тимуса), а также B-лимфоциты. АПК захватывают антиген, обрабатывают его (процессируют) и презентируют антигенные фрагменты на своей поверхности T-лимфоцитам (рис. 1-4).
• T-лимфоциты обусловливают клеточный иммунный ответ, а также помогают отвечать на антиген B-лимфоцитам при гуморальном иммунном ответе. Каждый T-лимфоцит несет на своей поверхности рецептор T-лимфоцитов (TCR — T-Cell Receptor) (см. рис. 5-1, в и рис. 6-1) строго одной специфичности, т.е. взаимодействующий с одним антигеном. T-клетки по экспрессии маркёрных антигенов CD (Cluster Differentiation) подразделяют на CD4+ и CD8+.
— CD4+ Т-лимфоциты (хелперы). Среди T-клеток, экспрессирующих мембранные маркёры CD4, выделяют Т-лимфоциты с эффекторными функциями (Th1, Th2, Th17) и Т-регуляторные клетки (естественные — Treg и индуцированные — Th3, или Tr1).

Рис. 1-4. Взаимодействие клеток в ходе гуморального иммунного ответа. Рецептор T-хелпера (TCR) распознаёт антигенную детерминанту (эпитоп), экспрессированную на поверхности антигенпрезентирующей клетки вместе с молекулой главного комплекса гистосовместимости класса II (MHC-II). Во взаимодействии участвует маркёрная молекула T-хелпера — CD4. В результате подобного взаимодействия антигенпрезентирующая клетка секретирует интерлейкин-1 (ИЛ-1), стимулирующий в T-хелпере синтез и секрецию цитокинов, включая ИЛ-2, а также синтез и перенос на плазматическую мембрану T-хелпера рецепторов для ИЛ-2 (ИЛ-2 также стимулирует пролиферацию T-хелперов). Отбор B-лимфоцитов происходит при взаимодействии антигена с вариабельными участками антител (иммуноглобулинов) на поверхности этих клеток (правая часть рисунка). Эпитоп этого антигена в комплексе с молекулой MHC-II распознаёт рецептор T-хелпера, после чего T-лимфоцит секретирует цитокины, стимулирующие пролиферацию B-лимфоцитов и их дифференцировку в плазматические клетки, синтезирующие антитела к данному антигену. Также показаны некоторые мембранные белки (CD40/CD40L и CD28/B7), участвующие в проведении костимуляторных сигналов, необходимых для полноценной активации взаимодействующих клеток (они описаны подробнее в главе 7)
◊ T-хелперы при взаимодействии с АПК специфически распознают антигены и начинают вырабатывать определённый набор цитокинов соответственно типу инфекционного агента: Th2 при взаимодействии с B-клетками индуцируют гуморальный иммунный ответ (см. рис. 1-4), а Th1 — при взаимодействии с макрофагами и цитотоксическими Т-лимфоцитами (ЦТЛ) — клеточный иммунный ответ. Th17 продуцируют ИЛ17 — мощный индуктор тканевого воспаления, привлекающий и активирующий гранулоциты и макрофаги.
◊ Регуляторные T-клетки (Т-регуляторы) контролируют интенсивность иммунного ответа, подавляя активность других субпопуляций Т-лимфоцитов.
— CD8+ Т-лимфоциты. Субпопуляция T-клеток, экспрессирующих мембранные молекулы CD8. Эти клетки выступают в роли ЦТЛ. Они лизируют клетки-мишени, несущие чужеродные или видоизменённые собственные антигены — аутоантигены: например, клетки опухоли, трансплантата, инфицированные вирусом клетки, несущие поверхностные вирусные антигены. Эффекторные функции ЦТЛ реализуются через индукцию образования в клетках-мишенях пор (под действием особых белков — перфоринов) и секрецию в поры специализированных сериновых протеаз — гранзимов. Вызванное этим нарушение осмотического баланса с внеклеточной средой приводит к гибели клетки (рис. 1-5). Под влиянием гранзимов индуцируются процессы запрограммированной гибели клетки — апоптоза.
• Т-клетки памяти — долгоживущие рециркулирующие малые лимфоциты, формируемые при первичном иммунном ответе. Они «запоминают» особенности детерминант антигенов и при повторном распознавании того же антигена развивают быстрый и усиленный ответ. Т-клетки памяти отличаются от наивных и эффекторных Т-лимфоцитов высоким уровнем экспрессии мембранных маркёров активации, меньшей потребностью в провоспалительных медиаторах и корецепторных сигналах для развития вторичного иммунного ответа.
• B-лимфоциты отвечают за гуморальный иммунный ответ. На мембране B-лимфоцитов присутствует рецептор для антигена — мономер IgM. Продолжительность жизни большинства B-лимфоцитов (если они не активируются антигеном!) не превышает 10 сут.

Рис. 1-5. Уничтожение клетки-мишени цитотоксическим T-лимфоцитом (Т-киллером). При сближении цитотоксического T-лимфоцита с клеткоймишенью после специфичного взаимодействия мембранных молекул клетокпартнёров T-лимфоцит убивает клетку-мишень
— Эффекторные B-лимфоциты. Активированные B-лимфоциты размножаются и дифференцируются в плазматические клетки (см. рис. 5-9), вырабатывающие антитела (иммуноглобулины, специфичные к конкретному антигену). При этом плазматические клетки теряют экспрессию специфических рецепторов для антигена.
— B-лимфоциты иммунной памяти — долгоживущие рециркулирующие малые лимфоциты. Они не превращаются в плазматические клетки, но сохраняют иммунную «память» об антигене, с которым когда-то контактировали, за счёт продолжающейся экспрессии рецептора для антигена. Клетки памяти активируются
при повторном распознавании того же антигена. В этом случае B-лимфоциты памяти, при обязательном участии T-хелперов и ряда других факторов, превращаются в плазматические клетки, обеспечивая быстрый синтез большого количества специфичных антител, взаимодействующих с чужеродным антигеном, и развитие эффективного иммунного ответа. • NK-клетки (от англ. Natural Killer — естественный киллер) — лимфоциты, лишённые характерных для T- и B-клеток поверхностных CD-маркёров, а также антигенраспознающих рецепторов — TCR (T Cell Receptor) или BCR (B Cell Receptor). Эти клетки играют важную роль в механизмах врождённого иммунитета (см. главу 3), уничтожают трансформированные, инфицированные вирусами и чужеродные клетки.
