Мрт для диагностики врастания плаценты
Плацентарная дисфункция является распространенной акушерской проблемой, которая осложняет 5-10% всех беременностей. Это прогрессирующее состояние, при котором внутриутробное снабжение кислородом и питательными веществами является недостаточным для поддержания нормального роста плода и развития органов. В настоящее время нет эффективных способов улучшения функции плаценты, тем не менее, правильная антенатальная диагностика плацентарной дисфункции приводит к четырехкратному улучшению неонатального исхода, так как это обеспечивает своевременное родоразрешение и тем самым снижает риск необратимого повреждения органов плода. В настоящее время скрининг плацентарной дисфункции фокусируется на оценках веса плода и измерениях допплеровского кровотока плода и пуповины. Тем не менее, размер плода не достаточно точно отражает функцию плаценты, кроме того, при поздней дисфункции плаценты допплер не обнаруживает патологии. Поэтому дополнительные маркеры, которые непосредственно отражают функцию плаценты, могут значительно улучшить диагностику плацентарной дисфункции. В данный момент растет интерес к МРТ плаценты из-за ее способности обнаруживать плацентарную дисфункцию in vivo.
МРТ нормальной плаценты
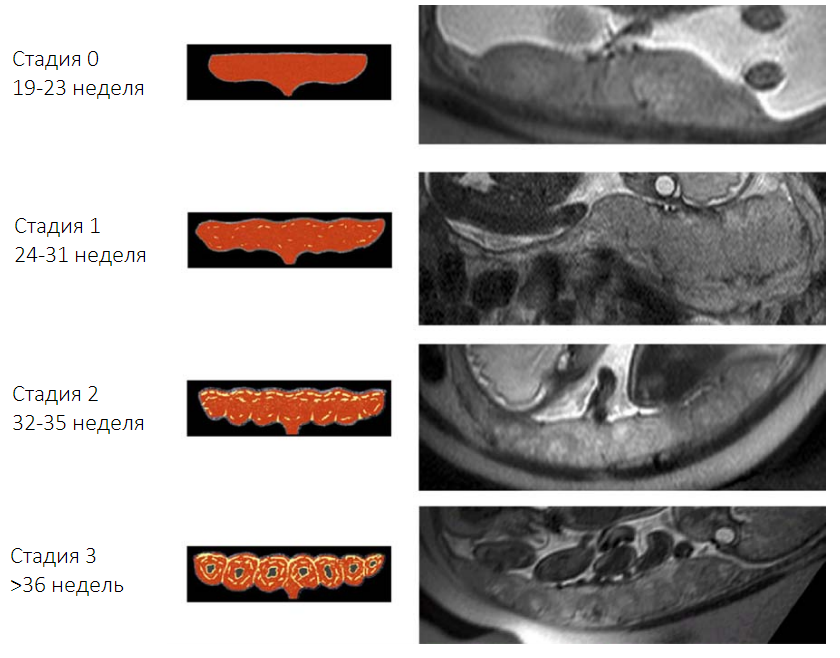
На МРТ нормальная плацента между 19 и 23 неделями беременности имеет относительно однородную высокую интенсивность сигнала Т2 и относительно низкую интенсивность сигнала Т1. В период между 24 и 31 неделей беременности можно увидеть слабо выраженную дольчатость плаценты и множественные перегородки между долями, что ведет к увеличению гетерогенности с увеличением срока беременности. Нормальный миометрий обычно выглядит трехслойным на T2-взвешенных изображениях, с неоднородно гиперинтенсивным средним слоем и более тонкими слоями с низкой интенсивностью сигнала с обеих сторон. Иногда миометрий появляется в виде одного тонкого слоя с равномерной интенсивностью сигнала в местах сдавления, например, рядом с позвоночником и аортой. Хорошо видна граница между плацентой и околоплодные водами, граница со стенкой матки также достаточно четкая.
Антенатальная МРТ нормальной плаценты показала четкие морфологические изменения во время беременности. В 2006 году была проведена томография женщин на разных сроках беременности по результатам которой исследователи выделили 4 стадии изменений в плаценте по мере увеличения срока. Стадии 0 соответствует правильная, однородная структура плаценты характерная для срока от 19 до 23 недель. С 24 по 31 неделю в плаценте начинают появляться первые изменения в виде слабо выраженной дольчатости, что соответствует стадии 1. Стадия 2 характеризуется увеличением количества и выраженности долек в сроке с 31 по 35 неделю. Плацента в сроке 36 недель и далее имеет ярко выраженную дольчатую структуру и соответствует стадии 3. По мере увеличения срока гестации также наблюдается уменьшение соотношения интенсивности сигнала плаценты/околоплодных вод.

Рисунок 1| Изменение внешнего вида плаценты на МРТ по мере увеличения срока беременности.
МРТ при задержке роста плода
Плацентарная недостаточность наиболее часто приводит к задержке роста плода, когда не достигаются параметры соответствующие сроку гестации. Недостаточное питание плода и гипоксия приводят к повышению риска когнитивных нарушений, церебрального паралича и метаболических нарушений.
Несмотря на то, что у плодов с задержкой внутриутробного развития объем плаценты увеличивается по мере увеличения срока, он остается сниженным относительно нормальных параметров. Внешний вид плаценты характеризуется утолщением и изменением формы ближе к шаровидной, с увеличением отношения толщины плаценты к объему.
Значение T2 падает при плацентарной недостаточности, что делает плаценту более темной, с большей неоднородностью, возможно, из-за областей инфаркта и фиброза.
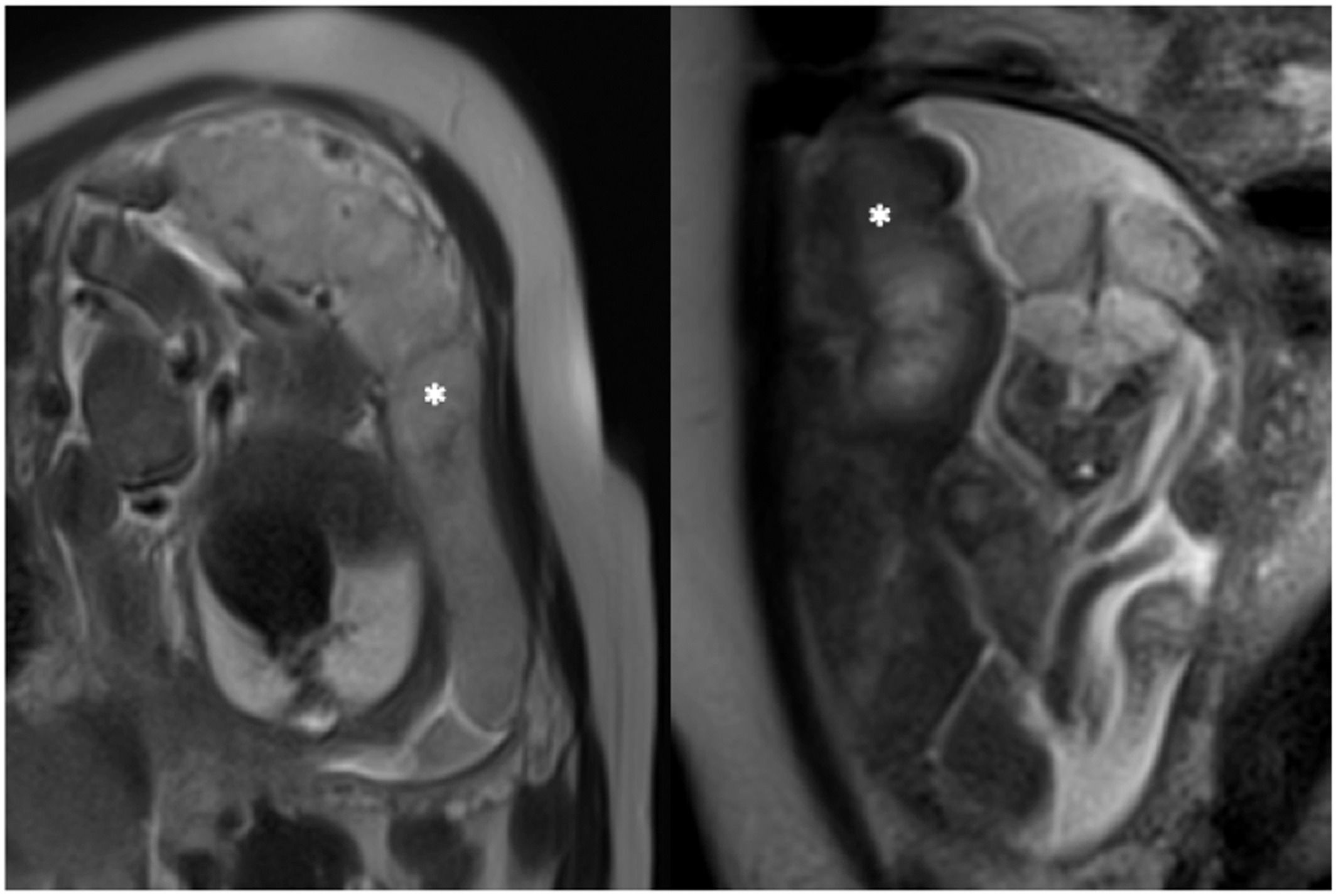
Рисунок 2 | МРТ нормальной плаценты (слева) и при задержке роста плода (справа). Плацента отмечена белой звездой. Обратите внимание на разницу во внешнем виде при взвешенной визуализации T2: нормальная плацента выглядит светлее и более однородной.
Диффузионно-взвешенные изображения
Интенсивность сигнала на диффузионно-взвешенном изображении (DWI) отражает диффузионную способность молекул воды исследуемого объекта. На диффузионную способность непосредственно влияет плотность расположения клеток и объем внеклеточного пространства.
Диффузно-взвешенная визуализация имеет потенциальную ценность при обнаружении аномалий плаценты, поскольку задержка внутриутробного роста связана с уменьшением площади поверхности обмена на уровне ворсин, что приводит к меньшей диффузионной проводимости. Среди многих причин ограничения диффузии при беременности наиболее важными являются гематомы и инфаркты плаценты, поскольку они приводят к меньшей диффузионной проводимости и ограниченному кровоснабжению вследствие дегенерации и рубцевания тканей. Таким образом, нарушение зрелости плаценты и очаговое нарушение плацентарного барьера могут привести к измененной диффузии.
В нескольких исследованиях изучающих диффузионно-взвешенные изображения плаценты с ограничением роста было установлено, что значения коэффициента диффузии плаценты значительно ниже в плацентах с задержкой роста плода.
Когда исследование выполняется в хорошо перфузируемых сосудистых тканях, измеренное затухание сигнала при низкой диффузионной сенсибилизации обусловлено не только диффузией свободной воды в ткани, но и микроциркуляцией внутри капиллярной сети. Внутривоксельное некогерентное движение (IVIM) — это традиционный вариант DWI, применяемый к перфузируемым органам. Он может быть использован при оценке капиллярного кровотока без необходимости введения контрастных веществ. При плацентарной недостаточности перфузионная фракция снижается по сравнению с нормальной плацентой.
Хотя до настоящего времени большинство исследований проводилось с целью изучения ограничения роста одного плода, в будущем визуализация перфузии может быть полезна для количественной оценки несоответствия плацентарной перфузии между близнецами и функционального объема плацентарной ткани. Это может помочь определить наилучшее место для лазерной коагуляции при лечении фето-фетального трансфузионного синдрома, гарантируя, что у каждого близнеца достаточно функционирующей ткани, чтобы выжить, или продемонстрировать, что это невозможно.
Релаксометрия
Магнитно-резонансная томография также может использоваться для оценки оксигенации плаценты, поскольку поперечное время релаксации (Т2*) зависит от наличия дезоксигемоглобина. Помимо оксигенации тканей на величину T2* также влияют элементы состава ткани, такие как плотность клеток, содержание воды, количество атомов водорода и площадь поверхности.
В плаценте время релаксации T2 уменьшается с увеличением срока беременности и значительно уменьшается в плаценте при беременности, осложненной задержкой внутриутробного развития, возможно, из-за фиброза, некроза и инфарктов в паренхиме плаценты.
Так как на результаты Т2 релаксометрии влияет уровень насыщения кислородом ткани, (более высокие значения насыщения кислородом приводят к более высоким значениям T2), МРТ может косвенно измерить фетоплацентарную оксигенацию. Насыщение кислородом в фетоплацентарной системе обычно довольно низкое по сравнению со здоровыми взрослыми показателями насыщения кислородом и оказывается значительно ниже у плодов с задержкой развития. Поскольку насыщение кислородом трудно измерить напрямую, а инвазивные методы, такие как кордоцентез, несут в себе риск выкидыша, МРТ релаксометрия обеспечивает неинвазивный способ измерения уровня кислорода в фетоплацентарной системе.
Источники:
- Sørensen A. et al. T2* weighted placental MRI: basic research tool or an emerging clinical test of placental dysfunction? //Ultrasound in Obstetrics & Gynecology. – 2019.
- Aughwane R. et al. Placental MRI and its application to fetal intervention //Prenatal diagnosis. – 2019.
- Fadl S. et al. Placental imaging: normal appearance with review of pathologic findings //Radiographics. – 2017. – Т. 37. – №. 3.
- Gowland P. Placental mri //Seminars in Fetal and Neonatal Medicine. – WB Saunders, 2005. – Т. 10. – №. 5.
- Damodaram M. et al. Placental MRI in intrauterine fetal growth restriction //Placenta. – 2010. – Т. 31. – №. 6.
- Bonel H. M. et al. Diffusion-weighted MR imaging of the placenta in fetuses with placental insufficiency //Radiology. – 2010. – Т. 257. – №. 3.
- Blaicher W. et al. Magnetic resonance imaging of the normal placenta //European journal of radiology. – 2006. – Т. 57. – №. 2.
- Sinding M. et al. Placental magnetic resonance imaging T2* measurements in normal pregnancies and in those complicated by fetal growth restriction //Ultrasound in Obstetrics & Gynecology. – 2016. – Т. 47. – №. 6.
Цель исследования. Оценить диагностическую значимость различных МР-признаков в определении степени инвазии плаценты.
Материалы и методы. В ретроспективное когортное исследование были включены 32 пациентки с морфологически верифицированным диагнозом врастания плаценты. В зависимости от гистологического заключения о степени инвазии все случаи были разделены на три группы: 1 – placenta accreta (n=10), 2 – placenta increta (n=20), 3 – placenta percreta (n=2).
Результаты. Центральное предлежание плаценты в 8,5 раза чаще встречается у пациенток с placenta increta . В то время как для placenta accreta более характерно краевое предлежание (p=0,015). Другие клинико-анамнестические параметры не показали влияния на степень инвазии плаценты. Множественные лакуны в 9 раз чаще преобладали при placenta increta, в то время как при placenta accreta определялось их не более 1–2. Темные полосы – также более характерный признак для более глубокой степени инвазии плаценты (p=0,04).
Заключение. В результате проведенного исследования была показана связь между формой аномалии прикрепления плаценты и степенью ее инвазии. Множественные лакуны и «темные полосы» являются значимыми маркерами на МРТ в диагностике placenta increta.
Одной из наиболее острых акушерских проблем, приобретающих все большую актуальность в последние годы, является патология врастания плаценты. В первую очередь подобная динамика объясняется ятрогенными факторами в отношении родоразрешения беременных в сторону кесарева сечения, а также увеличивающейся частотой внутриматочных вмешательств. Также известно, что пациентки, беременность которых отягощена предлежанием плаценты, имеют гораздо больший риск ее врастания. В зависимости от числа перенесенных кесаревых сечений в анамнезе женщины данный показатель экстенсивно возрастает до 3,3, 11, 40, 61, 67% соответственно числу рубцов на матке после абдоминального родоразрешения [1]. Показана роль и других факторов: зрелый возраст женщины, миома матки, синдром Ашермана [2, 3].
Патогенетический механизм требует ответов еще на многие вопросы, однако известно, что патологическая инвазия плаценты происходит при недостаточно выраженном децидуальном слое. Проникновение через базальный слой слизистой оболочки до миометрия является наиболее сложной для диагностики формой – placenta accreta. Инвазия ворсин в толщу миометрия носит название placenta increta. Наиболее тяжелым, и вместе с этим, более редким вариантом является placenta percreta, при которой происходит прободение серозной оболочки и даже соседних интактных органов малого таза.
Врастание плаценты представляет крайне тяжелое состояние, особенно при несвоевременной диагностике, объясняющееся угрозой массивного кровотечения в третьем периоде родов и в послеродовом периоде, приводящего к диссеминированному внутрисосудистому свертыванию и развитию полиорганной недостаточности. По мере роста ворсин закономерно увеличивается объем кровопотери за счет вовлечения большого числа сосудов с бассейна различных артерий [4]. В дополнение, в ряде случаев в патологический процесс оказываются вовлечены соседние органы, что в значительной мере меняет хирургический план, поэтому чрезвычайно важно антенатальное определение степени врастания плаценты.
Одним из наиболее распространенных и широко доступных методов является ультразвуковое исследование (УЗИ) [5]. Однако в последнее время интерес исследователей и клиницистов обращен в сторону магнитно-резонансной томографии (МРТ). Работы последних лет не показали какой-либо значимой разницы в прогностической ценности обоих методов [6, 7]. Тем не менее, в тех ситуациях, когда рутинного УЗИ оказывается недостаточно (при расположении плаценты по задней или боковым стенкам матки, placenta percreta, вовлеченность соседних органов) роль МРТ приобретает особый диагностический статус [7]. Благодаря многочисленным исследовательским работам удалось выявить наиболее значимые критерии в определении врастания плаценты. Валидными показали себя маркеры, позволяющие определить плацентарную ткань в толще миометрия или кнаружи от него, а также истончение или прерывность мышечного слоя матки, вплоть до отсутствия четкой границы между стенкой матки и мочевым пузырем при патологии в нижнем маточном сегменте, приводящей к его выбуханию. Позднее все большее внимание приобретали критерии, ассоциированные с патологией сосудистого компонента плацентарно-маточного комплекса: нерегулярные внутриплацентарные полосы, или «ленты», со сниженной на Т2-взвешенных изображениях (Т2ВИ) интенсивностью МР-сигнала, выраженная плацентарная гетерогенность, а также лакуны, которые представляют собой сосуды диаметром 6 и более миллиметров [4, 8–11]. Один из мировых лидеров освещаемой темы, J.M. Palacios-Jaraquemada выделил специфическое патологическое состояние – шеечно-треугольниковую гиперплазию, визуализируемую только посредством МРТ [10]. Ее генез автор объясняет усилением кровотока по бассейнам влагалищно-маточных анастомозов, отходящих от внутренней половой артерии между треугольником Льето мочевого пузыря и шейкой матки.
В настоящем исследовании проведена ретроспективная оценка различных МР-признаков в определении морфологических вариантов врастания плаценты по единому протоколу обследования у пациенток с верифицированным гистологическим диагнозом. Данные диагностические критерии были оценены на предмет специфичности в определении глубины инвазии плаценты, что и определило цель настоящей работы.
Цель исследования: оценить диагностическую значимость различных МР-признаков (плацентарная гетерогенность, усиление сосудистого рисунка, наличие ретроплацентарной «тени», лакун и «темных лент», выбухание стенки матки, истонч…
1. Silver R.M., Landon M.B., Rouse D.J., Leveno K.J., Spong C.Y., Thom E.A. et al. Maternal morbidity associated with multiple repeat cesarean deliveries. Obstet. Gynecol. 2006; 107(6): 1226-32.
2. Wu S., Kochergnisky M., Hibbard J.U. Abnormal placentation: twenty-year analysis. Am. J. Obstet. Gynecol. 2005; 192(5): 1458-61.
3. Al-Serehi A., Mhoyan A., Brown M., Benirschke K., Hull A., Pretorius D.H. Placenta accreta:an association with fibroids and Asherman syndrome. J. Ultrasound Med. 2008; 27(11): 1623-8.
4. Lax A., Prince M.R., Mennitt K.W., Schwebach J.R., Budorick N.E. The value of specific MRI features inthe evaluation of suspected placental invasion. Magn. Reson. Imaging. 2007; 25(1): 87-93.
5. Бойкова Ю.В., Илиева Э.А., Кан Н.Е., Кулабухова Е.А., Гус А.И. Возможности эхографии в выявлении патологической инвазии трофобласта. Акушерство и гинекология. 2016; 12: 82-6. https://dx.doi.org/10.18565/aig.2016.12.82-86
6. D’Antonio F., Iacovella C., Palacios-Jaraquemada J., Bruno C.H., Manzoli L., Bhide A. Prenatal identification of invasive placentation using magnetic resonance imaging: systematic review and meta-analysis. Ultrasound Obstet. Gynecol. 2014; 44(1): 8-16.
7. Budorick N.E., Figueroa R., Vizcarra M., Shin J. Another look at ultrasound and magnetic resonance imaging for diagnosis of placenta accreta. J. Matern. Fetal Neonatal Med. 2017; 30(20): 2422-7.
8. Lim P.S., Greenberg M., Edelson M.I., Bell K.A., Edmonds P.R., Mackey A.M. Utility of ultrasound and MRI in prenatal diagnosis of placenta accreta: a pilot study. AJR Am. J. Roentgenol. 2011; 197(6): 1506-13.
9. Derman A.Y., Nikac V., Haberman S., Zelenko N., Ophsa O., Flyer M. MRI of placenta accreta: a new imaging perspective. AJR Am. J. Roentgenol. 2011; 197(6): 1514-21.
10. Palacios-Jaraquemada J.M., Bruno C.H., Martín E. MRI in the diagnosis and surgical management of abnormal placentation.. MRI in the diagnosis and surgical management of abnormal placentation. Acta Obstet. Gynecol. Scand. 2013; 92(4): 392-7.
11. Manjiri Dighe. MR imaging of abnormal placentation. Magn. Reson. Imaging Clin. N. Am. 2017; 25(3): 601-10.
12. Palacios-Jaraquemada M., Bruno C. Gadolinium-enhanced MR imaging in the differential diagnosis of placenta accreta and placenta percreta. Radiology. 2000; 216(2): 610-1.
13. Millischer A.E., Deloison B., Silvera S., Ville Y., Boddaert N., Balvay D. et al. Dynamic contrast enhanced MRI of the placenta: A tool for prenatal diagnosis of placenta accreta? Placenta. 2017; 53: 40-7.
14. Jauniaux E., Collins S., Burton G.J. Placenta accreta spectrum: pathophysiology and evidence-based anatomy for prenatal ultrasound imaging. Am. J. Obstet. Gynecol. 2017; Jun 24. pii: S0002-9378(17)30731-7.
15. Baughman W.C., Corteville J.E., Shah R.R. Placenta accreta: spectrum of US and MR imaging findings. Radiographics. 2008; 28(7): 1905-16.
16. Breen J.L., Neubecker R., Gregori C.A., Franklin J.E. Jr. Placenta accreta, increta, and percreta: a survey of 40 cases. Obstet. Gynecol. 1977; 49(1): 43-7.
17. Cramer S.F., Heller D. Placenta accreta and placenta increta: an approach to pathogenesis based on the trophoblastic differentiation pathway. Pediatr. Dev. Pathol. 2016; 19(4): 320-33.
18. Thia E.W., Lee S.L., Tan H.K. Tan L.K. Ultrasonographical features of morbidly-adherent placentas. Singapore Med. J. 2007; 48(9): 799-802.
19. Maldjian C., Adam R., Pelosi M., Pelosi M., Rudelli R.D., Maldjian J. MRI appearance of placenta percreta and placenta accreta. Magn. Reson. Imaging. 1999; 17(7): 965-71.
20. Chen X., Shan R., Zhao L., Song Q., Zuo C., Zhang X. et al. Invasive placenta previa: Placental bulge with distorted uterine outline and uterine serosal hypervascularity at 1.5T MRI – useful features for differentiating placenta percreta from placenta accreta. Eur. Radiol. 2017; Aug 2.
21. Teo T.H., Law Y.M., Tay K.H., Tan B.S., Cheah F.K. Use of magnetic resonance imaging in evaluation placental invasion. Clin. Radiol. 2009; 64: 511-6.
Поступила 12.10.2017
Принята в печать 27.10.2017
Виницкий Александр Анатольевич, аспирант родильного отделения ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (925) 362-02-32. E-mail: drvinitskiy@gmail.com
Кулабухова Елена Анатольевна, к.м.н., врач-рентгенолог отделения лучевой диагностики ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-76-47. E-mail: mri-Elena@yandex.ru
Быченко Владимир Геннадьевич, к.м.н., зав. отделением лучевой диагностики ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-76-47. E-mail: v_bychenko@oparina4.ru
Шмаков Роман Георгиевич, д.м.н., главный врач ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-73-00. E-mail: r_shmakov@oparina4.ru
Ежова Лариса Сергеевна, к.м.н., старший научный сотрудник патологоанатомического отделения ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-28-92. E-mail: l_ezhova@oparina4.ru
Учеваткина Полина Владимировна, врач-рентгенолог отделения лучевой диагностики ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-76-47. E-mail: kulpova@mail.ru
Пирогова Мария Михайловна, аспирант ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (916) 094-45-69. E-mail: pirogovamariya@gmail.com.
Для цитирования: Виницкий А.А., Кулабухова Е.А., Быченко В.Г., Шмаков Р.Г., Ежова Л.С., Учеваткина П.В, Пирогова М.М. Прогностическая значимость МРТ в диагностике различных форм врастания плаценты. Акушерство и гинекология. 2018; 1: 41-7.
https://dx.doi.org/10.18565/aig.2018.1.41-47
Авторы: Charleen Sze-yan Cheung, Ben Chong-pun Chan
Введение
Патологически адгезивная плацента представляет собой спектр расстройств, характеризующихся аномальным креплением или проникновением плаценты в стенку матки. Гистологически это определяется согласно степени патологического проникновения. Истинное врастание плаценты (ВП) происходит, когда ворсинки плаценты распространяются в миометрий. При placenta percreta инвазии распространяются глубоко за пределы маточной серозы. С клинико-хирургической точки зрения разные степени инвазии могут сосуществовать у одного и того же пациента.
Подавляющее большинство женщин с ВП имеют идентифицируемый фактор риска. Предлежание плаценты и предшествующее кесарево сечение являются основными факторами риска. Риск возрастает с увеличением числа предыдущих кесаревых сечений. Травма и рубцевание миометрия в результате повторных дилатаций и выскабливания или других корректирующих операций также способствуют риску развития аномальной адгезии плаценты. Пожилой возраст матери также был определен как независимый фактор риска. Другие включают курение, многоплодие и периодические выкидыши.
ВП остается основной причиной материнских кровотечений и акушерской гистерэктомии. Выявление факторов риска, точная дородовая и предоперационная диагностика, многопрофильное ведение и соответствующее консультирование помогут в общем ведении женщин с ВП и в снижении материнской заболеваемости.
Ультразвуковая диагностика
УЗИ остается неинвазивным, широко доступным и экономически эффективным методом диагностики первой линии при ВП в клинической практике.
С 1980-х годов были разработаны многочисленные методы ультразвуковой визуализации, чтобы помочь в диагностике ВП антенатально.
Ретроплацентарная сонолюцентная зона
Описывается обычно как чистая зона между плацентой и миометрием. Эта область наблюдается с 12 недель и, как полагают, связана с расширенными сосудами decidua basalis. Недостаточность и прогрессирующая потеря decidua (рис. 1) были предположены и подтверждены гистологически.
Рисунок 1: Недостаточность ретроплацентарной сонолюцентной зоны.
Сосудистые лакуны
Многочисленные венозные структуры, встречающиеся по всему миометрию и плаценте были впервые описаны Керром де Мендонса в 1988 г. Последующие наблюдения за плацентарными лакунами описывали их как крупные и нерегулярные образования (вид «швейцарского сыра»). Эти лакуны не обязательно являются областями патологии. Сообщается, что наличие этого сонографического признака связано с самой высокой положительной прогностической ценностью для ВП (рис. 2). При выявлении во втором и третьем триместрах, чувствительность этого признака составляет 79%, с положительным прогностическим значением 92%.
Рисунок 2: Сосудистые лакуны.
Наличие сонографических критериев не является патогномоничным и должно интерпретироваться с осторожностью в клинических условиях. Хотя установлено, что они обладают высокой чувствительностью и положительной прогностической ценностью, наличие плацентарных лакун и отсутствие сонолюцентной зоны (нередко) наблюдались при предлежании плаценты без врастания.
Истончение миометрия
Прогрессирующее истончение миометрия указывает на близость плацентарной ткани к перитонеальной серозе или окружающим ее внутренностям, в частности к мочевому пузырю. Сегментарное истончение миометрия <1 мм наводит на мысль о врастающей плаценте (рис. 3). В сочетании с наличием крупных плацентарных пробелов чувствительность этого признака достигает почти 100%, а специфичность составляет 72–79%, с положительным прогностическим значением 73%.
Рисунок 3: Миометриальное истончение.
Прерывание линии мочевого пузыря
Недостаток ткани миометрия может привести к истончению или нарушению везикоутериновой линии, что, как было установлено, связано с высокой чувствительностью признака (рис. 4).
Рисунок 4: Нарушение целостности линии мочевого пузыря.
Наличие экзофитных масс
В крайних случаях наличие внематочной плацентарной паренхимы может подтвердить диагноз placenta percreta.
Цветная допплерография
Цветной и энергетический допплер обеспечивают более высокую специфичность в диагностике ВП и, в частности, глубины инвазии. Сообщалось о паттерне турбулентного кровотока, распространяющегося из плаценты в окружающие ткани.
ПРАВИЛЬНО ЛИ ВЫ УХАЖИВАЕТЕ ЗА УЗ-АППАРАТОМ?
Скачайте руководство по уходу прямо сейчас
Скачать PDF
Другие критерии включают очаговый или диффузный внутрипаренхиматозный плацентарный лакунарный кровоток, везикулярную серозную межфазовую гиперваскулярность, выраженный ретроплацентарный венозный комплекс и потерю ретроплацентарных допплеровских сосудистых сигналов.
Магнитно-резонансная томография
УЗИ и МРТ сопоставимы в диагностике ВП. Последнее имеет дополнительное значение в определении глубины инвазии и изображении задней части плаценты.
МРТ часто рекомендуется, когда результаты УЗИ неубедительны. Результаты МРТ, свидетельствующие о ВП включают выпячивание матки, интенсивность гетерогенного сигнала внутри плаценты, темные внутриплацентарные полосы на изображениях, взвешенных по Т2 и прямую визуализацию инвазии плаценты в тазовые структуры.
Рисунок 5: Ультразвуковое исследование с использованием режима допплера, показавшее крупное предлежание плаценты с вовлечением стенки мочевого пузыря.
Примечания: (A) и (B) -Трансвагинальное УЗИ не выявило ткани миометрия между нижней стенкой матки и мочевым пузырем. Также можно увидеть аномальный сосуд, проходящий в стенке мочевого пузыря (белые стрелки). (C) и (D) – Корональные и сагиттальные магнитно-резонансные изображения показали выпуклость на стенке мочевого пузыря (черные стрелки).
Источник
