Мрт матки при врастании плаценты
Плацентарная дисфункция является распространенной акушерской проблемой, которая осложняет 5-10% всех беременностей. Это прогрессирующее состояние, при котором внутриутробное снабжение кислородом и питательными веществами является недостаточным для поддержания нормального роста плода и развития органов. В настоящее время нет эффективных способов улучшения функции плаценты, тем не менее, правильная антенатальная диагностика плацентарной дисфункции приводит к четырехкратному улучшению неонатального исхода, так как это обеспечивает своевременное родоразрешение и тем самым снижает риск необратимого повреждения органов плода. В настоящее время скрининг плацентарной дисфункции фокусируется на оценках веса плода и измерениях допплеровского кровотока плода и пуповины. Тем не менее, размер плода не достаточно точно отражает функцию плаценты, кроме того, при поздней дисфункции плаценты допплер не обнаруживает патологии. Поэтому дополнительные маркеры, которые непосредственно отражают функцию плаценты, могут значительно улучшить диагностику плацентарной дисфункции. В данный момент растет интерес к МРТ плаценты из-за ее способности обнаруживать плацентарную дисфункцию in vivo.
МРТ нормальной плаценты
На МРТ нормальная плацента между 19 и 23 неделями беременности имеет относительно однородную высокую интенсивность сигнала Т2 и относительно низкую интенсивность сигнала Т1. В период между 24 и 31 неделей беременности можно увидеть слабо выраженную дольчатость плаценты и множественные перегородки между долями, что ведет к увеличению гетерогенности с увеличением срока беременности. Нормальный миометрий обычно выглядит трехслойным на T2-взвешенных изображениях, с неоднородно гиперинтенсивным средним слоем и более тонкими слоями с низкой интенсивностью сигнала с обеих сторон. Иногда миометрий появляется в виде одного тонкого слоя с равномерной интенсивностью сигнала в местах сдавления, например, рядом с позвоночником и аортой. Хорошо видна граница между плацентой и околоплодные водами, граница со стенкой матки также достаточно четкая.
Антенатальная МРТ нормальной плаценты показала четкие морфологические изменения во время беременности. В 2006 году была проведена томография женщин на разных сроках беременности по результатам которой исследователи выделили 4 стадии изменений в плаценте по мере увеличения срока. Стадии 0 соответствует правильная, однородная структура плаценты характерная для срока от 19 до 23 недель. С 24 по 31 неделю в плаценте начинают появляться первые изменения в виде слабо выраженной дольчатости, что соответствует стадии 1. Стадия 2 характеризуется увеличением количества и выраженности долек в сроке с 31 по 35 неделю. Плацента в сроке 36 недель и далее имеет ярко выраженную дольчатую структуру и соответствует стадии 3. По мере увеличения срока гестации также наблюдается уменьшение соотношения интенсивности сигнала плаценты/околоплодных вод.
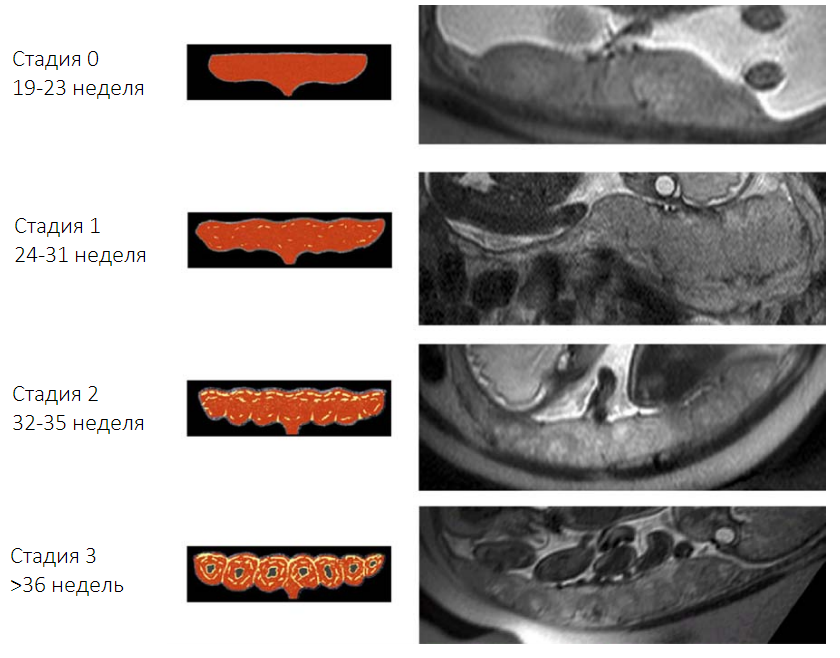
Рисунок 1| Изменение внешнего вида плаценты на МРТ по мере увеличения срока беременности.
МРТ при задержке роста плода
Плацентарная недостаточность наиболее часто приводит к задержке роста плода, когда не достигаются параметры соответствующие сроку гестации. Недостаточное питание плода и гипоксия приводят к повышению риска когнитивных нарушений, церебрального паралича и метаболических нарушений.
Несмотря на то, что у плодов с задержкой внутриутробного развития объем плаценты увеличивается по мере увеличения срока, он остается сниженным относительно нормальных параметров. Внешний вид плаценты характеризуется утолщением и изменением формы ближе к шаровидной, с увеличением отношения толщины плаценты к объему.
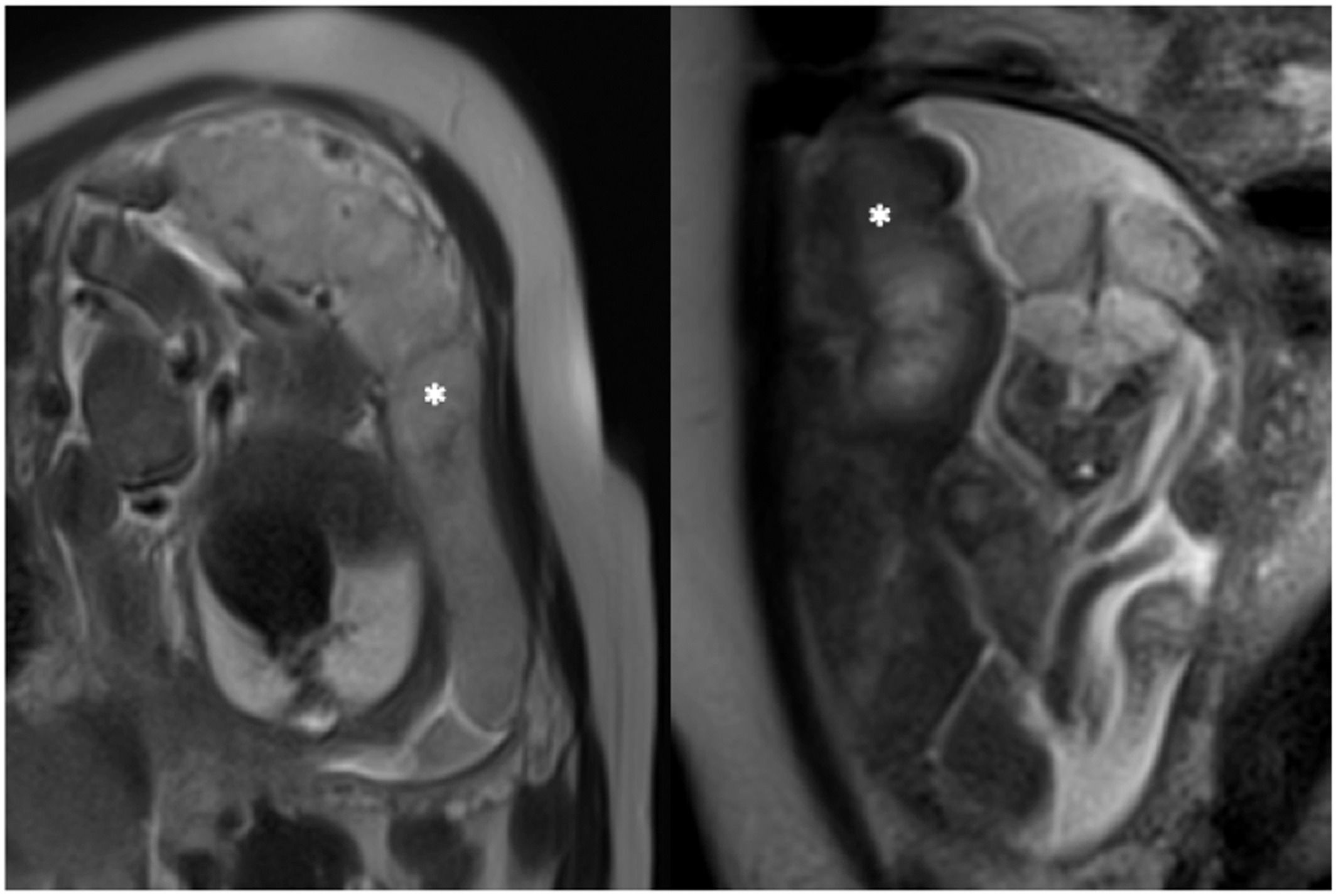
Значение T2 падает при плацентарной недостаточности, что делает плаценту более темной, с большей неоднородностью, возможно, из-за областей инфаркта и фиброза.

Рисунок 2 | МРТ нормальной плаценты (слева) и при задержке роста плода (справа). Плацента отмечена белой звездой. Обратите внимание на разницу во внешнем виде при взвешенной визуализации T2: нормальная плацента выглядит светлее и более однородной.
Диффузионно-взвешенные изображения
Интенсивность сигнала на диффузионно-взвешенном изображении (DWI) отражает диффузионную способность молекул воды исследуемого объекта. На диффузионную способность непосредственно влияет плотность расположения клеток и объем внеклеточного пространства.
Диффузно-взвешенная визуализация имеет потенциальную ценность при обнаружении аномалий плаценты, поскольку задержка внутриутробного роста связана с уменьшением площади поверхности обмена на уровне ворсин, что приводит к меньшей диффузионной проводимости. Среди многих причин ограничения диффузии при беременности наиболее важными являются гематомы и инфаркты плаценты, поскольку они приводят к меньшей диффузионной проводимости и ограниченному кровоснабжению вследствие дегенерации и рубцевания тканей. Таким образом, нарушение зрелости плаценты и очаговое нарушение плацентарного барьера могут привести к измененной диффузии.
В нескольких исследованиях изучающих диффузионно-взвешенные изображения плаценты с ограничением роста было установлено, что значения коэффициента диффузии плаценты значительно ниже в плацентах с задержкой роста плода.
Когда исследование выполняется в хорошо перфузируемых сосудистых тканях, измеренное затухание сигнала при низкой диффузионной сенсибилизации обусловлено не только диффузией свободной воды в ткани, но и микроциркуляцией внутри капиллярной сети. Внутривоксельное некогерентное движение (IVIM) — это традиционный вариант DWI, применяемый к перфузируемым органам. Он может быть использован при оценке капиллярного кровотока без необходимости введения контрастных веществ. При плацентарной недостаточности перфузионная фракция снижается по сравнению с нормальной плацентой.
Хотя до настоящего времени большинство исследований проводилось с целью изучения ограничения роста одного плода, в будущем визуализация перфузии может быть полезна для количественной оценки несоответствия плацентарной перфузии между близнецами и функционального объема плацентарной ткани. Это может помочь определить наилучшее место для лазерной коагуляции при лечении фето-фетального трансфузионного синдрома, гарантируя, что у каждого близнеца достаточно функционирующей ткани, чтобы выжить, или продемонстрировать, что это невозможно.
Релаксометрия
Магнитно-резонансная томография также может использоваться для оценки оксигенации плаценты, поскольку поперечное время релаксации (Т2*) зависит от наличия дезоксигемоглобина. Помимо оксигенации тканей на величину T2* также влияют элементы состава ткани, такие как плотность клеток, содержание воды, количество атомов водорода и площадь поверхности.
В плаценте время релаксации T2 уменьшается с увеличением срока беременности и значительно уменьшается в плаценте при беременности, осложненной задержкой внутриутробного развития, возможно, из-за фиброза, некроза и инфарктов в паренхиме плаценты.
Так как на результаты Т2 релаксометрии влияет уровень насыщения кислородом ткани, (более высокие значения насыщения кислородом приводят к более высоким значениям T2), МРТ может косвенно измерить фетоплацентарную оксигенацию. Насыщение кислородом в фетоплацентарной системе обычно довольно низкое по сравнению со здоровыми взрослыми показателями насыщения кислородом и оказывается значительно ниже у плодов с задержкой развития. Поскольку насыщение кислородом трудно измерить напрямую, а инвазивные методы, такие как кордоцентез, несут в себе риск выкидыша, МРТ релаксометрия обеспечивает неинвазивный способ измерения уровня кислорода в фетоплацентарной системе.
Источники:
- Sørensen A. et al. T2* weighted placental MRI: basic research tool or an emerging clinical test of placental dysfunction? //Ultrasound in Obstetrics & Gynecology. – 2019.
- Aughwane R. et al. Placental MRI and its application to fetal intervention //Prenatal diagnosis. – 2019.
- Fadl S. et al. Placental imaging: normal appearance with review of pathologic findings //Radiographics. – 2017. – Т. 37. – №. 3.
- Gowland P. Placental mri //Seminars in Fetal and Neonatal Medicine. – WB Saunders, 2005. – Т. 10. – №. 5.
- Damodaram M. et al. Placental MRI in intrauterine fetal growth restriction //Placenta. – 2010. – Т. 31. – №. 6.
- Bonel H. M. et al. Diffusion-weighted MR imaging of the placenta in fetuses with placental insufficiency //Radiology. – 2010. – Т. 257. – №. 3.
- Blaicher W. et al. Magnetic resonance imaging of the normal placenta //European journal of radiology. – 2006. – Т. 57. – №. 2.
- Sinding M. et al. Placental magnetic resonance imaging T2* measurements in normal pregnancies and in those complicated by fetal growth restriction //Ultrasound in Obstetrics & Gynecology. – 2016. – Т. 47. – №. 6.
Цель исследования. Оценить диагностическую значимость различных МР-признаков в определении степени инвазии плаценты.
Материалы и методы. В ретроспективное когортное исследование были включены 32 пациентки с морфологически верифицированным диагнозом врастания плаценты. В зависимости от гистологического заключения о степени инвазии все случаи были разделены на три группы: 1 – placenta accreta (n=10), 2 – placenta increta (n=20), 3 – placenta percreta (n=2).
Результаты. Центральное предлежание плаценты в 8,5 раза чаще встречается у пациенток с placenta increta . В то время как для placenta accreta более характерно краевое предлежание (p=0,015). Другие клинико-анамнестические параметры не показали влияния на степень инвазии плаценты. Множественные лакуны в 9 раз чаще преобладали при placenta increta, в то время как при placenta accreta определялось их не более 1–2. Темные полосы – также более характерный признак для более глубокой степени инвазии плаценты (p=0,04).
Заключение. В результате проведенного исследования была показана связь между формой аномалии прикрепления плаценты и степенью ее инвазии. Множественные лакуны и «темные полосы» являются значимыми маркерами на МРТ в диагностике placenta increta.
Одной из наиболее острых акушерских проблем, приобретающих все большую актуальность в последние годы, является патология врастания плаценты. В первую очередь подобная динамика объясняется ятрогенными факторами в отношении родоразрешения беременных в сторону кесарева сечения, а также увеличивающейся частотой внутриматочных вмешательств. Также известно, что пациентки, беременность которых отягощена предлежанием плаценты, имеют гораздо больший риск ее врастания. В зависимости от числа перенесенных кесаревых сечений в анамнезе женщины данный показатель экстенсивно возрастает до 3,3, 11, 40, 61, 67% соответственно числу рубцов на матке после абдоминального родоразрешения [1]. Показана роль и других факторов: зрелый возраст женщины, миома матки, синдром Ашермана [2, 3].
Патогенетический механизм требует ответов еще на многие вопросы, однако известно, что патологическая инвазия плаценты происходит при недостаточно выраженном децидуальном слое. Проникновение через базальный слой слизистой оболочки до миометрия является наиболее сложной для диагностики формой – placenta accreta. Инвазия ворсин в толщу миометрия носит название placenta increta. Наиболее тяжелым, и вместе с этим, более редким вариантом является placenta percreta, при которой происходит прободение серозной оболочки и даже соседних интактных органов малого таза.
Врастание плаценты представляет крайне тяжелое состояние, особенно при несвоевременной диагностике, объясняющееся угрозой массивного кровотечения в третьем периоде родов и в послеродовом периоде, приводящего к диссеминированному внутрисосудистому свертыванию и развитию полиорганной недостаточности. По мере роста ворсин закономерно увеличивается объем кровопотери за счет вовлечения большого числа сосудов с бассейна различных артерий [4]. В дополнение, в ряде случаев в патологический процесс оказываются вовлечены соседние органы, что в значительной мере меняет хирургический план, поэтому чрезвычайно важно антенатальное определение степени врастания плаценты.
Одним из наиболее распространенных и широко доступных методов является ультразвуковое исследование (УЗИ) [5]. Однако в последнее время интерес исследователей и клиницистов обращен в сторону магнитно-резонансной томографии (МРТ). Работы последних лет не показали какой-либо значимой разницы в прогностической ценности обоих методов [6, 7]. Тем не менее, в тех ситуациях, когда рутинного УЗИ оказывается недостаточно (при расположении плаценты по задней или боковым стенкам матки, placenta percreta, вовлеченность соседних органов) роль МРТ приобретает особый диагностический статус [7]. Благодаря многочисленным исследовательским работам удалось выявить наиболее значимые критерии в определении врастания плаценты. Валидными показали себя маркеры, позволяющие определить плацентарную ткань в толще миометрия или кнаружи от него, а также истончение или прерывность мышечного слоя матки, вплоть до отсутствия четкой границы между стенкой матки и мочевым пузырем при патологии в нижнем маточном сегменте, приводящей к его выбуханию. Позднее все большее внимание приобретали критерии, ассоциированные с патологией сосудистого компонента плацентарно-маточного комплекса: нерегулярные внутриплацентарные полосы, или «ленты», со сниженной на Т2-взвешенных изображениях (Т2ВИ) интенсивностью МР-сигнала, выраженная плацентарная гетерогенность, а также лакуны, которые представляют собой сосуды диаметром 6 и более миллиметров [4, 8–11]. Один из мировых лидеров освещаемой темы, J.M. Palacios-Jaraquemada выделил специфическое патологическое состояние – шеечно-треугольниковую гиперплазию, визуализируемую только посредством МРТ [10]. Ее генез автор объясняет усилением кровотока по бассейнам влагалищно-маточных анастомозов, отходящих от внутренней половой артерии между треугольником Льето мочевого пузыря и шейкой матки.
В настоящем исследовании проведена ретроспективная оценка различных МР-признаков в определении морфологических вариантов врастания плаценты по единому протоколу обследования у пациенток с верифицированным гистологическим диагнозом. Данные диагностические критерии были оценены на предмет специфичности в определении глубины инвазии плаценты, что и определило цель настоящей работы.
Цель исследования: оценить диагностическую значимость различных МР-признаков (плацентарная гетерогенность, усиление сосудистого рисунка, наличие ретроплацентарной «тени», лакун и «темных лент», выбухание стенки матки, истонч…
1. Silver R.M., Landon M.B., Rouse D.J., Leveno K.J., Spong C.Y., Thom E.A. et al. Maternal morbidity associated with multiple repeat cesarean deliveries. Obstet. Gynecol. 2006; 107(6): 1226-32.
2. Wu S., Kochergnisky M., Hibbard J.U. Abnormal placentation: twenty-year analysis. Am. J. Obstet. Gynecol. 2005; 192(5): 1458-61.
3. Al-Serehi A., Mhoyan A., Brown M., Benirschke K., Hull A., Pretorius D.H. Placenta accreta:an association with fibroids and Asherman syndrome. J. Ultrasound Med. 2008; 27(11): 1623-8.
4. Lax A., Prince M.R., Mennitt K.W., Schwebach J.R., Budorick N.E. The value of specific MRI features inthe evaluation of suspected placental invasion. Magn. Reson. Imaging. 2007; 25(1): 87-93.
5. Бойкова Ю.В., Илиева Э.А., Кан Н.Е., Кулабухова Е.А., Гус А.И. Возможности эхографии в выявлении патологической инвазии трофобласта. Акушерство и гинекология. 2016; 12: 82-6. https://dx.doi.org/10.18565/aig.2016.12.82-86
6. D’Antonio F., Iacovella C., Palacios-Jaraquemada J., Bruno C.H., Manzoli L., Bhide A. Prenatal identification of invasive placentation using magnetic resonance imaging: systematic review and meta-analysis. Ultrasound Obstet. Gynecol. 2014; 44(1): 8-16.
7. Budorick N.E., Figueroa R., Vizcarra M., Shin J. Another look at ultrasound and magnetic resonance imaging for diagnosis of placenta accreta. J. Matern. Fetal Neonatal Med. 2017; 30(20): 2422-7.
8. Lim P.S., Greenberg M., Edelson M.I., Bell K.A., Edmonds P.R., Mackey A.M. Utility of ultrasound and MRI in prenatal diagnosis of placenta accreta: a pilot study. AJR Am. J. Roentgenol. 2011; 197(6): 1506-13.
9. Derman A.Y., Nikac V., Haberman S., Zelenko N., Ophsa O., Flyer M. MRI of placenta accreta: a new imaging perspective. AJR Am. J. Roentgenol. 2011; 197(6): 1514-21.
10. Palacios-Jaraquemada J.M., Bruno C.H., Martín E. MRI in the diagnosis and surgical management of abnormal placentation.. MRI in the diagnosis and surgical management of abnormal placentation. Acta Obstet. Gynecol. Scand. 2013; 92(4): 392-7.
11. Manjiri Dighe. MR imaging of abnormal placentation. Magn. Reson. Imaging Clin. N. Am. 2017; 25(3): 601-10.
12. Palacios-Jaraquemada M., Bruno C. Gadolinium-enhanced MR imaging in the differential diagnosis of placenta accreta and placenta percreta. Radiology. 2000; 216(2): 610-1.
13. Millischer A.E., Deloison B., Silvera S., Ville Y., Boddaert N., Balvay D. et al. Dynamic contrast enhanced MRI of the placenta: A tool for prenatal diagnosis of placenta accreta? Placenta. 2017; 53: 40-7.
14. Jauniaux E., Collins S., Burton G.J. Placenta accreta spectrum: pathophysiology and evidence-based anatomy for prenatal ultrasound imaging. Am. J. Obstet. Gynecol. 2017; Jun 24. pii: S0002-9378(17)30731-7.
15. Baughman W.C., Corteville J.E., Shah R.R. Placenta accreta: spectrum of US and MR imaging findings. Radiographics. 2008; 28(7): 1905-16.
16. Breen J.L., Neubecker R., Gregori C.A., Franklin J.E. Jr. Placenta accreta, increta, and percreta: a survey of 40 cases. Obstet. Gynecol. 1977; 49(1): 43-7.
17. Cramer S.F., Heller D. Placenta accreta and placenta increta: an approach to pathogenesis based on the trophoblastic differentiation pathway. Pediatr. Dev. Pathol. 2016; 19(4): 320-33.
18. Thia E.W., Lee S.L., Tan H.K. Tan L.K. Ultrasonographical features of morbidly-adherent placentas. Singapore Med. J. 2007; 48(9): 799-802.
19. Maldjian C., Adam R., Pelosi M., Pelosi M., Rudelli R.D., Maldjian J. MRI appearance of placenta percreta and placenta accreta. Magn. Reson. Imaging. 1999; 17(7): 965-71.
20. Chen X., Shan R., Zhao L., Song Q., Zuo C., Zhang X. et al. Invasive placenta previa: Placental bulge with distorted uterine outline and uterine serosal hypervascularity at 1.5T MRI – useful features for differentiating placenta percreta from placenta accreta. Eur. Radiol. 2017; Aug 2.
21. Teo T.H., Law Y.M., Tay K.H., Tan B.S., Cheah F.K. Use of magnetic resonance imaging in evaluation placental invasion. Clin. Radiol. 2009; 64: 511-6.
Поступила 12.10.2017
Принята в печать 27.10.2017
Виницкий Александр Анатольевич, аспирант родильного отделения ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (925) 362-02-32. E-mail: drvinitskiy@gmail.com
Кулабухова Елена Анатольевна, к.м.н., врач-рентгенолог отделения лучевой диагностики ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-76-47. E-mail: mri-Elena@yandex.ru
Быченко Владимир Геннадьевич, к.м.н., зав. отделением лучевой диагностики ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-76-47. E-mail: v_bychenko@oparina4.ru
Шмаков Роман Георгиевич, д.м.н., главный врач ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-73-00. E-mail: r_shmakov@oparina4.ru
Ежова Лариса Сергеевна, к.м.н., старший научный сотрудник патологоанатомического отделения ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-28-92. E-mail: l_ezhova@oparina4.ru
Учеваткина Полина Владимировна, врач-рентгенолог отделения лучевой диагностики ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-76-47. E-mail: kulpova@mail.ru
Пирогова Мария Михайловна, аспирант ФГБУ НМИЦАГП им. В.И. Кулакова Минздрава России.
Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (916) 094-45-69. E-mail: pirogovamariya@gmail.com.
Для цитирования: Виницкий А.А., Кулабухова Е.А., Быченко В.Г., Шмаков Р.Г., Ежова Л.С., Учеваткина П.В, Пирогова М.М. Прогностическая значимость МРТ в диагностике различных форм врастания плаценты. Акушерство и гинекология. 2018; 1: 41-7.
https://dx.doi.org/10.18565/aig.2018.1.41-47
Приращение плаценты — это аномалия врастания хориальных ворсин с инвазией трофобласта в базальную отпадающую оболочку, миометрий, периметрий, окружающие органы. Проявляется отсутствием признаков отделения плаценты, профузным маточным кровотечением в последовом периоде, симптомами вовлечения смежных органов (тазовыми болями, примесью крови в кале и моче, запорами и др.). Для диагностики применяют УЗИ тазовых органов, ЦДК, МРТ-пельвиометрию, определение уровня АФП. Лечение предполагает проведение ручного отделения плаценты, надвлагалищной ампутации матки, гистерэктомии, метропластики, донного варианта кесарева сечения.
Общие сведения
Приращение плаценты было впервые описано в 1836 году английским гинекологом Джеймсом Симпсоном, морфологическую основу расстройства в 1889 году определил немецкий патолог Фредерик Харт. За последние 50 лет отмечается более чем десятикратное увеличение частоты патологии – с 1: 30 000 беременных в 1950-60-х годах до 1:2 500 в 2007 году, что напрямую связано со стремительным ростом числа кесаревых сечений. Зачастую патологическая глубокая инвазия хориона сочетается с предлежанием плаценты. По данным исследований, после первого оперативного родоразрешения риск приращения плацентарной ткани при ее предлежании повышается на 10%, а после 4-5-го — на 60% и более.
Приращение плаценты
Причины
Патологическому врастанию ворсин хориона в маточные оболочки способствуют как локальные дистрофические изменения эндометрия, так и нарушения бластогенеза. Риск развития расстройства повышается по мере увеличения возраста женщины и количества выношенных ею беременностей. По мнению большинства специалистов в сфере акушерства, основными причинами приращения тканей плаценты являются:
- Рубцовые изменения маточной стенки. Предпосылками к возникновению локальной дистрофии эндометрия становятся рубцы после перенесенных оперативных вмешательств, инвазивных манипуляций — кесарева сечения, миомэктомии, аборта, диагностического выскабливания. Дистрофические изменения провоцируются нарушениями процессов кровообращения и рубцовым перерождением эпителия.
- Заболевания матки. Нормальная архитектоника эпителиальной оболочки может нарушаться при неспецифическом и специфическом эндометрите, вызванном возбудителями хламидиоза, гонореи, туберкулеза, других инфекционных заболеваний половых органов. Приращение часто наблюдается при синдроме Ашермана, деформации маточной полости одной крупной или множественными подслизистыми миомами.
- Высокая протеолитическая активность хориона. В части случаев аномалии бластогенеза проявляются не нарушениями гаметогенеза и формированием пороков развития плода, а повышенной инвазивной способностью хориона. Более глубокая имплантация наблюдается при нарушении ферментативного равновесия в системе гиалуронидаза – гиалуроновая кислота между бластоцистой и децидуальной оболочкой.
Дополнительными факторами риска, способствующими аномальному врастанию хориальных ворсин, являются низкое расположение или предлежание плаценты, многоплодие, переношенная беременность, аномалии развития (двурогая матка, наличие внутриматочной перегородки). Патологию чаще выявляют у пациенток, страдающих хроническим гломерулонефритом, тяжелыми формами гестозов, при которых отмечаются микроциркуляторные нарушения в различных органах, в том числе в эндометрии и миометрии.
Патогенез
Механизм приращения плаценты основан на несоответствии проникающей способности трофобласта толщине и строению децидуальной оболочки. Недостаточная толщина эндометрия может быть обусловлена физиологической гипотрофией (функциональный слой слизистой обычно более тонкий в нижнем маточном сегменте) и патологическими процессами. Ситуация усугубляется при повышении протеолитической активности ферментов, способствующих внедрению бластоцисты в стенку матки. При наличии посттравматических, воспалительных, дистрофических изменений наблюдается рубцовое перерождение губчатого слоя отпадающей оболочки плаценты, по которому происходит ее отторжение в третьем периоде родов. При врастании в уплотненную ткань плацентарных ворсин становится невозможным их самопроизвольное отделение от стенки матки.
Значительное истончение эпителия сопровождается частичным или полным отсутствием губчатого слоя. В результате хориальные ворсины отделены от миометрия скоплениями фибриноида, а в более тяжелых случаях непосредственно контактируют с мышечными волокнами и даже прорастают в них на различную глубину. Плацентарные септы частично формируются из миоцитов, происходит обильная васкуляризация миометрия, подлежащего под плацентарной площадкой. После родов кавернозно измененная мышечная ткань не может сокращаться под влиянием окситоцина, что приводит к развитию массивного маточного кровотечения.
Классификация
Критериями для систематизации основных вариантов приращения плаценты служат площадь аномального прикрепления плацентарной ткани, глубина ее врастания в матку. Такой подход обеспечивает более точное прогнозирование осложнений и выбор оптимальной врачебной тактики. Приращение бывает полным с вовлечением в процесс всей плаценты и частичным с наличием участков нормальной и патологической плацентации. В зависимости от глубины проникновения в оболочки матки выделяют следующие виды расстройства:
- Ложное приращение (placenta adhaerens). Имеет более благоприятный прогноз в плане сохранения матки. Встречается значительно чаще, чем истинное. Возникает при рубцовом перерождении губчатого слоя. Хориальные ворсины плотно врастают в децидуальную оболочку и достигают базальной мембраны, однако не проникают до миометрия. Плацента самостоятельно не отделяется, использование специальных приемов ручного разделения плацентарной ткани и матки позволяет обойтись без полостной операции.
- Истинное приращение. Развивается на фоне атрофии губчатого слоя, проявляется проникновением ворсин хориона до мышечных волокон (приращенная плацента), в миометрий (вросшая плацента) и за пределы матки (проросшая плацента). Ручное отделение плаценты невозможно. Зачастую единственным методом, позволяющим сохранить жизнь родильницы, становится хирургическое удаление матки. Частота приращенной плаценты составляет около 78% всех случаев истинного приращения, вросшей — 15%, проросшей — 7%.
Симптомы приращения плаценты
Клинические признаки расстройства во время беременности отсутствуют. Патология проявляется в родах отсутствием внешних признаков отделения детского места в течение получаса после изгнания ребенка: маточное дно не поднимается выше пупка, не наблюдается выпячивание плаценты над симфизом, оставшийся конец пуповины не удлиняется, втягивается после натуживания женщины и укорачивается при надавливании на живот. При полном ложном и истинном приращении послеродовое кровотечение не возникает, при частичном приращении и попытке отделить приросший послед вручную начинается профузное маточное кровотечение. О прорастании плаценты в брюшину и другие органы свидетельствуют тазовые боли различной интенсивности, затруднения дефекации, примесь крови в моче или кале.
Осложнения
При нарушении бластогенеза приращение плаценты может сочетаться с пороками развития плода, хотя и не служит их непосредственной причиной. В дородовом периоде у женщин с нарушением плацентации чаще возникает фетоплацентарная недостаточность, гипоксия плода с задержкой его развития, преждевременное старение плаценты. В родах приращение плацентарной ткани осложняется маточным кровотечением, которое без оказания экстренной помощи способно привести к значительной кровопотере, возникновению геморрагического шока, смерти женщины. В редких случаях у родильниц развивается воздушная эмболия, респираторный дистресс-синдром, ДВС-синдром.
Диагностика
Для своевременного выявления патологии скрининговое обследование проводится всем беременным из группы риска — многократно рожавшим, женщинам с аномалиями матки, низко расположенной или предлежащей плацентой, пациенткам, ранее перенесшим кесарево сечение, миомэктомию, повторные аборты. Наиболее информативными являются методы ультразвуковой диагностики приращения плаценты:
- Эхография. Признаками возможного аномального крепления плацентарной ткани по данным УЗИ матки и плода считаются уменьшение расстояния между ретроплацентарными сосудами и периметрием до 10 мм и менее, наличие в толще плаценты кист, гиперэхогенных включений. Вероятность приращения повышается при обнаружении гипо- и анэхогенных участков с кровотоком лакунарного типа в мышечной стенке матки.
- Цветовое допплеровское картирование (ЦДК). Метод считается золотым стандартом в пренатальной диагностике приращения. В ходе исследования точно определяется локализация аномальных сосудистых зон. Патогномоничным признаком расстройства является расширение субплацентарного венозного комплекса. ЦДК также обеспечивает точную оценку глубины проникновения хориальных ворсин в миометрий.
В последние годы с диагностической целью акушеры-гинекологи все чаще назначают МРТ-пельвиометрию, позволяющую в сомнительных случаях достоверно визуализировать неровности маточной стенки, патологическую неоднородность структуры миометрия и плацентарной ткани. Косвенным лабораторным признаком расстройства служит повышение уровня альфа-фетопротеина.
При выявлении патологии в родах важно быстро выполнить дифференциальную диагностику между ложным и истинным приращением при помощи ручного отделения последа. При плотном прикреплении плацентарную ткань удается отделить полностью и, таким образом, купировать профузное кровотечение. Об истинном приращении свидетельствует невозможность отделения плаценты единым массивом, разрывы тканей, отсутствие отдельных долек, оставшихся в матке. Заболевание дифференцируют с другими расстройствами, сопровождающимися массивными маточными кровотечениями: маточной гипотонией, ДВС-синдромом, коагулопатиями, беременностью с нормально прикрепленной плацентой в трубном углу удвоенной или двурогой матки и др. По показаниям пациентку консультирует уролог, проктолог, хирург, анестезиолог-реаниматолог.
Лечение приращения плаценты
Выявление патологии служит показанием для проведения хирургического вмешательства. При антенатальной диагностике приращения естественные роды противопоказаны, операция выполняется в плановом порядке на 37-39 неделях гестационного срока одновременно с кесаревым сечением, при обнаружении в родах — экстренно по жизненным показаниям. Рекомендованный объем вмешательства определяется типом приращения плаценты:
- Ручное отделение с выделением последа. Акушерское пособие для извлечения неотделившейся плаценты с плодными оболочками проводят под внутривенной анестезией при ложном приращении. В ходе вмешательства акушер отделяет и удаляет плотно прикрепленную плацентарную ткань вручную.
- Удаление матки. При проникновении ворсин хориона к миометрию или их врастании в гладкомышечные волокна традиционно осуществляется надвлагалищная ампутация или гистерэктомия. Несмотря на травматичность, до недавнего времени такие операции были единственным способом остановить кровотечение.
- Органосохраняющие вмешательства. Антенатальная диагностика с последующим проведением донного кесарева сечения или метропластики позволяет сохранить матку даже при истинном приращении. Подобные операции в России пока производят редко, однако накоплен положительный опыт их выполнения за рубежом.
При прорастании маточной стенки рекомендованы комбинированные урогинекологические и проктогинекологические вмешательства, направленные на полное удаление плацентарной ткани. Часто щадящие хирургические методы дополняют эндоваскулярными для профилактики или остановки маточного кровотечения (эмболизацией маточных артерий, временной баллонной окклюзией). При экстренной операции родильнице показано восстановление объема циркулирующей крови с проведением инфузионной терапии (переливания цельной крови, ее компонентов, коллоидных и кристаллоидных растворов). Симптоматическое лечение включает назначение утеротоников (при сохранении матки), гемостатиков, препаратов для поддержания давления и сердечной деятельности.
Прогноз и профилактика
Благоприятный исход приращения плаценты возможен только при своевременной диагностике и выборе оптимального способа лечения. Для улучшения прогноза используют антенатальный скрининг и плановое хирургическое родоразрешение с выполнением операции рекомендованного объема. Первичная профилактика предполагает отказ от необоснованных диагностических и лечебных внутриматочных вмешательств, планирование беременности, лечение воспалительных заболеваний матки, проведение кесарева сечения строго при наличии акушерских или экстрагенитальных показаний.
