Мукозальные заболевания и иммунитет
Автор: ООО «Замбон Фарма»
Статья без опроса для врачейМатериал посетили: 587Добавлена: 27.01.2020
Тизер: Обсудим защитную функцию слизистых оболочек и понятие мукозального иммунитета. Также озвучим факторы, которые ухудшают качество местной иммунной защиты, и возможности подстраховать ребёнка от сбоев в мукозальном иммунитете в период эпидемии ОРВИ.
Мукозальный иммунитет респираторного тракта: его особенности и роль в защите от ОРВИ
Слизистые оболочки многих систем организма, в особенности дыхательной и пищеварительной, постоянно подвергаются воздействию патогенных микробов, аллергенов и химических соединений. Поэтому в процессе эволюции в них сформировалась мощная система иммунной защиты. Все её механизмы реализуются через так называемую «мукозоассоциированную лимфоидную ткань» (МАЛТ). Это самая большая часть иммунной системы общей площадью 400 м2. Именно в ней располагается около 50% иммунокомпетентных клеток. Там присутствуют как клетки врожденного, так и приобретённого иммунитета. Кроме клеток в МАЛТ есть и другие механизмы защиты, которые различаются в зависимости от системы органов (1).
Структура и особенности мукозального иммунитета респираторного тракта у детей
Местный иммунитет слизистых оболочек начинает формироваться у ребёнка ещё до рождения. Однако после родов процесс не заканчивается: развитие и формирование мукозального иммунитета у детей младшего возраста продолжается. Незрелость систем мукозальной части иммунной системы может стать причиной её дисфункции у маленьких пациентов. Последствиями такой дисфункции, по данным исследователей, бывают как частые заболевания респираторными инфекциями, так и проявления аллергии (1,2,3).
Мукозальный иммунитет дыхательных путей представляет собой сложную многоуровневую систему защиты:
- Верхний уровень – «инертный» барьер – это слой слизи, который формирует физическое препятствие для проникновения микроорганизмов. Другие защитные факторы, действующие на этом уровне, — противомикробные пептиды, секреторный IgA, компоненты системы комплемента и микробиота. Уже на этом уровне начинает происходить частичное разрушение чужеродных микроорганизмов.
- Эпителиальные клетки – не только создают ещё один барьер, но и отвечают за формирование рецепторов, которые запускают выработку противомикробных пептидов при взаимодействии с чужеродными микроорганизмами.
- Собственная пластинка (lamina propria). В собственной пластинке находятся «изолированные лимфоидные фолликулы», тесно связанные с регионарными лимфатическими образованиями: пейеровыми бляшками, миндалинами и т. д., которые позволяют перевести иммунный ответ с местного уровня на системный (1).
Слизистая дыхательных путей вынуждена постоянно сталкиваться с инфекционными и неинфекционными аллергенами, биотоксинами, воздействиями химических и физических факторов из вдыхаемого воздуха. Учитывая объём вдыхаемого воздуха, который у человека составляет 7-12 л/ минуту, нагрузка на местный мукозальный иммунитет очень велика. Поэтому механизм иммунной защиты слизистой может давать сбои – развивается дисфункция мукозального иммунитета, результатом которой может быть заражение ОРВИ или развитие хронического заболевания, например, астмы (2).
Что может ухудшить работу мукозального иммунитета
- Патологические состояния, связанные с наличием хронического рецидивирующего воспалительного процесса (например, по данным исследований, при хроническим полипозном риносинусите выявляется дисфункция мукозального иммунитета) (2).
- Стрессы
- Сверхвысокие физические нагрузки
- Химические воздействия на дыхательные пути
- Воздействие радиации и др. (2)
- Проживание в экологически неблагоприятных регионах (например, наличие вредных производств по соседству)
- Отклонения в иммунологическом и аллергическом статусе (2).
Столкнуться с факторами, способными ухудшить качество работы мукозального иммунитета дыхательных путей, может практически каждый ребёнок, особенно живущий в городских условиях и посещающий организованные коллективы. Поэтому идея усиления мукозального иммунитета остаётся актуальной, тем более в сезон эпидемий гриппа и ОРВИ (1,2). Барьерный назальный спрей может стать средством, подходящим различным категориям маленьких пациентов, благодаря своей натуральности, безопасности и способности усиливать природную защиту слизистых оболочек дыхательных путей (3).
Барьерный спрей как средство усиления мукозального иммунитета
Назальный спрей Назаваль плюс создан на основе натуральной микронизированной целлюлозы. При впрыскивании в носовые ходы взвесь частиц спрея равномерно распределяется по поверхности слизистых оболочек верхних дыхательных путей и превращается в гелеобразную плёнку. Плёнка формирует ещё одно физическое препятствие на пути проникновения в организм патогенных микробных агентов (4,5,6). Таким образом, применение спрея Назаваль плюс может дополнительно «усилить» первый (инертный) слой многоуровневой защиты респираторного тракта.
Эффективность барьерной функции микронизированной целлюлозы научно подтверждена. В одном из исследований проводилось сравнение абсорбирующих свойств агарного геля и геля на основе порошка целлюлозы. Через 360 минут экспозиции агарный гель пропустил через себя 100% потенциально вредного антигена, в то время как средство на основе целлюлозы пропустило не более 14% того же антигена (6).
В состав Назаваль плюс входит также экстракт дикого чеснока, который обогащает созданную защитную плёнку фитонцидами. Эти вещества способны подавлять увеличение численности микроорганизмов и нарушать их жизнедеятельность. В результате первый уровень защиты слизистых оболочек усиливается не только механически, но и химически (4,6).
При этом все компоненты Назаваль плюс не всасываются в кровь и не вызывают системных побочных эффектов. Также есть данные, что применение микронизированной целлюлозы не мешает слизистым оболочкам реализовать другие функции – не ухудшается мукоцилиарный клиренс и сохраняется свободный ток воздуха по дыхательным путям (4,5,6).
Таким образом, мукозальный иммунитет – это эффективная защита организма от чужеродных агентов (бактерий и вирусов). Однако из-за сложности и разнообразия механизмов данный вид иммунной защиты может нарушаться под влиянием внешних факторов. Усиление внешнего слоя мукозального иммунитета у детей с помощью барьерного спрея представляется безопасным и эффективным элементом профилактики ОРВИ в эпидемический сезон, в том числе и у детей с атопией и бронхиальной астмой, склонных к тяжёлому протеканию респираторных инфекций и развитию осложнений.
- Козлов И.Г. Микробиота, мукозальный иммунитет и антибиотики: тонкости взаимодействия. Регулярные выпуски «РМЖ». 2018. №8(I):19-27
- Хаитов М.Р., Ильина Н.И., Лусс Л.В., Бабахин А.А. Мукозальный иммунитет респираторного тракта и его роль при профессиональных патологиях // Медицина экстремальных ситуаций. 2017. №3 (61).
- Szczawinska-Poplonyk A. Development of mucosal immunity in children: a rationale for sublingual immunotherapy?. J Allergy (Cairo). 2012;2012:492761. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3205711/
- Ерофеева М.К., Максакова В.Л., Шелехова С.Е., Позднякова М.Г. Возможность применения препарата Назаваль Плюс для профилактики острых респираторных заболеваний у детей. Инфекция и иммунитет. 2012. №1-2.
- Отчет о научно-исследовательской работе по теме: «Оценка эффективности применения медицинского изделия «Назаваль Плюс» с целью профилактики гриппа и других острых респираторных заболеваний»/ Ерофеева М.К., Максакова В.Л., Позднякова М.Г. и др. /Санкт-Петербург, 2011.
- Ненашева Н.М. Эффективная защита слизистой носа против аллергенов и вирусов. Астма и аллергия. 2013. (1):9-15. Доступно по ссылке: https://cyberleninka.ru/article/n/effektivnaya-zaschita-slizistoy-nosa-protiv-allergenov-i-virusov.
Барьерный (мукозальный) иммунитет
Иммунитет такая штука (на этом, как правило, точные знания о нём заканчиваются), которую все хотят поднять, так как считают, что опустится эта штука сама. Где тонко, там и рвётся!
Что это:
Микробиота – «общага» для живых бактерий, грибов и вирусов, обитающих в кишечном тракте, во всём их генетическом разнообразии (в 150 раз больше по сравнениию с геномом человека).
Антибиотики – противобактериальные препараты, но кто у нас различает бактерию и вирус? Например, из всех бронхитов максимум 15% имеют бактериальную природу, но при таком диагнозе антибиотики, как правило, назначают всем. Доводы: а вдруг чё там? Лишним не будет! Я не назначу, другой врач назначит, а я как дурак… В прошлый раз ведь помогло!
Что такое мукозальный иммунитет?
Мукозой называют внутреннюю оболочку полых органов, сообщающихся с внешней средой (желудок, кишечник, мочевой пузырь, влагалище и пр.). Её функция – защита от проникновения внешних «врагов» с помощью физического барьера, противомикробных (воспалительных) белков и иммунных ответов. Вся иммунная борьба в барьерных тканях (если прибавить сюда кожу) и будет называться мукозальный (барьерный) иммунитет.
Основные симптомы, которые появляются в начале заболевания (насморк, кашель, боль в горле, изжога, диарея, воспаление кожных покровов) и есть «бои на границе», в барьерных тканях.
В чем суть:
Каковы взаимоотношения этих «трёх поросят» – микробиоты (микрофлоры), барьерного (мукозального) иммунитета и антибиотиков?
Иммунитет слизистых реализуется через единую систему, название которой – mucosa-associated lymphoid tissue – MALT, ещё есть SALT – skin…кожа (дерма). Это половина всей иммунной системы, где на площади 400 кв.м (4 сотки) расположены 50% иммунных клеток. То есть половина всех «защитников родины» находится в приграничной зоне.
Ранее считалось, что эпидермис является непроницаемым физическим барьером, но сейчас выяснилось, что в коже и слизистых существуют специальные клетки (дендритные и М-клетки), функцией которых является контролируемый трафик чужеродных агентов через биологический барьер (кожа, слизистая). Своего рода разведчики берут «языка», переводят его через «линию фронта», выведывают его «буржуинские» тайны и обучают этим хитростям новобранцев (свежие иммунные клетки, они так и называются – наивные лимфоциты).
Кроме того, клетки кожи и слизистых включают рецепторы, которые запускают контролируемую воспалительную (атомную) реакцию с выделением цитокинов (пептиды; их 3 типа – противо- и провоспалительные, и регуляторы иммунитета). Таким образом, иммунная система барьерных тканей всё время находится в состоянии «тлеющей» активации, что позволяет при проникновении патогена давать быстрый иммунный ответ «обученными бойцами». Обучение-то они, конечно, прошли, но метко стрелять ещё не умеют – это называется адаптивный иммунитет.
Как это работает?
Его представительством в тканях (подэпителиальная, подслизистая рыхлая ткань) являются изолированные лимфоидные фолликулы, в которых находятся «бойцы», в том числе В-лимфоциты, продуцирующие IgA. Эта система «местного» иммунитета связана региональными лимфоузлами, миндалинами, пейеровыми бляшками, аппендиксом и переводит иммунный ответ с местного уровня на системный (федеральный), что позволяет вводить в действие высокоспецифические антитела (высокоточное оружие) на конкретный патоген– это называется приобретенный иммунитет. Так работают прививки и вакцины на конкретное заболевание.
Как организм новорожденного распознает, что можно «всосать», а что надо «выплюнуть»? Один из путей идет через недавно открытые сигнальные рецепторы врожденного иммунитета (signal pattern recognizing receptor – SPRR). Каждый патоген имеет «отличительный знак», так называемый патоген-ассоцированный молекулярный образ (patogen-associated molecular patterns – PAMP). Обычно это бактериальный липополисахарид или ДНК, двуспиральная РНК, глюканы грибков и другие названия подобных «образов», которые запомнить невозможно. Клетки распознают «чужаков» по этим знакам и начинают «мочить их в сортире» с помощью фагоцитоза (поглощения), продукцией активных форм кислорода, усиливая экспрессию генами провоспалительных пептидов (цитокинов). Такая реакция во многом паническая, неумелая, но на первоначальном этапе приводит к задержке «противника» на границе – это называется врождённый иммунитет.
А с какого бока-припёка здесь микрофлора? Дело в том, что внутрикишечная флора имеет «договор» с нашим организмом – мы сдаём ей в аренду площади (слизистые, кожа), взамен она помогает переваривать пищу, продуцирует витамины, а главное – защищает от патогенных микроорганизмов. Микрофлора образует биопленку на поверхности слизи, которая, как пограничный контроль, проверяет паспорта – гражданин ли ты данной страны. Кроме того, поддерживает адаптивный иммунитет в «тлеющем» состоянии (а наш бронепоезд на запасном пути), сохраняя золотую середину между иммуноагрессией/супрессией через сигнальные рецепторы врожденного иммунитета.
Как влияют антибиотики на иммунный ответ?
На экспериментальных животных и у человека в клинике многократно подтверждено, что антибиотики приводят к изменению микробиоты. Например, клиндамицин в виде 7-дневного курса почти на 2 года меняет у человека видовой состав бактерий рода Bacteroides. 5-дневный курс ципрофлоксацина приводит к изменению микробиоты у человека почти на 30%. Для частичного восстановления микробиоты после курса ципрофлоксацина требуется около месяца.
Кроме того, антибиотики «мочат» всех без разбора, и часть погибшей микрофлоры замещается патогенами – например, грибками (привет, молочница). На уровне эпителия наблюдаются снижение продукции слизи и истончение «пассивного» барьера. Одновременно уменьшается секреция противомикробных пептидов, то есть «пограничная полоса» становится уже и перебежать её легче. Рецепторы SPRR, видя такой «балаган», реагируют бурным выбросом провоспалительных агентов, а золотой (защитной) середины уже нет, и данное воспаление распространяется системно по организму, и если кто-то хоть как-то похож на «врага», по нему наносится удар (аутоимунная реакция), что может провоцировать развитие язвенного колита, болезни Крона, ревматоидного артрита, васкулитов, нейродермита и т.д.
Как помочь?
- трансплантация фекальной микробиоты (ТФМ) Промышленное масштабирование ТФМ является весьма проблематичным, и процедура сегодня используется (и, очевидно, будет использоваться) как крайняя мера, когда невозможно уничтожить патоген другими способами – например, в случае антибиотикорезистентных штаммов. В настоящее время эффективность ТФМ (80–100%) была продемонстрирована в случае инфицирования Clostridium difficile в качестве меры борьбы с псевдомембранозным колитом.
- использование пробиотиков, добавляя, что ни один из пробиотиков не может полностью воспроизвести состав нормофлоры, а значит, не способен восстановить нормальный баланс кишечной микробиоты.
- использовать минимальные биологически активные фрагменты (МБАФ) – это фрагменты патогенных микробов, а также нормофлоры, на которые реагируют рецепторы врожденного иммунитета (SPRR), стимулируя барьерный (адаптивный) иммунитет.
Что с этим делать и на что обратить внимание:
– главный вывод этой статьи: НЕФИГ назначать антибиотики направо и налево. Например, в Голландии назначить антибиотик, особенно ребёнку, целая история. Тем не менее одна из самых здоровых (и длинных) наций в Европе;
– умеренно-грязные руки у ребёнка – хорошо (но, приучать мыть после посещения туалета), отдавать в садик рано – хорошо (хоть и болеет, в среднем, раз в три недели первый год), прививки делать – хорошо. Всё это тренирует адаптивный и приобретенный иммунитет, и затем в подростковом возрасте значительно меньше аллергических и аутоиммунных заболеваний. Кстати, в США запретили производство антибактериального мыла.
Следите за своим здоровьем – будете знать, куда оно ушло!
Виктор Ямщиков, врач-минималист
Написано на основе статьи из Русского медицинского журнала (в блоге www.rmj.ru/blog/)
Целью работы было определение параметров и особенностей мукозального иммунитета у спортсменов высших достижений. В ходе исследования у спортсменов выявлены нарушения мукозального иммунитета – повышение уровней иммуноглобулина класса G и лактоферрина в слюне, а также снижение активности лизоцима.
Параметры мукозального иммунитета у спортсменов высших достижений могут иметь значение для оценки состояния иммунной защиты организма и мотивации к назначению и коррекции проводимой терапии. Изменения показателей мукозального иммунитета при инфекционных заболеваниях верхних дыхательных путей, имевшие место у участников исследования, указывают на необходимость применения у них препаратов с иммуномодулирующим эффектом.

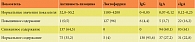
Таблица. Динамика показателей мукозального иммунитета у спортсменов высших достижений, абс. (%)
Введение
За последние 20–30 лет физические нагрузки в спорте возросли в четыре-пять раз и стали предельными для человека. Увеличение физической нагрузки у спортсменов все чаще сопровождается нарушениями иммунной системы, выраженность которых зависит от интенсивности и продолжительности физических упражнений.
Длительные и интенсивные физические нагрузки провоцируют множественные изменения иммунной системы, или физиологический стресс. Спортсмены, которые напряженно тренируются в течение двух недель и впоследствии участвуют в соревнованиях, имеют повышенный риск развития инфекционных заболеваний верхних дыхательных путей (ИЗВДП) [1].
Следствием интенсивной физической нагрузки могут быть изменения врожденного, мукозального, адаптивного иммунитета и цитокиновой сети иммунной системы.
В США и Европе с участием спортсменов проведено немало исследований, посвященных изучению особенностей мукозального иммунитета. Например, в ходе французского исследования при повторных соревнованиях в команде триатлонистов ежедневные интенсивные упражнения приводили к снижению уровня иммуноглобулина (Ig) класса A слюны [2]. Аналогичные исследования проводились в Бразилии [3], Великобритании и США. Вместе с тем следует отметить, что снижение IgA слюны не является надежным маркером определения восприимчивости к инфекциям [4].
Местный иммунитет играет важную роль в защите слизистых оболочек респираторного, кишечного и урогенитального трактов, конъюнктивы глаза, ротовой полости. Защитные свойства слизистых оболочек (предотвращение проникновения антигенов во внутреннюю среду организма) обусловлены комплексом факторов (перистальтические движения, движение ресничек эпителия, отделение слизи, выделение ферментов), а также выработкой иммуноглобулинов и продукцией лизоцима, лактоферрина, интерферона и др. [5].
Гуморальный иммунитет слизистых оболочек предполагает продукцию IgA, IgM, IgG, а также секреторного IgА (sIgA). Иммуноглобулины попадают в ротовую полость с током крови, но их могут вырабатывать и плазмоциты. Затем иммуноглобулины проникают в место иммунного конфликта – в подслизистый или слизистый слой. IgM быстрее появляются на месте иммунного конфликта. Они менее эффективны, чем IgG, но оказывают иммуностимулирующее действие на местную лимфатическую систему.
К основным маркерам мукозального иммунитета относят sIgA. Слюна – основной материал для исследования мукозального иммунитета ротовой полости и верхних дыхательных путей. Плазматические клетки синтезируют sIgA, который в свою очередь играет первостепенную роль в защите слизистых оболочек от бактерий, грибов и вирусов. Он препятствует взаимодействию микробов со слизистой оболочкой, а также тормозит адгезию микроорганизмов, их токсинов и аллергенов на поверхности эпителия слизистых оболочек, предотвращая их проникновение во внутреннюю среду организма [5]. Антиадгезивные свойства sIgA лежат в основе его антибактериальных, антивирусных и антиаллергенных эффектов.
Продукция sIgA – основная эффекторная функция иммунной системы слизистых оболочек, обеспечивающая первую линию защиты от патогенов.
В недавних исследованиях доказана значимость антимикробных протеинов слюны – лактоферрина, лизоцима и др.
Действуя совместно с другими факторами защиты, такими как бета-лизин, дефензины, комплемент, лизоцим обеспечивает бактерицидность слюны. Расщепляя пептидогликан бактерий, он вызывает осмотический лизис и гибель микробов [6]. Однако лизоцим не активен в отношении вирусов.
Лизоцим проявляет синергизм с дефензинами – положительно заряженными аминокислотами. Дефензины связываются с цитоплазматическими мембранами бактерий, образуют поры, что также вызывает утечку клеточного содержимого и гибель клетки по механизму, аналогичному действию лизоцима [7].
В ротовой жидкости в достаточном количестве содержится лактоферрин. Захватывая ионы железа у бактерий, он парализует дыхание микробов. Лактоферрин служит важным маркером воспалительного процесса, показателем острой фазы воспаления [8].
Дефензины, кателицидины, гистатины относятся к пептидам, характеризующимся антибактериальными свойствами. Дефензины способны уничтожать бактерии, грибы и вирусы. Кроме того, они являются медиаторами воспаления, влияют на хемотаксис, оказывают иммуномодулирующий, цитотоксический и другие эффекты. Дефензины играют ведущую роль в защите макроорганизма от инфекций. Известно десять молекул дефензинов: шесть альфа- и четыре бета-дефензинов, сходных по структуре и функционированию [9].
Гистатины – семейство 12 гистидин-богатых пептидов, обнаруженных только в слюне человека и некоторых высших приматов. Гистатины обладают бактерицидной и фунгицидной активностью, что обеспечивает врожденную защиту ротовой полости [5].
Показано, что длительная и интенсивная тренировка способна индуцировать снижение sIgA в слюне. Результаты ряда исследований демонстрируют изменения показателей антимикробных пептидов в слюне у спортсменов после длительных нагрузок. Уменьшение секреции sIgA в слюне во время интенсивных тренировок и хронического стресса, вероятно, связано с изменением активности гипоталамо-гипофизарно-адреналовой оси при ингибиторных воздействиях на синтез sIgA и трансцитоз [10].
Учитывая противоречивость некоторых зарубежных исследований в отношении данных мукозального иммунитета у спортсменов, мы изучили показатели местного иммунитета у российских спортсменов высших достижений в различных видах спорта.
Материал и методы
Исследование проводилось в лаборатории клинической иммунологии Института иммунологии ФМБА России.
Для оценки мукозального иммунитета использовали нестимулированную слюну. Сбор смешанной нестимулированной слюны проводили в течение десяти минут, через час после еды и после предварительного ополаскивания рта водой. Затем образцы центрифугировали при 1500 g в течение 20 минут для удаления посторонних включений. Аликвоты слюны хранились в холодильнике при температуре -70 ºC.
При исследовании мукозального иммунитета оценивали следующие показатели:
уровни IgA и IgG, а также sIgA в слюне;
активность лизоцима в слюне;
количественное содержание лактоферрина в слюне.
Уровни IgA, IgG и sIgA в слюне определяли методом радиальной иммунодиффузии в геле Манчини. Активность лизоцима измеряли с помощью спектрофотометра. Количественное содержание лактоферрина оценивали методом твердофазного иммуноферментного анализа [11].
Результаты
Исследование проводилось в тренировочный период с нагрузками средней интенсивности.
Всего было обследовано 213 спортсменов. В результате исследования мукозального иммунитета были получены данные, свидетельствовавшие о наличии дисфункции местного иммунитета у спортсменов высших достижений (см. таблицу).
У 61% участников исследования отмечалось снижение уровня sIgA в слюне.
Как известно, дефицит sIgA лежит в основе многих хронических воспалительных заболеваний слизистых оболочек и способствует развитию аллергических реакций [12].
Установлена прямая корреляция между уровнем снижения sIgA в слюне и наличием часто рецидивирующих вирусных инфекций у спортсменов (герпесвирусные, острые респираторные, рецидивирующие риносинуситы и т.д.).
Чаще снижение уровня sIgA отмечалось у спортсменов с выявленной аллергией.
У 64,3% обследованных отмечалось уменьшение активности лизоцима в слюне, что свидетельствовало о снижении местного иммунитета.
Лизоцим разрушает бета-1–4-гликозидную связь между N-ацетилглюкозамином и N-ацетилмурамовой кислотой пептидогликана, что приводит к изменению проницаемости клеточных стенок бактерий, лизису и гибели бактериальной клетки. Этот пептид высвобождает из клеточной стенки бактерии мурамилдипептид, что обеспечивает его защитные свойства.
У 96% спортсменов имело место повышение содержания лактоферрина в слюне. Повреждая внешнюю мембрану бактерий, лактоферрин дает возможность лизоциму воздействовать на пептидогликан бактерий. Лактоферрин также обладает фунгицидными свойствами, активен в отношении многих вирусов. Повышение содержания лактоферрина в слюне может свидетельствовать о наличии ИЗВДП.
У 69,1% спортсменов высших достижений выявлено снижение уровня IgА в слюне.
Специфические защитные механизмы слизистых оболочек обеспечивают защиту макроорганизма от воздействия внешней (инфекции) и внутренней агрессии за счет активации иммунокомпетентных и вспомогательных клеток, а также продукции иммуноглобулинов разных классов (G, M, A), в том числе секреторных (sIgA) [12]. Снижение содержания IgA в слюне обследованных спортсменов может говорить о снижении барьерной функции слизистой оболочки верхних дыхательных путей. Как следствие – повышенная заболеваемость ИЗВДП.
Нормальный уровень IgG в слюне отмечался у 95,6% обследованных, повышенный – у 4,6%. Это соответствует данным литературы: в нормальной слизистой оболочке верхних дыхательных путей значимых нарушений IgG иммунного ответа не выявляется [13].
Таким образом, на основании полученных данных установлено снижение показателей мукозального иммунитета у спортсменов высших достижений.
Многие патологические процессы, в том числе инфекционные, протекают на фоне сниженного местного иммунитета либо приводят к вторичной иммунной недостаточности. При хронической воспалительной реакции любой этиологии (инфекция, аллергия и др.) создаются условия для нарушения функционирования мукозального иммунитета, что подтверждено результатами данного исследования.
Выявленное нами уменьшение активности лизоцима в слюне может приводить к снижению фагоцитоза и литической активности комплекса sIgA с С3-компонентом комплемента в отношении грамотрицательных бактерий и повышенной инфекционной заболеваемости у спортсменов [14]. Такие изменения могут способствовать формированию и частым рецидивам ИЗВДП. Результаты клинико-лабораторных данных, полученных нами при обследовании спортсменов высших достижений, подтвердили это.
Как уже отмечалось, более трети обследованных нами спортсменов страдали рецидивирующими вирусными и бактериальными заболеваниями верхних дыхательных путей (ВДП). Необходимо учитывать, что в развитии любого местного клинического проявления со стороны слизистой оболочки носа и ВДП участвуют все интегральные системы организма (иммунная, нервная, эндокринная и др.). Местный иммунитет ЛОР-органов и ВДП – это барьерная функция слизистой оболочки, включающая две линии защиты:
механизм иммунного исключения или охраны; обеспечивается мукоцилиарным клиренсом;
механизм иммунной элиминации, или иммунное устранение; обеспечивается иммунным ответом слизистого и подслизистого слоя [15].
Профилактика и лечение
В связи с тем что одной из основных причин частого возникновения острых респираторных вирусных инфекций (ОРВИ) и более тяжелого течения инфекционно-воспалительных заболеваний является несостоятельность системы местной защиты, особую роль в лечении и профилактике ИЗВДП играют иммуномодуляторы местного действия. Они не запрещены антидопинговым контролем, в силу чего могут занять свою нишу в лечении и профилактике ИЗВДП у спортсменов высших достижений.
В настоящее время применяется несколько типов иммуномодуляторов местного действия:
препараты на основе компонентов клеточной стенки бактерий;
бактериальные лизаты: лизаты бактерий Candida albicans, Corynebacterium pseudodiphtheriticum, Enterococcus faecalis, E. faecium, Fusobacterium nucleatum subsp., Klebsiella pneumoniae subsp. pneumoniae, Lactobacillus acidophilus, L. fermentum, L. helveticus, L. delbrueckii subsp. lactis, Streptococcus pyogenes groupe A, S. sanguis, Staphylococcus aureus subsp. aureus (ИРС 19, Имудон);
препараты на основе нуклеиновых кислот (натрия нуклеинат, деринат и др.);
интерфероны (Виферон);
полимерные (Полиоксидоний).
Эффективность иммуномодуляторов системного и местного действия доказана в многочисленных клинических исследованиях. На фоне их применения удается добиться увеличения длительности ремиссии, снижения частоты обострений и госпитализаций. Кроме того, использование иммуномодуляторов способствует профилактике развития инфекционных осложнений. Многие иммуномодуляторы, в частности Полиоксидоний и Виферон, включены в медицинские стандарты по комплексному лечению рецидивирующих вирусных инфекций, рецидивирующих хронических неспецифических заболеваний легких, ЛОР-патологии, туберкулеза.
Так, в открытом рандомизированном исследовании с участием 77 пациентов с острыми и хроническими синуситами показано, что ИРС 19 снижает количество пункций и рецидивов риносинуситов у взрослых [16].
Препарат Имудон способствует устранению очагов инфекции в ротоглотке за счет увеличения фагоцитарной активности нейтрофилов, завершенности фагоцитоза и уменьшения внутриклеточной персистенции возбудителей, способствует нормализации микрофлоры полости рта и глотки и снижает риск рецидивов [17].
Профилактическое использование сублингвальной формы Полиоксидония усиливает иммунный ответ на широкий круг патогенов, ускоряя их уничтожение, а также обезвреживание возможных эндотоксинов микрофлоры респираторного тракта. Клинически это проявляется прекращением избыточного выделения экссудата, разжижением мокроты, улучшением оттока секрета из полостей верхних дыхательных путей.
Снижение показателей мукозального иммунитета отмечается у спортсменов высших достижений, страдающих аллергическими заболеваниями. В том случае, когда аллергические заболевания у спортсменов протекают в сочетании с рецидивирующими очагами бактериальной, вирусно-грибковой инфекции (хронический гнойно-обструктивный бронхит, хронический гнойный гайморит, слизисто-кожный кандидоз, рецидивирующая герпетическая инфекция и т.д.), патогенетически обоснованным считается назначение Полиоксидония. Препарат не усиливает синтез IgE и не вызывает обострение аллергических заболеваний [18, 19].
Особого подхода требует и назначение лечебно-профилактических мероприятий при аллергических заболеваниях у спортсменов высших достижений, что определяется требованиями антидопингового комитета и запретом на применение спортсменами многих противоаллергических средств. Если же использование запрещенных препаратов жизненно необходимо, следует соблюдать регламент оформления соответствующих документов. У спортсменов, страдающих аллергическими заболеваниями, разрешены к использованию так называемые барьерные методы терапии (например, Превалин), препараты, стабилизирующие мембраны тучных клеток, в частности препараты кромоглициевой кислоты (Интал, КромоГЕКСАЛ). Впервые в клинике Института иммунологии у спортсменов высших достижений показан высокий клинический эффект основного, патогенетически обоснованного метода лечения – аллергенспецифической иммунотерапии.
Заключение
Раннее выявление патогенеза иммуноопосредованных воспалительных состояний на фоне аллергических заболеваний и иммунной недостаточности позволяет своевременно и эффективно решать проблемы оказания спортсменам высших достижений первичной и специализированной аллергологической и иммунологической помощи. Эта помощь направлена на профилактику и раннюю диагностику иммунозависимых заболеваний, среди которых особое место занимают аллергические заболевания (бронхиальная астма, аллергический ринит, поллиноз, атопический дерматит), иммунодефицитные состояния и аутоиммунные заболевания.
