Нобелевская премия в области иммунитета
Иммунная система позволяет нам существовать в мире, полном патогенных микроорганизмов — вирусов, бактерий, грибов. Нобелевская премия по физиологии и медицине 2011 года вручена за открытия в области активации врожденного иммунитета (половину премии разделили Брюс Бётлер и Жюль Хоффман) и за изучение роли дендритных клеток в приобретенном иммунитете (вторая половина премии присуждена Ральфу Стайнману, к сожалению, скончавшемуся 30 сентября). Эти достижения не только дали понимание того, как слаженная работа врожденного и адаптивного иммунитета защищает организм, но и открыли новые перспективы в лечении инфекций, рака и воспалительных заболеваний.
Две линии иммунной обороны
Мы обитаем в мире, буквально кишащем патогенными микроорганизмами (бактериями, грибами, вирусами и паразитами), однако наши организмы оснащены совершенной системой защиты, позволяющей (в норме) не замечать опасного соседства. «Первая линия» иммунной обороны — врожденный иммунитет — уничтожает вторгшиеся в организм патогены на основе технологии «свой—чужой», распознавая черты, всегда присутствующие у «захватчиков», но отсутствующие в собственном организме. Если же инфекции удается прорваться, вступает в работу «вторая линия» — приобретенный, или адаптивный, иммунитет. Основанный на согласованной работе B- и T-лимфоцитов, он действует посредством специфических к конкретной инфекции антител и клеток-«убийц», уничтожающих зараженные клетки и саму инфекцию. В отличие от врожденного иммунитета, способность к распознаванию патогенов которого закодирована генетически, приобретенный иммунитет обучается распознавать новые «образы» врага и сохраняет память о нем, мгновенно «вспоминая», встретившись вновь.
Однако, обеспечивая необходимую защиту, иммунные механизмы скрывают и опасность: если «активационный барьер» слишком низок, иммунитет может активироваться собственными молекулами, что приводит к развитию аутоиммунных и воспалительных заболеваний.
Организация иммунной системы изучалась в течение XX века постепенно; в частности, нобелевскими премиями отмечены изучение строения антител и определение механизма распознавания Т-клетками инородных веществ. Однако только с работами Бётлера, Хоффмана и Стайнмана стали понятны механизмы, активирующие врожденный иммунитет и связывающие его с иммунитетом приобретенным.
Открытие сенсоров врожденного иммунитета
Пионерское открытие Жюля Хоффмана было сделано в 1996 году, когда он с коллегами исследовал, как дрозофила сопротивляется инфекциям [1]. Они работали на линиях мух, мутантных по нескольким генам, включая ген Toll, участвующий в эмбриональном развитии (за открытие роли этого гена также вручена Нобелевская премия в 1995 году). Хоффман с коллегами открыли, что мухи с мутантным геном Toll погибали при заражении бактериями или грибами, в то время как «дикий тип» чувствовал себя вполне сносно. В результате их работ был сделан вывод, что продукт этого гена — Toll-рецептор — «чувствует» патогенные микроорганизмы и запускает механизмы врожденного иммунитета.
Брюс Бётлер с коллегами, со своей стороны, искали рецепторы, которые могли бы активироваться элементом клеточной стенки бактерий липополисахаридом (ЛПС), который при попадании в кровь вызывает септический шок (чрезмерная активация иммунной системы, грозящая смертью). В 1998 году они обнаружили, что мыши, не реагирующие на введение ЛПС, имели мутации в гене, гомологичном Toll у дрозофил. Продукт этого гена — Toll-подобный рецептор — и оказался искомым сенсором липополисахарида [2]. Связывание ЛПС (обозначающее присутствие бактерий) активирует иммунитет и запускает воспаление, а чрезмерная концентрация ЛПС приводит к септическому шоку. Это открытие показало, что и членистоногие, и млекопитающие используют схожие стратегии противостояния бактериальным инвазиям.
Открытия Хоффмана и Бётлера фактически положили начало новой «горячей» области биологии: впоследствии было открыто более 10 Toll-подобных рецепторов, каждый распознающий свой «образ», характерный для разных групп микроорганизмов. Мутации в генах этих рецепторов увеличивают вероятность инфекционных заболеваний, а также хронических воспалительных болезней.
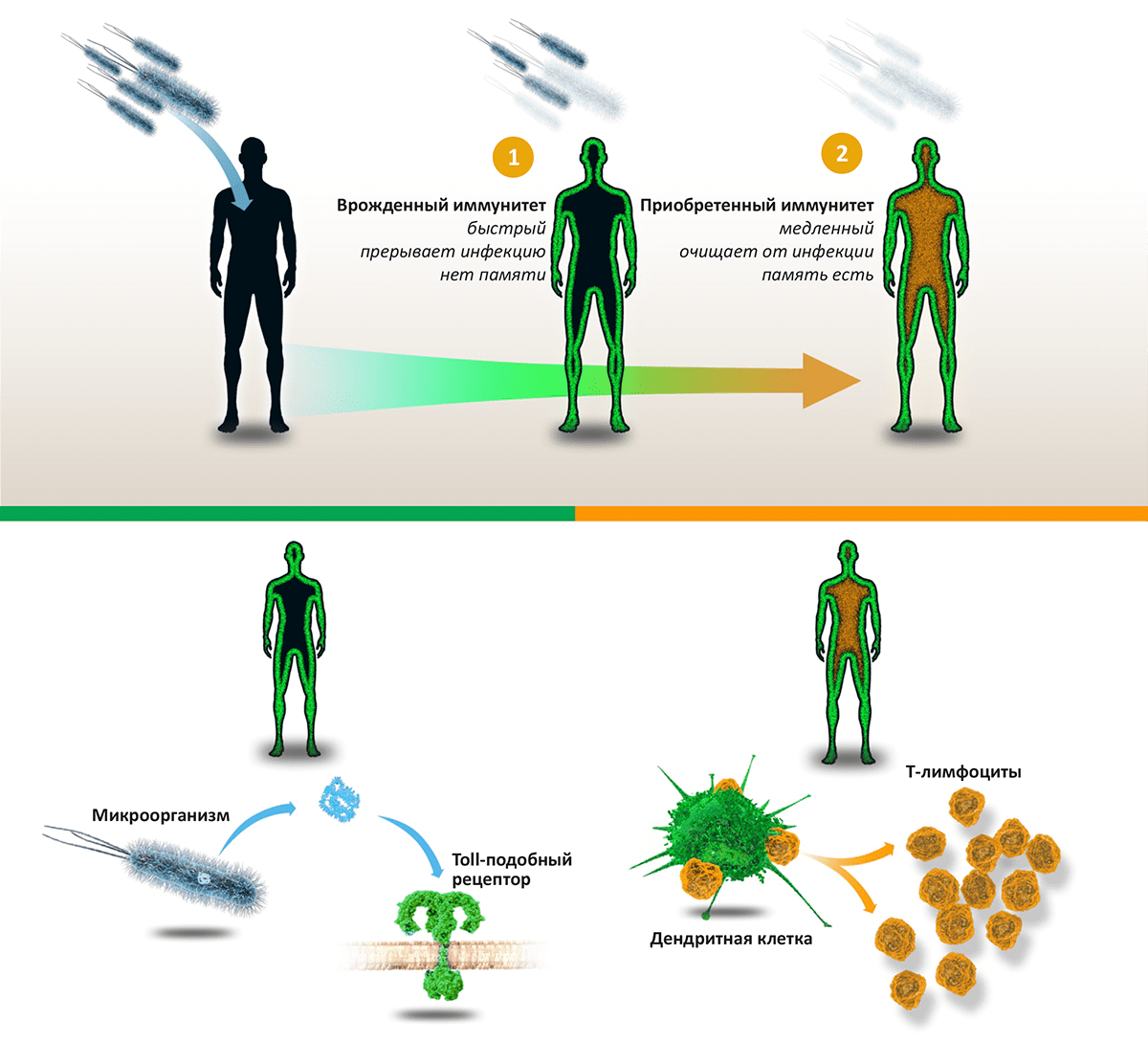
Рисунок 1. Схема работы иммунитета. Проникновение в тело человека патогенных микроорганизмов — бактерий, вирусов или грибов — активирует «две линии» иммунной реакции: врожденный иммунитет (останавливает инфекцию) и приобретенный иммунитет (выводит инфекцию из организма). Врожденный иммунитет: компоненты микроорганизмов, такие как липополисахарид, связываются с Toll-подобными рецепторами, находящимися на поверхности многих клеток организма. Это запускает врожденный иммунитет, активирующий воспалительную реакцию и уничтожающий «захватчиков». Приобретенный иммунитет: Дендритные клетки активируют T-лимфоциты, лежащие в основе каскада иммунных реакций, приводящих к синтезу антител и уничтожению патогенов и зараженных клеток.
Новый игрок в команде адаптивного иммунитета
Еще в 1973 году Ральф Стайнман открыл новый тип клеток иммунитета с длинными отростками, названный им дендритными клетками. Его предположение было — что эти клетки активируют T-лимфоциты, играющие ключевую роль в приобретенном иммунитете и иммунной памяти. Это предположение блестяще подтвердилось в клеточных экспериментах, где добавление дендритных клеток к популяции Т-лимфоцитов способствовало формированию иммунитета [3–5].
Дальнейшие работы Стайнмана и других исследователей были направлены на то, чтобы понять, как приобретенный иммунитет определяет, — надо ли реагировать на то или иное вещество, или можно этого не делать. Обнаружилось, что дендритные клетки воспринимают сигналы от системы врожденного иммунитета, и это управляет их способностью активировать T-клетки. Это позволяет нашему иммунитету прицельно бороться с патогенными микроорганизмами, «не обращая внимания» на молекулы нашего собственного тела.
Фундаментальные науки — медицине
Достижения нобелевских лауреатов 2011 года пролили свет на подробности работы систем врожденного и приобретенного иммунитета. Это знание легло в основу создания новых стратегий лечения многих болезней, — например, новых вакцин против инфекций и попыток «натравить» собственную иммунную систему на раковые опухоли. В дополнение к этому, стало понятно, почему организм иногда начинает атаковать свои собственные ткани, что приводит к воспалительным и аутоиммунным заболеваниям.
Горькая ирония
Как известно, Нобелевская премия не вручается посмертно. Однако этот год стал исключением: 30 сентября после продолжительной борьбы с раковой опухолью скончался Ральф Стайнман, — буквально за несколько дней до объявления лауреатов премии. Нобелевский комитет не знал об этом, и обнародовал свое решение 3 октября. Несмотря на этот печальный казус, решение менять не будут. Работы Стайнмана легли в основу терапии дендритными клетками — перспективного способа лечения воспалительных и онкологических заболеваний. К сожалению, самому ему оказалось суждено стать жертвой такого заболевания [6], [7].
И снова мимо!..
Сегодня интернет пестрит сообщениями, что опять — в который уже раз! — Нобелевский комитет обошел своим решением российских ученых. Речь идет о российском эмигранте Руслане Меджитове [8], который, вместе со своим (ныне уже покойным) учителем Чарльзом Дженуэем показал, что и у людей существуют Toll-подобные рецепторы [9]. Если бы Дженуэй был жив, то, скорее всего, именно он был бы третьим лауреатом премии (вместо Стайнмана), а сама премия была бы конкретно за врожденный иммунитет.
По материалам пресс-релиза Нобелевского комитета [10].
- Bruno Lemaitre, Emmanuelle Nicolas, Lydia Michaut, Jean-Marc Reichhart, Jules A Hoffmann. (1996). The Dorsoventral Regulatory Gene Cassette spätzle/Toll/cactus Controls the Potent Antifungal Response in Drosophila Adults. Cell. 86, 973-983;
- A. Poltorak. (1998). Defective LPS Signaling in C3H/HeJ and C57BL/10ScCr Mice: Mutations in Tlr4 Gene. Science. 282, 2085-2088;
- R. M. Steinman. (1973). IDENTIFICATION OF A NOVEL CELL TYPE IN PERIPHERAL LYMPHOID ORGANS OF MICE: I. MORPHOLOGY, QUANTITATION, TISSUE DISTRIBUTION. Journal of Experimental Medicine. 137, 1142-1162;
- R. M. Steinman, M. D. Witmer. (1978). Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice.. Proceedings of the National Academy of Sciences. 75, 5132-5136;
- G. Schuler. (1985). Murine epidermal Langerhans cells mature into potent immunostimulatory dendritic cells in vitro. Journal of Experimental Medicine. 161, 526-546;
- Нобелевскую премию присудили только что умершему от рака ученому. Но другого выбирать уже не будут. (2011). NewsRu;
- Воронин Е. (2011). Ральф Стайнман. shvarz.livejournal.com;
- Интервью с профессором Йельского университета Русланом Меджитовым;
- Ruslan Medzhitov, Paula Preston-Hurlburt, Charles A. Janeway. (1997). A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature. 388, 394-397;
- The Nobel Prize in Physiology or Medicine 2011. (2011). The Nobel Prize.
Нобелевскую премию 2018 года вручили за открытия, позволившие разработать принципиально новый подход в иммунотерапии рака, совершивший прорыв в лечении некоторых ранее смертельных опухолей. Сегодня «Биомолекула» снова расскажет об антителах-ингибиторах иммунологических чекпоинтов и о работах лауреатов этого года — Джеймса П. Эллисона и Тасуку Хондзё.
Повстанцы внутри организма
Рак — это большая группа заболеваний, объединенных общей чертой: все они начинаются с одной клетки, мутации в которой позволяют ей неограниченно делиться и формировать огромные сложно организованные скопления клеток — опухоли. Ежегодно рак убивает миллионы людей, занимая почетное второе место среди причин смерти, сразу после сердечно-сосудистых заболеваний.
С точки зрения медицины, раковые опухоли представляют собой таких же паразитов, как болезнетворные бактерии или глисты. С тем лишь отличием, что раковые клетки намного более похожи на здоровые, нежели бактерии или вирусы, да и располагаться могут в любой части тела. Но задача и там и там одна — полностью избавить организм от причины заболевания, уничтожить ее. До недавнего времени врачи располагали лишь тремя инструментами для борьбы с раком — операция, облучение ионизирующей радиацией и химиотерапия (специальные яды, бьющие по быстро делящимся клеткам). Нобелевская премия этого года дана за важнейшие шаги в разработке четвертого способа борьбы — уничтожения опухолей с помощью иммунных клеток самого пациента.
Иммунный надзор
Идею, что иммунитет и рак могут быть как-то связаны, высказал еще отец-основатель иммунологии и Нобелевский лауреат 1908 года Пауль Эрлих. Этот исследователь предположил, что опухолевые клетки могут возникать в организме постоянно, но иммунитет блокирует их развитие [1], [2]. Его идеи отчасти подтвердились в 1950-х годах, когда оказалось, что переливание крови от пациентов, у которых меланома (рак кожи) ранее спонтанно исчезла, может спровоцировать такую же регрессию у пациента, получившего кровь. Исследователи пошли дальше и попробовали пересадить меланому между двумя пациентами, чем добились регрессии опухолей у обоих. Со временем идеи Эрлиха легли в основу целой теории иммунного надзора над опухолью.
Эти данные позволили разработать первую иммунотерапию рака. Подкожное введение бациллы Кальметта—Герена, сильного неспецифического иммуностимулятора, приводило к регрессии опухоли [3]. Введением пациентам вакцин на основе стрептококка и занимался «отец иммунотерапии рака» Уильям Коли. Его результаты подтвердили предположение Эрлиха о важной роли иммунитета в подавлении развития опухолей. Однако до поры это не вылилось в серьезные медицинские прорывы.
Чтобы совершить качественный рывок в лечении рака, исследователям пришлось потратить еще несколько десятилетий на раскрытие природы иммунной защиты от опухолей. В настоящий момент эта тема изучена очень хорошо. Взаимодействие опухоли и иммунной системы устроено очень сложно. Все клетки нашего организма подвергаются постоянному иммунному надзору. Эта слежка позволяет на ранних этапах опознать раковые опухоли и задушить их в зародыше.
Для того чтобы стать раковой, клетке необходимо накопить некоторое количество мутаций в своих генах. Одни гены должны активироваться и начать стимулировать деление (их еще называют онкогенами), другие, подавляющие деление клетки (гены-супрессоры), — выключиться. При этом внутри клетки появляются измененные этими и последующими мутациями белки — неоантигены. Этот термин пришел к нам из иммунологии, где антигеном называют мишень иммунных клеток.
Дело в том, что практически все клетки нашего тела в обязательном порядке сообщают иммунитету обо всех белках, которые они содержат. Этот «иммунологический паспорт» расположен на поверхности клеток и состоит из белков главного комплекса гистосовместимости (MHC), в которых как в тисках зажаты небольшие аминокислотные цепочки — пептиды. Эти фрагменты вырезаются из всех белков, присутствующих внутри данной клетки. Специальные клетки — Т-киллеры, постоянно «ощупывают» эти белковые комплексы и когда клетка начинает производить что-то странное, убивают ее. Поэтому практически все опухоли так или иначе умеют контролировать иммунный ответ и избегать его (рис. 1).
Рисунок 1. Схематическое изображение взаимодействия опухолевых клеток и иммунитета. Искаженный «иммунологический паспорт», состоящий из комплексов MHC и пептидов привлекает Т-киллеры, а его отсутствие — NK-клетки.
Иммунологические тормоза
При той всеобъемлющей защите, которую обеспечивает нам иммунитет, кажется невероятным, что какие-то опухоли все-таки могут развиваться в организме. Особенно подобные меланоме (рис. 2), которая выделяется среди опухолей наиболее сильным искажением «иммунологического паспорта». Многие опухоли просто «набиты» иммунными клетками (рис. 3), которые почему-то их не атакуют. Должны существовать механизмы, позволяющие таким новообразованиям избегать иммунного надзора.

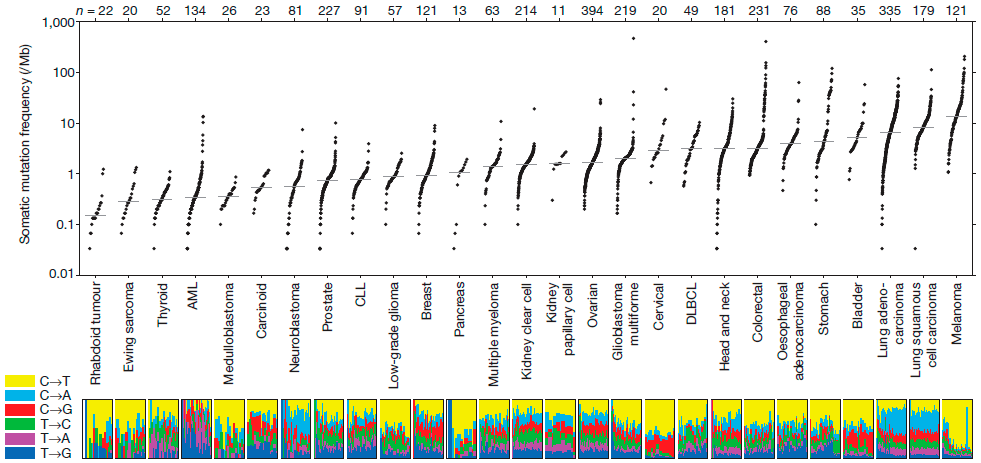
Рисунок 2. Количество мутаций в различных типах опухолей на миллион оснований ДНК. Косвенно может указывать на иммуногенность опухоли.
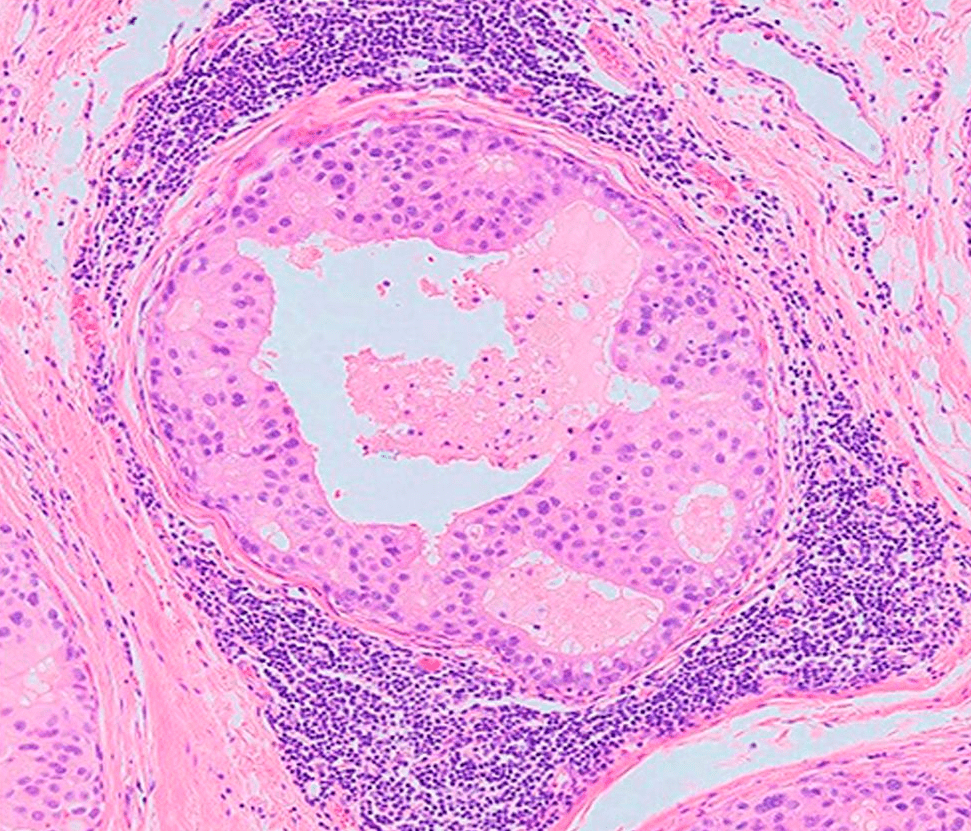
Рисунок 3. Лимфоциты (темно-фиолетовые), окружающие опухоль (в центре). Гистологический срез опухоли молочной железы.
Именно их изучением занимались лауреаты Нобелевской премии по физиологии и медицине 2018 года (рис. 4) [4]. В 1990-х годах первый из двух лауреатов, Джеймс Эллисон, занимался изучением белка CTLA-4, который располагается на поверхности различных групп Т-лимфоцитов. Он и его коллеги заметили, что этот белок способен подавлять иммунную реакцию [5]. Основными носителями этого белка в организме являются регуляторные Т-клетки, которые с его помощью предотвращают активацию других лимфоцитов, блокируя работу антигенпрезентирующих клеток в лимфоузлах и тканях [6]. Эта блокировка действует как тормоз для иммунной реакции и является важной защитой от аутоиммунных заболеваний. Если же заблокировать CTLA-4, Т-лимфоциты начинают работать намного активнее.
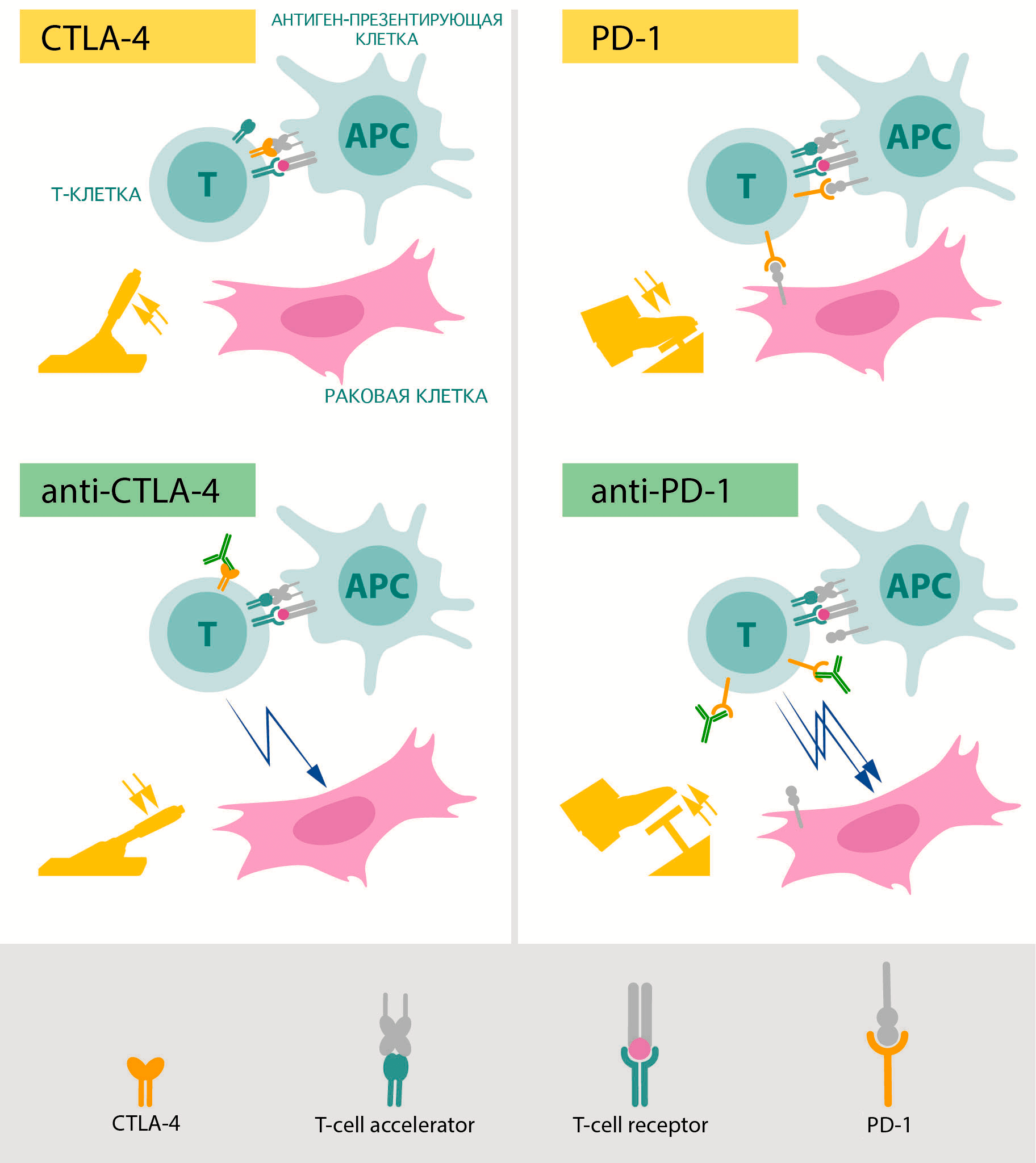
Рисунок 4. Схематическое изображение механизмов работы препаратов, разработанных на основе открытий Эллисона (слева) и Хондзё (справа). Зеленым показаны блокирующие антитела, «снимающие тормоза» с противоракового иммунитета.
Пока коллеги Эллисона изучали возможности применения знаний о CTLA-4 в терапии аллергий, ему пришло в голову, что гиперактивация этого белка может быть частью защиты опухолей от иммунитета. Его группа попробовала ввести блокирующие функцию CTLA-4 антитела мышам с развитыми формами рака и увидела серьезное снижение активности опухолевых клеток и уменьшение объема опухолевой ткани [7]. Поначалу фармакологические компании не заинтересовались этим открытием, однако впоследствии настойчивость Эллисона, продолжившего исследования на людях, принесла свои плоды. В настоящий момент терапия антителами против CTLA-4 [8] с использованием открытого Эллисоном механизма зарегистрирована по всему миру, в том числе и в России. Международное непатентованное название препарата — ипилимумаб [9]. Применяют его сейчас для лечения меланомы в последней стадии, которая ранее была смертным приговором. Этот препарат также тестируется и против других форм рака.
В то время, когда группа Эллисона работала над CTLA-4 в США, в Киото исследователи под руководством профессора Тасуку Хондзё изучали другой механизм подавления иммунного ответа [10]. Они обнаружили белок под названием PD-1, который появляется на активированных Т-киллерах [11]. В норме этот белок позволяет регуляторным Т-клеткам подавлять те Т-киллеры, которые активировались на «неправильный» антиген. Дело в том, что активация этого белка на лимфоцитах (с помощью лиганда PD-1 — PD-L1) отправляет их в апоптоз. Именно благодаря этому он и получил свое название: PD расшифровывается как programmed death, «программируемая смерть».
В исследованиях на мышах группа Хондзё показала эффективность блокировки нового белка в борьбе с различными опухолями [12]. Эти данные были использованы для разработки нового препарата под названием ниволумаб, который также зарегистрирован по всему миру и используется для лечения многих опухолей, в том числе и меланомы [13].
Так, более 100 лет спустя после первого, пророческого заявления Пауля Эрлиха, иммунитет наконец-то стал надежным союзником человека в борьбе с онкологическими заболеваниями.
- Christine V Ichim. (2005). . J Transl Med. 3, 8;
- Ehrlich P. (1909). Ueber den jetzigen stand der Karzinomforschung. Ned. Tijdschr. Geneeskd. 5, 273–290;
- Morton D.L., Eilber F.R., Joseph W.L., Wood W.C., Trahan E., Ketcham AS. (1970). Immunological factors in human sarcomas and melanomas: a rational basis for immunotherapy. Ann. Surg. 172, 740–749;
- Пресс-релиз на сайте Нобелевского комитета;
- D. R. Leach, M. F. Krummel, J. P. Allison. (1996). Enhancement of Antitumor Immunity by CTLA-4 Blockade. Science. 271, 1734-1736;
- Дендритные клетки: профессиональные разведчики в «Опухолевой войне»;
- E. D. Kwon, A. A. Hurwitz, B. A. Foster, C. Madias, A. L. Feldhaus, et. al.. (1997). Manipulation of T cell costimulatory and inhibitory signals for immunotherapy of prostate cancer. Proceedings of the National Academy of Sciences. 94, 8099-8103;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Лечение Джимми Картера;
- Hiroyuki Nishimura, Masato Nose, Hiroshi Hiai, Nagahiro Minato, Tasuku Honjo. (1999). Development of Lupus-like Autoimmune Diseases by Disruption of the PD-1 Gene Encoding an ITIM Motif-Carrying Immunoreceptor. Immunity. 11, 141-151;
- Y. Ishida, Y. Agata, K. Shibahara, T. Honjo. (1992). Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death.. The EMBO Journal. 11, 3887-3895;
- Y. Iwai. (2004). PD-1 blockade inhibits hematogenous spread of poorly immunogenic tumor cells by enhanced recruitment of effector T cells. International Immunology. 17, 133-144;
- Рак почки: чтобы вылечить, надо восстановить естественный иммунитет!;
- Marie Colombe Agahozo, Dora Hammerl, Reno Debets, Marleen Kok, Carolien H M van Deurzen. (2018). Tumor-infiltrating lymphocytes and ductal carcinoma in situ of the breast: friends or foes?. Mod Pathol. 31, 1012-1025.
Вчера были названы лауреаты Нобелевской премии по физиологии и медицине. Ими стали иммунологи Джеймс Эллисон из США и Тасуку Хондзё из Японии. Почетным призом были отмечены работы ученых, касающиеся открытия механизма локального подавления иммунитета вокруг злокачественных опухолей. Пионерская работа Эллисона касалась открытия белка CTLA-4, а Хондзё параллельно открыл белок PD-1.
Открытия Джеймса Эллисона и Тасуку Хондзё касаются фундаментального вопроса, которым задавались врачи на всем протяжении изучения онкологических заболеваний. Понятно, что основным защитником организма в борьбе со злокачественными клетками является иммунитет. Каждый день в нашем организме возникают зачатки опасных опухолей, но иммунная система оперативно справляется с ними, поэтому мы и не догадываемся об их существовании. Диагноз «рак» ставят в случае, когда неожиданно одна из опухолей находит пути «взломать» защиту организма.
Длительное время у онкобольных пытались найти нарушение иммунитета — ведь понятно, что если опухоль растет, то иммунитет с ней не справляется. Однако все попытки найти системные нарушения иммунитета оказались неудачными.
Джеймс Эллисон и Тасуку Хондзё установили потрясающий факт: опухоль в стадии роста способна сама выделять иммуносупрессоры, то есть ограничители иммунитета. Поэтому на уровне организма эффекты падения защиты увидеть нельзя, а рядом с опухолью — можно.
По словам руководителя отдела биологии опухолевого роста НИИ онкологии им. Н.Н. Петрова, заведующего кафедрой медицинской генетики Санкт-Петербургского педиатрического университета, профессора кафедры онкологии Северо-Западного медицинского университета им. И.И. Мечникова Евгения Имянитова, это действительно один из самых значительных прорывов онкологии в понимании механизмов вовлечения иммунитета.
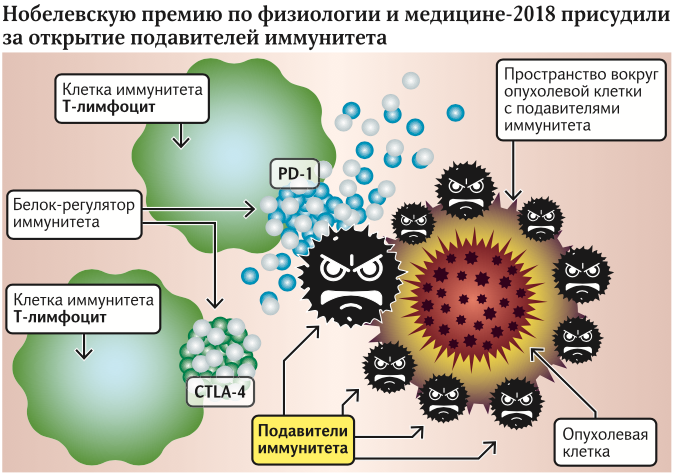
— Как мы знаем, онкологию лечат при помощи хирургического вмешательства, облучения и химиотерапии. Открытие нобелевских лауреатов привело к появлению четвертого столпа в борьбе с раком — работы с иммунитетом. Благодаря этому открытию были разработаны лекарства, которые снижают активность иммуносупрессоров и приводят к уменьшению опухоли, — отмечает эксперт.
Исследования белков СTLA-4 и PD-1 велись почти 30 лет. В настоящий момент получены лекарства, которые подавляют локальную защиту опухоли, вынуждая иммунитет работать в обычном режиме. Как считает руководитель лаборатории геномной инженерии МФТИ Павел Волчков, это говорит о том, что в будущем с раком будет бороться иммунитет человека, а не химиотерапия, которая убивает и «своих» и «чужих».
В настоящий момент, по словам научного сотрудника лаборатории молекулярной иммунологии и вирусологии НИЦ «Курчатовский институт» Сергея Крынского, разрабатываются и внедряются различные подходы к стимулирующей иммунотерапии у онкологических больных, основанные на природоподобных технологиях направленной активации иммунных клеток больного.
— В их числе, например, метод противоопухолевой вакцинации, основанный на введении в организм фрагментов белков опухоли для стимуляции иммунного ответа на нее. Другой современный метод — это использование собственных лимфоцитов пациента, обработанных в лабораторных условиях биологически активными веществами, лимфокинами, и затем возвращенных в организм для эффективной атаки на опухоль (метод лимфокин-активированных киллеров, или ЛАК-терапия). Эффективное применение этих методов было бы невозможным без открытий Джеймса Эллисона и Тасуку Хондзё.
Академик РАН, заведующий лабораторией молекулярных механизмов иммунитета Института молекулярной биологии им. В.А. Энгельгардта РАН и заведующий кафедрой иммунологии биологического факультета МГУ им. М.В. Ломоносова Сергей Недоспасов считает нынешнее присуждение одним из самых справедливых в недавней истории этой премии.
— Я лично хорошо знаю и Джеймса Эллисона, и Тасуку Хондзё. Почти 30 лет назад они открыли важные молекулы, которые участвуют в сигнальных каскадах иммунной системы. Потом они установили, что речь идет о молекулярных тормозах для Т-лимфоцитов. А потом оказалось, что именно эти молекулы могут стать мишенью для лекарств при борьбе с опухолями. Однако не стоит думать, что эти очень важные и наукоемкие лекарства станут панацеей. Это просто еще один важный инструмент для онкологов. И нужно понимать, что он работает не на всех видах рака, не на всех пациентах и имеет побочные действия, — подчеркнул Сергей Недоспасов.
Побочные эффекты связаны с тем, что лекарства отключают механизм, блокирующий аутоиммунные заболевания. Но так как они развиваются долго и только в редких случаях приводят к смерти, этот риск считается приемлемым для онкологического пациента. Поэтому российские производители также приступили к созданию лекарств на основе антител к PD-1 и CTLA-4.
Компания Biocad с 2013 года разрабатывает препараты против меланомы, один из которых уже близок к выходу на рынок.
— Решение работать с этими белками было принято еще в 2013 году, когда появились самые первые результаты клинических исследований при использовании антител к PD-1, показавшие прорывные результаты на меланоме, — рассказал вице-президент компании по исследованиям и разработкам Роман Иванов. — Сейчас мы понимаем, что самый лучший терапевтический эффект можно достигнуть при совмещении этих двух антител. Препарат от меланомы на основе антител к PD-1 будет подан в ближайшее время на регистрацию в Минздрав. В первой половине 2019 года препарат появится на российском рынке. Потом мы планируем провести испытания этого же препарата при раке легкого и раке шейки матки. А вот препарат, в котором два антитела будут применяться вместе, поступит на рынок через два-три года.
Понятно, что созданные на основе антител лекарства будут иметь высокую стоимость. Поэтому, прежде чем их применять, нужно убедиться в эффективности их воздействия на конкретного пациента. Для этого в Курчатовском институте разработан метод OncoBox, позволяющий подобрать онкологическому больному наиболее эффективное лечение на основе генного анализа раковой опухоли.
Технология OncoBox уже проходит клинические испытания. Ученые рассчитывают, что через два года начнется ее использование в больницах. OncoBox позволяет исследовать индивидуальную реакцию пациента на прием лекарств — в частности, какой препарат можно использовать для эффективного лечения поздней стадии рака. Анализ предполагает взятие образца опухоли и исследование более 2 тыс. его генов. После этого тест OncoBox сымитирует воздействие 140 целевых препаратов на раковую опухоль, а специалисты оценят эффективность лекарств для конкретного больного.
