Определение т и в клеточного иммунитета
Ниже продублирован мой предыдущий пост на эту важную тему. На днях появились новые, очень интересные данные. Об этом в следующем посте (скорее всего завтра). А пока рекомендую ознакомиться с результатами первого исследования Т-клеточного иммунитета при SARS-CoV-2 инфекции/COVID-19.
Иммунитет к любому инфекционному заболеванию есть следствие глубоко эшелонированной обороны, состоящей из множество элементов. В норме они действуют координировано, работая на единую цель – отбить «атаку агрессора». Если не вдаваться в детали, то в «иммунной обороне» есть несколько блоков.
Первый блок это, так-называемый, врождённый иммунитет (innate immunity). Особенности врождённого иммунитета – распознавание агрессоров «по-крупному», не вдаваясь в детали, быстрое реагирование и отсутствие «памяти» — это означает, что врождённый иммунитет, встретившись с агрессором, не «запоминает» его и если происходит повторная встреча, реагирует точно таким же образом как и при первой встрече. Хотя, нужно отметить, что в последнее время появились данные о существования аналога памяти и у врождённого иммунитета. Для обозначения этого феномена предложен термин «тренированный иммунитет» (trained immunity). Наши возможности избирательно влиять в нужном направлении на врождённый иммунитет пока очень ограничены.
Второй блок это, так называемый, адаптивный иммунитет (adaptive immunity). Эта линия обороны реагирует на агрессора медленнее, но зато она значительно лучше различает индивидуальность агрессоров и обладает «злопамятностью» — если агрессор попытается внедриться повторно, то «сдачи» он получит гораздо сильнее, чем при первом вторжении. По-научному, это называется иммунологической памятью . Ключевыми элементами индивидуального образа агрессора являются антигены. Именно антигены, а точнее их микроструктуры, находящиеся на поверхности, так-называемые, эпитопы, являются теми элементами, по которым адаптивная иммунная система отличает «своих» от «чужих». Когда агрессорами являются вирусы, то антигены это белки вирусов. В адаптивной иммунной системе есть две составные части. Первая, традиционно называется гуморальной («жидкостной»), в вторая – клеточной. Это исторически-укоренившиеся названия не совсем точны, поскольку первичными «игроками» и в гуморальном и в клеточном звене адаптивного иммунитета являются клетки, а «жидкостные факторы» играют роль не только в гуморальном, но и в клеточном звене иммунитета. Более точное название для гуморального иммунитета — «антительный или В-клеточный», так как ключевым «бойцом» здесь являются антитела (продукты В-клеток). А клеточный адаптивный иммунитет точнее называть «Т-клеточным», так как эффекторами этого звена являются Т-лимфоциты. В- и Т- клеточные звенья иммунитета работают не изолированно. Они взаимосвязаны. Но феномены, связанные с антительным иммунитетом, значительно проще исследовать и мы знаем о В-клеточном иммунитете значительно больше, чем о Т-клеточном. Большинство существующих вакцин работают, в основном или исключительно, стимулируя В-клеточный иммунитет. Единственный тип вакцин, который включает в иммунную защиту все типы иммунитета, это вакцины, состоящие из живых, но ослабленных (аттенуированных) возбудителей. Эти вакцины наиболее полно «имитируют» естественный инфекционный процесс. Но такие вакцины не полностью безопасны. Их пытаются заменить более безопасными «высокотехнологичными» вакцинами. Этот процесс идёт не очень быстро. Но это отдельная большая тема, в которую я сейчас углубляться не буду. Экскурс в иммунологию сделан для того, чтобы читатели-неспециалисты понимали, в самых общих чертах, что иммунная защита от инфекции, в частности, иммунная защита от SARS-CoV-2 не сводится только к антителам. Просто антительные иммунные ответы значительно легче изучать, чем Т-клеточные, а методы определения антител, в отличие от таковых для Т-клеточных иммунных ответов, относительно просты и легко коммерциализируются. Однако, без понимания роли каждого из этих двух звеньев адаптивного иммунитета попытки создание вакцины против SARS-CoV-2/COVID-19 это «блуждание в потемках». А ведь до сих пор не было ни одной научной публикации о Т-клеточном иммунитете при инфекции «новым коронавирусом»! Наконец она появилась.
В MedRxiv опубликован препринт статьи озаглавленной «Присутствие SARS-CoV-2-реактивных клеток у пациентов с COVID-19 и здоровых доноров» (оригинал здесь: https://doi.org/10.1101/2020.04.17.20061440). Не буду вдаваться в методические детали этой работы. Не специалисту с ходу в этом разобраться трудно. Остановлюсь на основных выводах:
1) Т-клетки, реагирующие на главный антиген SARS-CoV-2 (гликопротеин S), есть в крови 83% больных COVID-19. Частота обнаружения таких клеток коррелирует с тяжестью заболевания – у тяжелых больных COVID-19, таких клеток, как правило, было меньше или они отсутствовали (хотя размер выборки очень маленький). Существенной корреляции между антительным и Т-клеточным иммунными ответами у больных COVID-19 не обнаружено.
2) Т-клетки, реагирующие на гликопротеин S вируса SARS-CoV-2, обнаружены у здоровых людей, у которых нет никаких признаков инфицирования этим вирусом, ни в настоящем, ни в прошлом. Причём, реагирующие на вирус Т-клетки у больных COVID-19 и здоровых доноров «нацелены» на разные эпитопы гликопротеина S. Более того, эпитопы, с которыми реагируют Т-клетки от здоровых доноров, находятся в той части гликопротеина S, которая имеет наибольшее сходство с аналогичным белком «сезонных» коронавирусов.
Что это всё значит? Прежде всего, это только первая работа такого рода и количество исследованных случаев не слишком велико (больных исследовано – 18; здоровых доноров — 68). Работа выполнена в весьма авторитетной лаборатории, но независимо от авторитета, научные результаты должны пройти проверку на воспроизводимость. Если всё подтвердиться, то будут основания считать, что Т-клеточный иммунитет является важным, а возможно, и необходимым фактором для выздоровления. Остаётся открытым вопрос, насколько важен Т-клеточный иммунитет для поддержания пост-инфекционного иммунитета, если он конечно развивается (что пока не доказано). Методы, апробированные в данной работе, дают возможность этот вопрос изучить. Далее нужно разобраться, что означает неожиданно частая реактивность Т-клеток здоровых доноров с некоторыми эпитопами гликопротеина S. Действительно ли это связано с перекрёстной реакцией между «новым» и «старыми» сезонными коронавирусами? На уровне антительного ответа такой перекрёстной реактивности нет. Но может она есть на уровне Т-клеточных эпитопов. Если окажется, что это так, то можно будет, по крайней мере частично, объяснить индивидуальные различия в чувствительности к SARS-CoV-2, особенно, в зависимости от возраста. Ведь дети чаще взрослых болеют ОРВИ, вызванными обычными коронавирусами. Может в следствии этого они приобретают частичный иммунитет против SARS-CoV-2?
Исследование поверхностных антигенов T-лимфоцитовОпределение поверхностных антигенов T-лимфоцитов с помощью проточной цитофлюориметрии позволяет изучить их созревание, дифференцировку и активацию.
Стимуляция T-лимфоцитов in vitroНарушения созревания и дифференцировки T-лимфоцитов при иммунодефицитах с недостаточностью клеточного иммунитета происходят на разных уровнях. Так, при тяжелом комбинированном иммунодефиците нарушается созревание T-лимфоцитов в тимусе, что проявляется отсутствием на поверхности T-лимфоцитов антигена CD2. При этом заболевании также возможны отсутствие CD3, CD4 и неспособность T-лимфоцитов синтезировать цитокины. При синдроме обнаженных лимфоцитов на мембране активированных T-лимфоцитов отсутствуют антигены MHC класса II. При синдроме Вискотта—Олдрича снижена экспрессия антигена CD43, участвующего в активации T-лимфоцитов. Тяжелые иммунодефициты с недостаточностью клеточного иммунитета сопровождаются выраженным нарушением функции T-лимфоцитов, хотя абсолютное и относительное число этих клеток может быть нормальным.
Реакция бласттрансформации лимфоцитов (РБТЛ) Под действием митогенов, антигенов и аллогенных клеток покоящиеся T-лимфоциты активируются, превращаются в бластные клетки и начинают делиться. Спонтанная пролиферация лимфоцитов (бласттрансформация) бывает повышена у больных, перенесших многократные переливания крови, больных аллергическими и аутоиммунными заболеваниями, при бактериальных и вирусных инфекциях, а также у новорожденных.
Смешанную культуру лимфоцитовприменяют для оценки способности T-лимфоцитов распознавать антигены HLA аллогенных B-лимфоцитов и моноцитов. Стимулирующие клетки (аллогенные B-лимфоциты) инактивируют облучением или митомицином. Реакция лимфоцитов больного оценивается по включению в ДНК меченого тимидина.
Биохимические исследования При подозрении на комбинированную недостаточность гуморального и клеточного иммунитета определяют активность аденозиндезаминазы и пуриннуклеозидфосфорилазы (участвуют в метаболизме нуклеозидов). При атаксии-телеангиэктазии почти всегда повышен уровень альфа-фетопротеина в сыворотке, что позволяет дифференцировать это заболевание с другими нервными болезнями. К редким метаболическим нарушениям, сопровождающимся недостаточностью клеточного иммунитета, относятся оротовая ацидурия и биотин-зависимая недостаточность карбоксилаз (проявляется алопецией и неврологическими нарушениями). При недостаточности транскобаламина II (участвует в транспорте витамина B12) поражаются быстрообновляющиеся ткани, поэтому для этого заболевания характерны недостаточность гуморального иммунитета, нарушения кроветворения (анемия, тромбоцитопения), понос и отставание в развитии.
Генетические исследованияУ больных с тяжелой недостаточностью клеточного иммунитета возможен химеризм (существование клеток разных генотипов в одном организме). Он возникает при попадании материнских клеток крови в кровь плода, переливании компонентов крови и трансплантации костного мозга. Если в крови больного содержатся клетки человека противоположного пола, химеризм легко выявить, обнаружив клетки с женским и мужским кариотипами. В остальных случаях проводят типирование клеток крови больного по HLA. Это исследование также позволяет выявить отсутствие антигенов HLA класса II на активированных T-лимфоцитах при синдроме обнаженных лимфоцитов.
Сканирующая электронная микроскопия выявляет T-лимфоциты, на поверхности которых нет микроворсинок, что характерно для синдрома Вискотта—Олдрича.
Биопсия тимусапроизводится в ряде случаев для подтверждения диагноза тяжелого комбинированного иммунодефицита. При недостаточности клеточного иммунитета в тимусе определяются скопления ретикулоэпителиальных клеток, отсутствие телец Гассаля и четкой границы между корковым и мозговым веществом, резкое снижение числа тимоцитов.
Биопсия лимфоузловПри недостаточности клеточного иммунитета в биоптате лимфоузла выявляется опустошение паракортикальной зоны. Из-за риска раневой инфекции и осложнений анестезии биопсию лимфоузлов проводят только в том случае, когда другие лабораторные исследования не позволяют подтвердить диагноз.
Исследование фагоцитозапоказано при хронических и рецидивирующих бактериальных инфекциях, если исследование гуморального и клеточного иммунитета не выявило отклонений от нормы. Недостаточность фагоцитов может быть обусловлена нарушением миграции, хемотаксиса, адгезии фагоцитов, а также нарушением собственно фагоцитоза. Кроме того, недостаточность фагоцитов может быть обусловлена дефицитом опсонинов (антител и комплемента) и нарушением метаболизма фагоцитов.
Тест восстановления нитросинего тетразолияприменяется в диагностике хронической гранулематозной болезни. Суть метода заключается в следующем: к фагоцитам добавляют желтый краситель нитросиний тетразолий, в норме при его поглощении метаболическая активность фагоцитов возрастает, нитросиний тетразолий восстанавливается, продукты этой реакции окрашены в синий цвет. О нарушении метаболизма фагоцитов судят по снижению интенсивности синего окрашивания. При выявлении нарушений определяют уровень цитохрома b558 и других белков фагоцитов.
Хемилюминесценция также позволяет оценить функциональную активность фагоцитов. В норме при фагоцитозе появляется большое количество свободных радикалов кислорода, окисляющих субстрат, например компоненты клеточной стенки бактерий. Окисление сопровождается излучением видимого или ультрафиолетового света. По интенсивности излучения можно судить о функциональной активности фагоцитов.
Оценка фагоцитарной активности — наиболее информативный способ исследования опсонинов и функционального состояния фагоцитов. В норме в течение 2 ч фагоцитами поглощается и разрушается около 95% бактерий. При хронической гранулематозной болезни число разрушенных бактерий не превышает 10%, а внутри лейкоцитов обнаруживаются жизнеспособные бактерии. Присутствие живых бактерий в лейкоцитах при инкубации с сывороткой здорового свидетельствует о нарушении переваривания бактерий в отсутствие снижения способности к захвату бактерий. Повышенное содержание жизнеспособных бактерий в надосадочной жидкости при инкубации с сывороткой больного свидетельствует о дефиците опсонинов.
Хемотаксис лейкоцитов Нарушение хемотаксиса может быть обусловлено дефектом фагоцитов, наличием ингибиторов хемотаксиса, дефицитом сывороточных или тканевых факторов хемотаксиса.
Для исследования хемотаксиса лейкоцитов применяютметод кожного окна. Исследование хемотаксиса in vitro основано на стимуляции выделенных из крови фагоцитов факторами хемотаксиса. Способность фагоцитов к направленной миграции можно оценить, поместив их в камеру Бойдена или чашку Петри с агарозой.
Адгезия лейкоцитовНарушение адгезии лейкоцитов обусловлено снижением экспрессии или отсутствием на их поверхности молекул адгезии, например CD11/CD18. Для определения молекул адгезии применяют проточную цитофлюориметрию. Отсутствие CD11/CD18 на нейтрофилах и моноцитах проявляется поздним отпадением пуповины, рецидивирующими бактериальными инфекциями, пародонтитом.
Диагностика асплении.Селезенка играет важную роль в защите от инфекции, так как содержит огромное количество макрофагов и плазматических клеток. У больных с аспленией часто наблюдается сепсис, в мазках крови выявляются деформированные эритроциты и тельца Говелла—Жолли. Асплению выявляют с помощью ультрасонографии.
Другие исследования.Определение активности миелопероксидазы, глутатионпероксидазы, лизоцима, Г-6-ФД, пируваткиназы и электронную микроскопию проводят для выявления незначительных нарушений функций фагоцитов и в научных целях. При нейтропении показаны повторные определения числа лейкоцитов в крови, определение числа лейкоцитов в крови после введения кортикостероидов, адреналина и эндотоксина, определение антител к лейкоцитам, исследование костного мозга.
Исследование костного мозгапроводят при стойкой лейкопении или лейкоцитозе, изменении морфологии лейкоцитов, выявлении бластных форм в крови.
Исследование комплементаЕсли данные анамнеза и основных лабораторных исследований указывают на недостаточность комплемента, показано его углубленное исследование. Оно включает количественное определение и функциональную оценку компонентов комплемента, исследование альтернативного пути активации комплемента, определение опсонинов и факторов хемотаксиса в сыворотке. О дефиците опсонинов в исследуемой сыворотке свидетельствует ее неспособность усиливать фагоцитоз бактерий и дрожжевых грибов нормальными лейкоцитами.
Пренатальная диагностика и генетическое консультированиеНа сегодняшний день установлено, что многие иммунодефициты являются наследственными заболеваниями: известен тип их наследования, выявлена локализация дефектного гена, определен продукт этого гена (табл. 2). В настоящее время стало возможным выявление носительства дефектного гена. Так, гетерозиготное носительство дефектного гена, кодирующего какой-либо фермент, можно выявить по снижению активности этого фермента, например при аутосомно-рецессивном тяжелом комбинированном иммунодефиците снижена активность аденозиндезаминазы, при хронической гранулематозной болезни — ферментов дыхательной цепи, при X-сцепленной агаммаглобулинемии — тирозинкиназы в B-лимфоцитах. Выявлен также целый ряд дефектов, не связанных с нарушением синтеза ферментов, например при X-сцепленном тяжелом комбинированном иммунодефиците — нарушен синтез гамма-цепи рецептора к интерлейкину-2, синдроме гиперпродукции IgM — синтез гликопротеида клеточной мембраны gp39 — лиганда рецептора CD40 B-лимфоцитов. У девочек с X-сцепленными иммунодефицитами, проявляющимися нарушением дифференцировки лимфоцитов (X-сцепленная агаммаглобулинемия, X-сцепленный тяжелый комбинированный иммунодефицит, синдром Вискотта—Олдрича), в крови выявляются как дифференцированные, так и недифференцированные лимфоциты. Это обусловлено тем, что X-хромосома, несущая дефектный ген, инактивирована лишь в части клеток. Наличие недифференцированных лимфоцитов в отсутствие клинических проявлений этих иммунодефицитов указывает на носительство дефектного гена. Анализ полиморфизма длин рестрикционных фрагментов также позволяет выявить носителей дефектного гена в семье.
Лабораторные методы пренатальной диагностики основаны на исследовании клеток пуповинной крови и околоплодных вод, а также ворсин хориона. Так, при всех формах тяжелого комбинированного иммунодефицита в пуповинной крови отсутствуют T-лимфоциты, при синдроме Вискотта—Олдрича обнаруживаются тромбоцитопения и T-лимфоциты, лишенные микроворсинок. В табл. 2 указан тип наследования и возможность применения генетических методов для диагностики некоторых первичных иммунодефицитов.
Т-клеточный
имунитет.
Дифференцировка
и функционирование Т-клеток (лимфоцитов).
Клетки иммунной системы включают в себя
лимфоциты, мон/макрофаги, гранулоциты.
Они различаются морфологически,
биохимически и функционально. ОБщее
их свойство- обеспечение иммунитета.
Все они происходят из ПСК. Зрелые
лимфоциты состоят из 2-х больших популяций:
тимусзависимые (Т-лимфоциты),дифференцирующиеся
в тимусе; тимуснезависимые.
(В-лимфоциты), дифференцирующиеся в
бурсе (у человека, возможно, в костном
мозге, АкЛТ).
Среди клеточных элементов иммунной
системы лидерство, как по количественным,
так и по функциональным параметрам
принадлежит Т-лимфоцитам, количество
которых составляет в периферической
крови от 60 до
80%общей
численности лимфоидных клеток. Зрелые
Т-лимфоциты диаметром около
6,5 мкм, ядро плотное, интенсивно
окрашенное, занимает всю клетку,
эксцентрически располагается почти
отсутствующая цитоплазма. Исследование
в сканирующем микроскопе показало, что
Т-лимфоциты имеют почти гладкую
поверхность, lg-рецепторов
на их поверхности в 100-1 000
раз меньше чем на В-лимфоцитах. В-клетки
больших размеров до 8.5
мкм, ядро менее интенсивно окрашено,
не содержит ядрышка, цитоплазма больших
размеров, базофильна. В-лимфоциты имеют
отростчатую поверхность за счет большой
плотности lg-рецепторов.
Функционально Т-лимфоциты определяют
практически полный спектр клеточных
реакций иммунитета, эффекторную функцию,
включая реакции гиперчувствительности
замедленного типа, реакции
противоопухолевого и трансплантационного
иммунитета, принимают участие в регуляции
функциональной активности кроветворных
стволовых клеток, В-лф. Это клетки,
которые осуществляют рецепцию антигена
и запуск иммунного ответа.
Функции Т-лимфоцитов.
1)эффекторной функции Т-лимфоциты
выполняют
2)иммунорегуляторную функцию.
3) взаимодействие с
макрофагами (АПК) —
распознавание антигена и запуск имунного
ответа.
4) продукция цитокинов,
регулирующих не только межсистемные
взаимодействия, но и многие жизненно
важные процессы в организме (например
Т-лимфоциты через продукцию ИЛ-3
воздействуют на самые ранние процессы
гемопоэза ).
Одной из особенностей Т-лимфоцитов
является их гетерогенность.
Среди Т-клеток выделяют:
регуляторы Тх/Тс;
Т-индукторы (Тинд,Тh1,Тh2);
Т-цитотоксические. Т-эффекторы ГЗТ.
Т-дифференцирующие (Т-амплифайеры) и
др.
Т-индукторы — клетки,
сходные по многим характеристикам
(морфологическим, функциональным)
с Т-хелперами, но активирующие другие
типы клеток, в частности Т-супрессоры.
Т-клетки замедленной
гиперчувствительности
— эти клетки
обеспечивают приток макрофагов в
локальные участки, например, на коже,
слизистых, где развивается клеточная
иммунная реакция по типу ГЧЗТ
(туберкулиновая проба и т.д.).
Т-клеточный рецептор для антигена TCR
В отличие от антигенраспознающих
рецепторов В-лимфоциты (молекулы
мембранных 1д) Т-лимфоциты имеют
специфический рецептор для антигена
-TCR. По строению молекулы
TCR оказались близкими молекулам
Ig и МНС.
В состав рецептора TCR
входит:
антигенрасопзнающий рецептор и молекула
CD3 в комплексе с молекулой
ГКГ 1 и II
класса. Молекула CD3,
связанная с TCR, вероятно,
осуществляет передачу сигнала от
TCR к внутриклеточным эффекторным
системам .
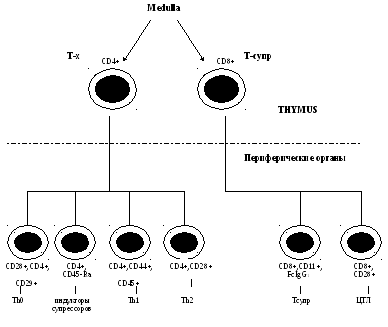
Онтогенез
Т-лимфоцитов.

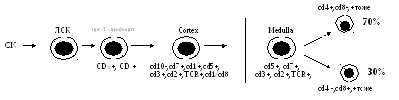
В костном мозге на пре-Т-лимфоцит
появляется самый ранний маркер
Т-лимфоцитов — CD7+(это
рецептор к µ-цепи Fc
фрагмента IgM). Ранние
предшественники мигрируют из костного
мозга через кровоток в тимус под действием
гормонов тимуса, где происходит их
размножение, созревание, образование
зрелых Т-лимфоцитов, оттуда миграция в
кровь, заселение периферических органов
.Только 5-10% пройдет позитивную селекцию,
90-95%- погибнет, а затем только начнется
заселение зон организма.
В тимус пре-Т поступают из сосудов,
расположенных между корковым и мозговым
веществом, где они первоначально
взаимодействуют с дендритными
клетками и макрофагами, а затем после
миграции в субкортикальный слой
-с эпителиальными клетками-«няньками»,
после чего начинается их активная
пролиферация.
Т-лимфоциты не вступившие во взаимодействие
с антигенами называют наивными, а
подвергнувшиеся действию гормонов и
т.д.- армированными.
Периферические
органы иммунной системы

В процессе созревания тимоцитов, их
взаимодействие с эпителиальными
клетками тимуса (клетки-«няньки»)
они учатся распознавать антиген,
экспрессир. антигенраспоэнающий
рецептор — позитивная
селекция {У/о клеток).
«Негативная селекция»-
(95%) — клетки, которые не научились
распознавать антиген, они имеют
рецепторы к аутоантигенам. На
дифференци-ровку (созревание) клеток в
тимусе влияют гуморальные факторы
тимуса и стромы. Гуморальные факторы
тимуса: тимозин, тимопоэтин, тимический
гормональный фактор, тимостимулин,
сывороточный тимический фактор, ИЛ-3.
Стромальные факторы: в медуллярной
зоне тимуса имеются макрофаги,
дендритные клетки тимуса.
Маркеры—
поверхностные структуры (или
внутриклеточные), характеризующие
как отдельные типы лимфоцитов, так и
определенные этапы их развития.
Варианты маркеров:
1) поверхностные антигены,
в т.ч. дифференцировочные, появляющиеся
и исчезающие в зависимости от стадии
развития клетки или сохраняющиес
на всех стадиях клеточного цикла;
2) поверхностные рецепторы
( распознающие структуры), с помощью
которых клетки узнают антиген и
воспринимают другие стимулы, необходимые
для их жизнедеятельности.
Важнейшими маркерами Т-лимфоцитов
служат рецепторы, которые отличаются
по строению, функциональному назначению
и разделены на 3 группы
1)антигенраспознающие рецепторы на Тлф
— (TCP.), на Влф
— рец.Тд
природы; позволяют специфически
распознавать антиген;
2) рецепторы для
иммунологически значимых продуктов
иммунной системы (рец. к Fclg,CI-C9,
лимфокинов цк и др.) —
необходимы для реализации различных
функций иммунной системы;
3) рецепторы для продуктов
неиммунного происхождения (гормонов,
нейропептидов и др.), рецепторы адгезии.
Методы идентификации Т-клеток.
Для выделения Т-лимфоцитов из пула
клеток крови или других тканей используют
различные приемы:
1) РОК
2) МКА
3 ) цитофлюорометрия
4) по рец. к Fc
lg-на Тх-Fc
lgM; -Т на Те-Fc
lgG; -Т
Патология в системе Т-клеточного
иммунитета.
— врожденная недостаточность
Т-лимфоцитов (первичный ИД
— Т-КИН, синдром Ди-Джорджа, синдром
атаксии-телеангиоэктазии и др);
— инфицирование Т-клеток
вирусом ВИЧ, острого лимфолейкоза
взрослых ;
— Т-клеточные
иммунопролиферативные заболевания
(варианты острого лимфолейкоза,
Т-клеточные лимфомы и Др.)-
— врожденные и приобретенные
дефекты Т-клеточного антигенраспоз-нающего
рецепторного комплекса или его отдельных
субъединиц, адгезив-ных молекул,
дефектность механизмов «обучения»
Т-лф в тимусе ( блок
позитивной и/или негативной селекции
тимических лимфоцитов) ;
— нарушение соотношения
регул. Т-лимфоцитов (CD4 и
008), субпопуляций с превышением
функции хелперно-индуцирующих клеток
— аутоиммун-ная и аллергическая
направленность или
супрессорно-ЦТК-иммунодефицит-ная
направленность иммунопатологии;
— приобретенные тимусзависимые
ИДС (удаление тимуса, поражение Т-клеток
физическими, фармакологическими и
другими методами, опухоли, нарушение
питания, инфекции, возрастные изменения
и др.);
— преактивация Т-лимфоцитов
in vivo (факторы
микроорганизмов, ау-тоантитела против
структур Т-клеток, фармакологические
средства и др.) с развитием аутоиммунных
процессов, повышенной продукцией ЦК,
актив, мф — усиление
воспалительных, деструктивных процессов).
3
