Основные функции клеток врожденного иммунитета

Английское слово «иммунитет», которым определяют все механизмы, используемые организмом для защиты от чужеродных агентов из окружающей среды, происходит от латинского термина «immunis», означающего «освобожденный». Эти агенты могут представлять собой микроорганизмы или их продукты, пищевые продукты, химические вещества, лекарства, пыльцу или чешуйки и шерсть животных. Иммунитет может быть врожденным или приобретенным.
Врожденный иммунитет
Врожденный иммунитет поддерживается всеми элементами, с которыми рождается человек и которые всегда присутствуют и по первому требованию доступны для защиты организма от чужеродных агрессоров. В табл. 1.1 суммируются и сравниваются некоторые свойства врожденной и адаптивной иммунных систем. Элементами врожденной системы являются оболочки тела и его внутренние компоненты, такие как кожа и слизистые оболочки, кашлевый рефлекс, которые представляют эффективный барьер для чужеродных агентов.
Эффективными химическими барьерами против проникновения многих микроорганизмов являются кислотность (рН) и выделяемые жирные кислоты. Другим неклеточным элементом врожденной иммунной системы является система комплемента.
Таблица 1.1. Основные свойства врожденной и адаптивной иммунных систем
| Свойство | Врожденная система | Адаптивная система |
| Характеристики | Антигеннеспецифическая Быстрый ответ (минуты) Нет памяти | Антигенспецифическая Медленный ответ (дни) Память |
| Иммунные компоненты | Естественные барьеры (например, кожа) Фагоциты Растворимые медиаторы (например, комплемент) Молекулы, распознающие структуры, характерные для патогенов | Лимфоциты Антигенраспознающие молекулы (рецепторы В- и Т-клеток) Секретируемые молекулы (например, антитела) — |
Существуют и другие многочисленные компоненты врожденного иммунитета: лихорадка, интерфероны, другие вещества, высвобождаемые лейкоцитами, и молекулы, распознающие структуры патогенов, которые могут связываться с разными микроорганизмами (Тоll-подобные рецепторы или TLR), а также белки сыворотки, например В-лизин, фермент лизоцим, полиамины и кинины.
Все перечисленные элементы либо непосредственно действуют на патогенный объект, либо усиливают реакцию организма на него. К другим компонентам врожденного иммунитета относятся фагоцитирующие клетки, такие как гранулоциты, макрофаги и микроглиальные клетки центральной нервной системы (ЦНС), которые участвуют в разрушении и удалении чужеродного материала, проникающего сквозь физические и химические барьеры.
Приобретенный иммунитет
Приобретенный иммунитет более специализирован, чем врожденный, и поддерживает защиту, создаваемую врожденным иммунитетом. С точки зрения эволюции приобретенный иммунитет появляется относительно поздно и имеется только у позвоночных.
Хотя индивидуум уже рождается со способностью запускать иммунный ответ на чужеродное вторжение, приобретается иммунитет только при контакте с вторгшимся объектом и специфичен именно к нему; отсюда и его название — приобретенный иммунитет.
Первоначальный контакт с чужеродным агентом (иммунизация) запускает цепь событий, которые ведут к активации лимфоцитов и других клеток, а также к синтезу белков, некоторые из которых обладают специфической реактивностью против чужеродного агента. В этом процессе индивидуум приобретает иммунитет, который позволяет противостоять последующей атаке или защищает при повторной встрече с этим же агентом.
Открытие приобретенного иммунитета определило появление многих концепций современной медицины. В течение столетий признавалось, ч го люди, которые не умирали от таких смертельно опасных заболеваний, как бубонная чума и оспа, были в последующем более устойчивы к заболеванию, чем люди, которые не встречались с ними ранее.
Окончательное открытие приобретенного иммунитета приписывают английскому врачу Э.Дженнеру (E.Jenner), который в конце XVIII в. экспериментально вызвал иммунитет к оспе. Если бы Э.Дженнер проводил свой эксперимент сегодня, его медицинская лицензия была бы аннулирована, а он сам стал бы подсудимым на сенсационном судебном процессе: он ввел маленькому мальчику гной из очага поражения у молочницы, которая болела коровьей оспой — относительно доброкачественным заболеванием, родственным оспе.
Затем он намеренно заразил мальчика оспой. Но контакт с возбудителем не вызвал заболевания! В связи с защитным эффектом введения возбудителя коровьей оспы (vaccinia от латинского слова «vacca», означающего «корова») процесс получения приобретенного иммунитетa был назван вакцинацией.
Теорию вакцинации или иммунизации развили Л. Пастер и П. Эрлих почти 100 лет спустя после эксперимента Э.Дженнера. К 1900 г. стало ясно, что иммунитет может быть вызван не только к микроорганизмам, но и к их продуктам. Сейчас мы знаем, что он может развиться против бесчисленного количества естественных и синтетических веществ, включая металлы, химические вещества с относительно низкой молекулярной массой, углеводы, белки и нуклеотиды.
Вещество, к которому возникает иммунная реакция, называется антигеном. Этот термин был создан для демонстрации способности вещества генерировать продукцию антител. Конечно, в настоящее время известно, что антигены могут генерировать реакции, опосредованные и антителами, и Т-клетками.
Активная, пассивная и адоптивная иммунизация
Приобретенный иммунитет индуцируется путем иммунизации, которая может достигаться несколькими путями.
- Активная иммунизация — иммунизация индивидуума путем введения антигена.
- Пассивная иммунизация — иммунизация посредством переноса специфических антител от иммунизированного к неиммунизированному индивидууму.
- Адоптивная иммунизация — перенос иммунитета путем переноса иммунных клеток
Характеристики приобретенного иммунного ответа
Приобретенный иммунный ответ имеет несколько общих черт, характеризующих его и отличающих от других физиологических систем, таких как циркуляторная, респираторная и репродуктивная. Это следующие черты:
- специфичность — это способность распознавать определенные молекулы среди многих других и реагировать только на них, избегая таким образом случайного недифференцированного ответа;
- адаптивность — способность реагировать на ранее не встречавшиеся молекулы, которые в действительности могли бы и не существовать на Земле в естественной среде;
- распознавание между «своим» и «чужим» — главное свойство специфичности иммунного ответа; способность узнавать и реагировать на чужеродные («чужие») молекулы и избегать реакции на собственные. Это распознавание и узнавание антигенов передается специализированными клетками (лимфоцитами), которые несут на своей поверхности антигенспецифические рецепторы;
- память — способность (как и у нервной системы) вспоминать предыдущий контакт с чужеродной молекулой и реагировать на нее уже известным образом, однако с большими силой и скоростью. Для описания иммунологической памяти используют термин «анамнестический ответ».
Клетки, участвующие в приобретенном иммунном ответе
В течение многих лет иммунология оставалась эмпирической наукой, в которой эффекты введения различных веществ в живые организмы исследовались главным образом с точки зрения получаемых продуктов. Основной прогресс был достигнут с появлением количественных методов выявления этих продуктов иммунного ответа. В 1950-х гг. после открытия того, что лимфоциты являются клетками, играющими основную роль в иммунном ответе, акценты в иммунологии резко сместились и в ней выделилась новая область — клеточная иммунология.
В настоящее время установлено, что существуют три основных типа клеток, вовлеченных в приобретенный иммунный ответ, и для индукции полноценного иммунного ответа необходимо сложное взаимодействие между ними. Из них клетки двух типов имеют общую лимфоидную клетку-предшественник, но в дальнейшем их дифференцировка идет по разным направлениям. Одна линия клеток созревает в тимусе, и их относят к Т-клеткам.
Другие созревают в костном мозге и относятся к В-клеткам. Клетки В- и Т-лимфоцитарных линий различаются по многим функциональным признакам, но имеют в иммунном ответе одну важную способность, а именно: обладают специфичностью относительно антигена. Таким образом, в иммунном ответе основные функции — распознавание и реагирование — выполняют лимфоциты.
Антигенпрезентирующие клетки (АПК), такие как макрофаги и дендритные клетки, относятся к третьему типу клеток, участвующих в приобретенном иммунном ответе. Хотя на этих клетках нет антигенспецифических рецепторов, как у лимфоцитов, они выполняют важную функцию — процессируют (перерабатывают) и презентируют антиген специфическим рецепторам (Т-клеточным рецепторам) на Т-лимфоцитах. Антигенпрезентирующие клетки имеют на своей поверхности два типа специальных молекул, участвующих в презентации антигена.
Эти молекулы, называемые молекулами главного комплекса гистосовместимости (major histocompatibility complex — МНС) I и II классов, кодируются набором генов, которые отвечают также за отторжение или приживление трансплантированной ткани. Процессированный антиген нековалентно связывается с молекулами МНС I или II класса (или обеими). Антиген, представляемый на молекулах МНС 1 класса, презентируется и участвует в активации одной из субпопуляций Т-клеток (цитотоксических Т-клеток), в то время как антиген, процессируемый и экспрессируемый на АПК в комплексе с молекулами МНС II класса, приводит к активации другой субпопуляции (Т-клетки-хелперы).
Кроме того, в иммунных ответах участвуют и клетки других типов, такие как нейтрофилы и тучные клетки. В действительности, они принимают участие как в реакциях врожденного, так и приобретенного иммунитета. В основном они вовлечены в эффекторную фазу реакции. Эти клетки не способны специфически распознавать антиген Они активируются различными субстанциями, называемыми цитокинами, которые высвобождаются другими клетками, в том числе активированными антигенспенифическими лимфоцитами.
Клонально-селекционная теория
Поворотным пунктом в иммунологии стало распространение в 1950-е гг. дарвиновской теории на клеточную основу специфичности при иммунном ответе. Это была повсеместно принятая в настоящее время клонально-селекционная теория, предложенная и развитая Ерне (Jerne) и Бернетом (Burnet) (оба лауреаты Нобелевской премии), а также Толмеджем (Talmage). Основные постулаты этой теории суммируются далее.
Специфичность иммунного ответа основывается на способности его компонентов (а именно антигенспецифичных Т- и В-лимфоцитов) распознавать определенные чужеродные молекулы (антигены) и реагировать на них, чтобы устранить. Неотъемлемой частью этой теории является необходимость клональной делеции (выбраковки, удаления) лимфоцитов, способных быть аутореактивными. При отсутствии такого механизма постоянно возникали бы аутоиммунные реакции. К счастью, лимфоциты с рецепторами, связывающимися с собственными антигенами, устраняются на ранних стадиях развития, повышая таким образом толерантность к структурам собственного организма (рис. 1.1).
Поскольку, как указано ранее, иммунная система способна распознавать огромное множество чужеродных антигенов, остается выяснить, как осуществляется реакция на какой-либо один антиген. В дополнение к уже доказанному постулату, что аутореактивные клоны лимфоцитов инактивируются, клонально-селекционная теория предполагает:
- что Т- и В-лимфоциты, отличающиеся огромным разнообразием специфичностей, существуют еще до того, как произошел какой-либо контакт с инородным антигеном;
- лимфоциты, участвующие в иммунном ответе, имеют антигенспецифичные рецепторы на своих поверхностных мембранах. В результате связывания антигена с лимфоцитом клетка активируется и высвобождает различные вещества. В случае В-лимфоцитов рецепторами являются молекулы (антитела), обладающие той же специфичностью, что и антитела, которые клетка в дальнейшем будет производить и секретировать. Т-клетки обладают рецепторами, называемыми Т-клеточными рецепторами (Т cell receptors — TCR). В отличие от В-клеток Т-лимфоциты продуцируют вещества, отличающиеся от их поверхностных рецепторов и являющиеся другими белковыми молекулами, называемыми цитокинами. Они участвуют в устранении антигена путем регуляции других клеток, необходимых для организации эффективной иммунной реакции;
- каждый лимфоцит несет на своей поверхности рецепторные молекулы только одной специфичности, как показано на рис. 1.1 для В-клеток, что также справедливо для Т-клеток.
Указывается на существование широкого спектра возможных различий по специфичности, формируемых в процессе размножения и дифференцировки до того, как происходит какой-либо контакт с чужеродной субстанцией, на которую должна быть реакция.
В ответ на ведение чужеродного антигена из всех имеющихся разновидностей (специфичностей) отбираются те, которые специфичны для антигена и делают возможным его связывание (см. рис. 1.1). Схема, показанная на рис. 1.1 для В-клеток, также подходит для Т-клеток, однако Т-клетки имеют рецепторы, не являющиеся антителами, и секретируют молекулы, не являющиеся антителами.

Рис. 1.1. Теория клональной селекции В-клеток, вырабатывающих антитела
Оставшиеся постулаты клонально-селекционной теории объясняют процесс селекции антигеном клеток из всего репертуара доступных клеток.
- Иммунокомпетентные лимфоциты соединяются с чужеродным антигеном или его частью, называемой эпитопом, посредством своих поверхностных рецепторов. В соответствующих условиях идет стимуляция их пролиферации и дифференцировки в клоны клеток с соответствующими идентичными рецепторами к определенной части антигена, называемой антигенной детерминантой или эпитопом. У В-клеточных клонов это приводит к синтезу антител, имеющих совершенно одинаковую специфичность Комплекс антител, секретируемых разными клонами, составляет поликлональную антисыворотку, способную взаимодействовать с множеством эпитопов, представленных на антигене. Т-клетки будут таким же образом отбираться соответствующими антигенами или их участками. Каждая селектированная Т-клетка будет активироваться, чтобы делиться и образовать клоны той же самой специфичности. Таким образом, в клональном ответе на антиген количество реагирующих клеток будет умножено, а образовавшиеся клетки будут высвобождать различные цитокины. Последующий контакт с тем же антигеном приведет к активации многих клеток или клонов той же специфичности. Вместо синтеза и высвобождения антител, как у В-клеток, Т-клетки синтезируют и высвобождают цитокины. Эти цитокины, являющиеся растворимыми медиаторами, осуществляют свое воздействие на другие клетки, заставляя их расти или активироваться для дальнейшего устранения антигена. Распознаваться могут несколько отделенных друг от друга участков антигена (эпитопов), соответственно для создания антител к ним будут стимулироваться несколько различных клонов В-клеток, которые в свою очередь все вместе будут создавать антигенспецифическую антисыворотку, объединяющую антитела различной специфичности (см. рис. 1.1). Все клоны Т-клеток, распознающие различные эпитопы на том же антигене, будут активироваться для выполнения своей функции.
- Последний постулат был добавлен для объяснения способности к распознаванию собственных антигенов без возникновения реакции.
- Циркулирующие аутоантигены, попадающие в места развития незрелых лимфоцитов до того, как начнется определенный этап их созревания, обеспечивают «выключение» тех клеток, которые будут специфически распознавать эти аутоантигены и, таким образом, предотвратят начало последующего иммунного ответа.
Сформулированная таким образом клонально-селекционная теория оказала поистине революционное воздействие на иммунологию и изменила подход к ее изучению.
Р.Койко, Д.Саншайн, Э.Бенджамини
Опубликовал Константин Моканов
Врождённый
иммунитет — наиболее ранний защитный
механизм как в эволюционном плане (он
существует практически у всех
многоклеточных), так и по времени ответа,
развивающегося в первые часы и дни после
проникновения чужеродного материала
во внутреннюю среду, т.е. задолго до
развития адаптивной иммунной реакции.
Значительную часть патогенов инактивируют
именно врождённые механизмы иммунитета,
не доводя процесс до развития иммунного
ответа с участием лимфоцитов. И только
если механизмы врождённого иммунитета
не справляются с проникающими в организм
патогенами, в «игру» включаются лимфоциты.
При этом адаптивный иммунный ответ
невозможен без вовлечения механизмов
врождённого иммунитета. Кроме того,
врождённый иммунитет играет главную
роль в удалении апоптотических и
некротических клеток и реконструировании
повреждённых органов. В механизмах
врождённой защиты организма важнейшую
роль играют первичные рецепторы для
патогенов, система комплемента, фагоцитоз,
эндогенные пептиды-антибиотики и факторы
защиты от вирусов — интерфероны. Функции
врождённого иммунитета схематично
представлены на рис. 3-1.
Рецепторы распознавания «чужого»
На
поверхности микроорганизмов
присутствуют повторяющиеся
молекулярные углеводные и липидные
структуры, которые
в подавляющем большинстве случаев
отсутствуют на клетках организма
хозяина. Особые рецепторы, распознающие
этот «узор» на поверхности патогена, —
PRR (Pattern
Recognition Receptors –РRP-рецептор)
— позволяют клеткам врождённого иммунитета
обнаруживать микробные клетки. В
зависимости от локализации выделяют
растворимые и мембранные формы PRR.
• Циркулирующие
(растворимые) рецепторы для
патогенов — белки сыворотки крови,
синтезируемые печенью: липополисахаридсвязывающий
белок (LBP — Lipopolysaccharide
Binding Protein), компонент
системы комплемента C1q и белки острой
фазы MBL и С-реактивный белок (СРБ). Они
непосредственно связывают микробные
продукты в жидких средах организма и
обеспечивают возможность их поглощения
фагоцитами, т.е. являются опсонинами.
Кроме того, некоторые из них активируют
систему комплемента.
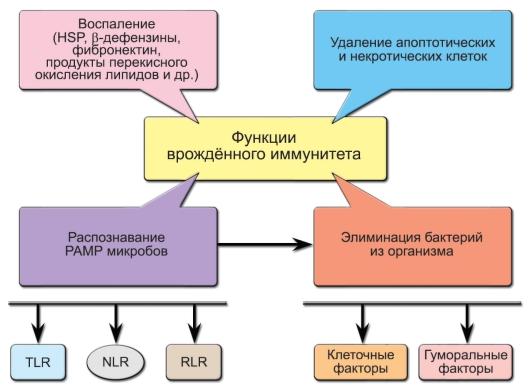
Рис.
3-1. Функции
врождённого иммунитета. Обозначения:
PAMP (PathogenAssociated
Molecular Patterns) —
молекулярные структуры микроорганизмов,
HSP (Heat
Shock Proteins) —
белки теплового шока, TLR (Toll-Like
Receptors), NLR (NOD-Like
Receptors), RLR (RIG-Like
Receptors) —
клеточные рецепторы
— СРБ, связывая
фосфорилхолин клеточных стенок ряда
бактерий и одноклеточных грибов,
опсонизирует их и активирует систему
комплемента по классическому пути.
— MBL принадлежит
к семейству коллектинов. Имея сродство
к остаткам маннозы, экспонированным на
поверхности многих микробных клеток,
MBL запускает лектиновый путь активации
комплемента.
— Белки
сурфактанта лёгких — SP-A и SP-D принадлежат
к тому же молекулярному семейству
коллектинов, что и MBL. Они, вероятно,
имеют значение в опсонизации (связывании
антител с клеточной стенкой микроорганизма)
лёгочного патогена — одноклеточного
грибка Pneumocystis
carinii.
• Мембранные
рецепторы. Эти
рецепторы расположены как на наружных,
так и на внутренних мембранных структурах
клеток.
— TLR (Toll-Like
Receptor —
Toll-подобный рецептор; т.е. сходный с
Toll-рецептором дрозофилы). Одни из них
непосредственно связывают продукты
патогенов (рецепторы для маннозы
макрофагов, TLR дендритных и других
клеток), другие работают совместно с
иными рецепторами: например, CD14 молекула
на макрофагах связывает комплексы
бактериального липополисахарида (ЛПС)
с LBP, а TLR-4 вступает во взаимодействие с
CD14 и передаёт соответствующий сигнал
внутрь клетки. Всего у млекопитающих
описано 13 различных вариантов TLR (у
человека пока только 10).
• Цитоплазматические
рецепторы:
— NOD-рецепторы (NOD1
и NOD2) находятся в цитозоле и состоят из
трёх доменов: N-концевого CARD-домена,
центрального NOD-домена (NOD — Nucleotide
Oligomerization Domain —
домен олигомеризации нуклеотидов) и
C-концевого LRR-домена. Различие между
этими рецепторами заключается в
количестве CARD-доменов. Рецепторы NOD1 и
NOD2 распознают мурамилпептиды — вещества,
образующиеся после ферментативного
гидролиза пептидогликана, входящего в
состав клеточной стенки всех бактерий.
NOD1 распознаёт мурамилпептиды с концевой
мезодиаминопимелиновой кислотой
(meso-DAP), которые образуются только из
пептидогликана грамотрицательных
бактерий. NOD2 распознаёт мурамилдипептиды
(мурамилдипептид и гликозилированный
мурамилдипептид) с концевым D-изоглутамином
или D-глутаминовой кислотой, являющиеся
результатом гидролиза пептидогликана
как грамположительных, так и
грамотрицательных бактерий. Кроме того,
NOD2 имеет сродство к мурамилпептидам с
концевым L-лизином, которые есть только
у грамположительных бактерий.
— RIG-подобныерецепторы (RLR, RIG-Like
Receptors): RIG-I (Retinoic
acid-Inducible Gene I),
MDA5 (Melanoma
Differentiation-associated Antigen 5)
и
LGP2 (Laboratory
of Genetics and Physiology 2).
Все
три рецептора, кодируемые этими генами,
имеют сходную химическую структуру и
локализуются в цитозоле. Рецепторы
RIG-I и MDA5 распознают вирусную РНК. Роль
белка LGP2 пока неясна; возможно, он
выполняет роль хеликазы, связываясь с
двуцепочечной вирусной РНК, модифицирует
её, что облегчает последующее распознавание
с помощью RIG-I. RIG-I распознаёт односпиральную
РНК с 5-трифосфатом, а также относительно
короткие (<2000 пар оснований) двуспиральные
РНК. MDA5 различает длинные (>2000 пар
оснований) двуспиральные РНК. Таких
структур в цитоплазме эукариотической
клетки нет. Вклад RIG-I и MDA5 в распознавание
конкретных вирусов зависит от того,
образуют ли данные микроорганизмы
соответствующие формы РНК.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
