Основные эффекторные механизмы клеточного иммунитета осуществляются
Клеточный иммунитет: активация Т-лимфоцитов и элиминация внутриклеточных микробов. Наивные Т-лимфоциты активируются антигеном и костимуляторами в периферических лимфоидных органах, пролиферируют и дифференцируются в эффекторные клетки, которые мигрируют в любой участок организма, где присутствует антиген.
Одной из наиболее ранних реакций хелперных Т-клеток CD4+ является секреция цитокина IL-2 и экспрессия его высокоаффинных рецепторов. IL-2 представляет собой фактор роста, который действует на эти Т-лимфоциты и стимулирует их пролиферацию, приводя к повышению числа антиген-специфических лимфоцитов.
Функции хелперных Т-клеток опосредованы комбинированным действием лиганда CD40 (CD40L) и цитокинов. После распознавания антигенов, презентированных макрофагами или В-лимфоцитами, хелперные Т-клетки CD4+ экспрессируют CD40L, взаимодействующий с CD40 на макрофагах или В-клетках и активирующий их.
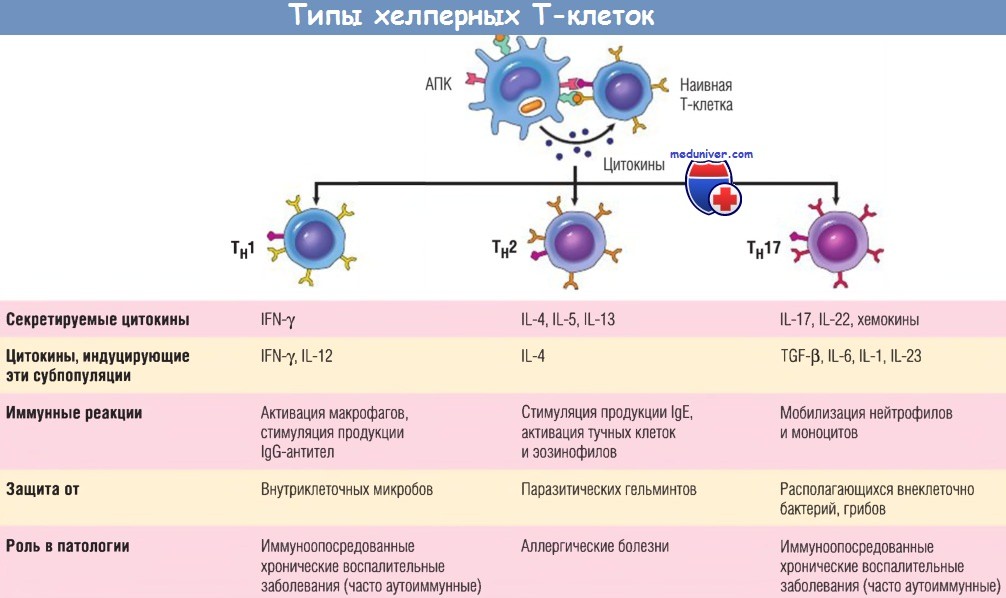
Некоторые из потомков размножившихся Т-клеток дифференцируются в эффекторные клетки, секретирующие различные наборы цитокинов и тем самым выполняющие различные функции. Лучше всего исследованы субпопуляции Тh1-клеток и Тh2-клеток — дифференцированных хелперных Т-клеток CD4+. Тh1 -клетки секретируют цитокин IFN-y, сильный активатор макрофагов.
Сочетание процессов активации, опосредованных CD40 и IFN-y, приводит к индукции микробицидных веществ в макрофагах, разрушающих поглощенные ими микробы. Тh2-клетки образуют IL-4, который стимулирует дифференцировку В-клеток в секретирующие IgE плазматические клетки, и IL-5, активирующий эозинофилы.
Эозинофилы и тучные клетки связываются с покрытыми IgE патогенами (например, с паразитическими гельминтами) и элиминируют паразитов. Третья субпопуляция Т-клеток CD4+, открытая недавно, получила название «субпопуляция Тh17-клеток», поскольку эти клетки продуцируют цитокин IL-17. Эти клетки характеризуются выраженной способностью мобилизовать нейтрофилы и моноциты и тем самым играют главную роль в некоторых воспалительных заболеваниях.
Также клетки осуществляют защиту от некоторых инфекций, вызываемых бактериями и грибами, при которых существенное значение имеет нейтрофильное воспаление. Образование и функции этих субпопуляций Т-клеток подробнее будут рассмотрены при обсуждении реакции гиперчувствительности.
Активированные лимфоциты CD8+ дифференцируются в цитотоксические Т-лимфоциты, которые уничтожают клетки, содержащие микробы. Разрушая инфицированные клетки, цитотоксические Т-лимфоциты устраняют резервуар инфекции.
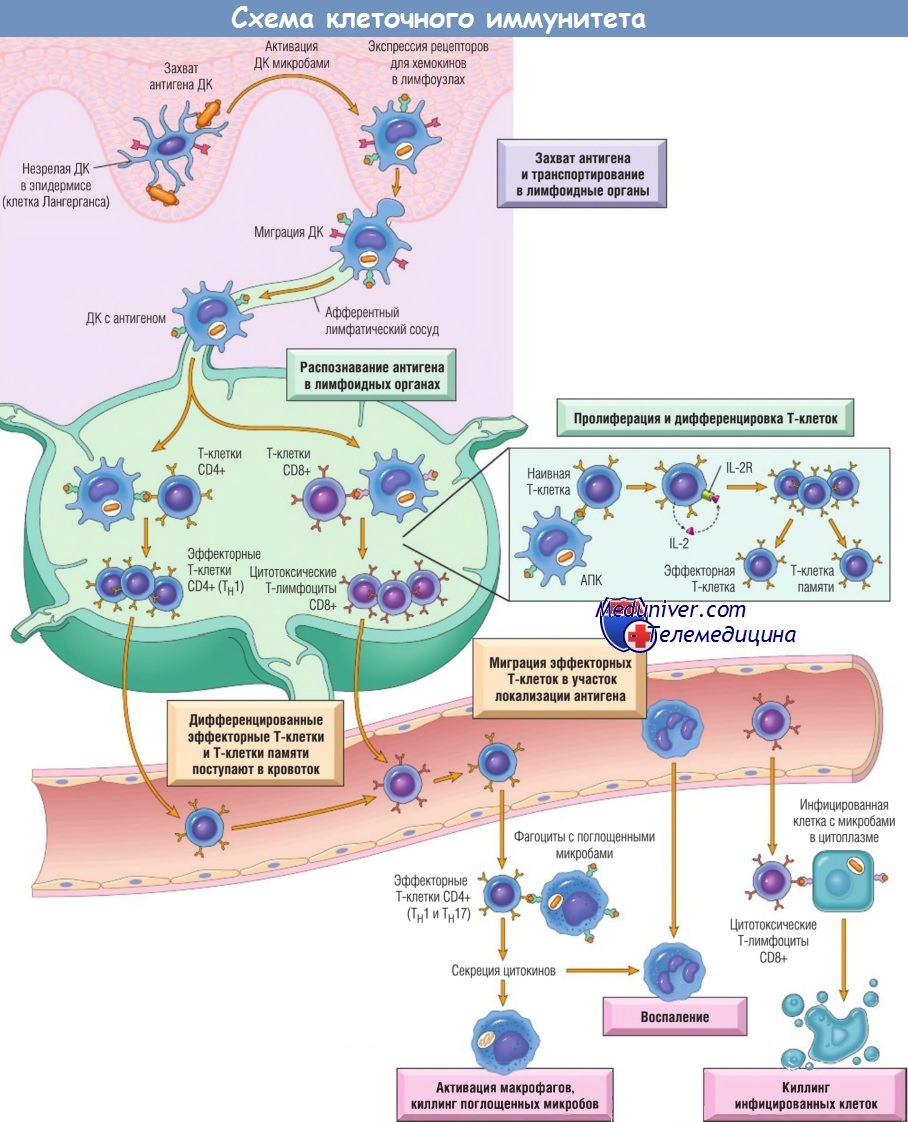
Клеточно-опосредованный иммунитет.
Дендритные клетки (ДК) захватывают микробные антигены в эпителии и тканях и транспортируют их в лимфоузлы.
В течение этого процесса ДК созревают и экспрессируют на высоком уровне молекулы МНС и костимуляторы.
Наивные Т-клетки распознают ассоциированные с МНС пептидные антигены, презентированные ДК.
Т-клетки активируются, пролиферируют и дифференцируются в эффекторные Т-клетки и Т-клетки памяти, мигрирующие в очаг инфекции и выполняющие разнообразные функции.
Эффекторные Т-клетки CD4+ субпопуляции ТН1 распознают антигены микробов, поглощенных фагоцитами, активируют их и индуцируют воспаление.
Цитотоксические Т-лимфоциты CD8+ убивают инфицированные клетки, содержащие микробы в цитоплазме.
На рисунке не показаны Тh2-клетки, имеющие особое значение в защите от гельминтов. Некоторые активированные Т-клетки дифференцируются в долгоживущие Т-клетки памяти.
Тh — хелперные Т-клетки; АПК — антиген-презентирующая клетка.

Субпопуляции хелперных Т-клеток (Тн).
В ответ на стимуляцию (осуществляемую главным образом цитокинами) во время распознавания антигена наивные Т-клетки CD4+ могут дифференцироваться в популяции эффекторных клеток, продуцирующих различные наборы цитокинов и выполняющих разные функции.
На рисунке в суммарном виде представлены основные иммунные реакции, вызываемые каждой субпопуляцией, и их роль в защите организма и при иммунологических заболеваниях.
IFN — интерферон; Ig — иммуноглобулин; IL — интерлейкин; TGF — трансформирующий фактор роста; АПК — антигенпрезентирующая клетка.
— Рекомендуем ознакомиться со следующей статьей «Механизмы гуморального иммунитета»
Оглавление темы «Реакции иммунного ответа»:
- Цитокины иммунной системы
- Механизм презентации и распознавания антигенов лимфоцитами
- Механизмы клеточного иммунитета
- Механизмы гуморального иммунитета
- Механизмы затухания иммунного ответа и иммунологической памяти
- Механизмы и типы реакций гиперчувствительности
- Механизмы гиперчувствительности немедленного типа (I типа)
- Примеры гиперчувствительности I типа (немедленного)
- Механизмы гиперчувствительности опосредованной антителами (II типа)
- Механизмы гиперчувствительности опосредованной иммунными комплексами (III типа)
Эта форма иммунного ответа предназначена для защиты от внутриклеточных патогенов, локализующихся в цитоплазматических гранулах — микроорганизмов, фагоцитированных клетками, но не разрушенных из-за недостатка адекватных эффекторных механизмов или их блокады патогенами. Типичные представители таких патогенов — различные виды микобактерий, а также многие простейшие (например, лейшмании, хламидии), риккетсии, плазмодии, грибы (кандиды) и др.
Клеточный иммунный ответ воспалительного типа осуществляется в 4 этапа (рис. 3.109).
- Презентация дендритными клетками антигена CD4+ Т-лимфоци- там, приводящая к их активации.
- Развитие хелперных Т-лимфоцитов типа ТЫ.
- Презентация антигена макрофагами ранее сформировавшимся Т-хелперам (ТЫ-типа), их взаимная активация и выделение цитокинов.
- Активация цитолиза в фагосомах макрофагов.
За реализцию этой формы защиты отвечают Thl-клетки и макрофаги. Thl-клетки формируются на этапе запуска иммунного ответа и отвечают за специфическую составляющую реакции (распознавание антигена и направление реакции на его носителя). Макрофаги выступают в качестве эффекторных клеток. Начальный этап реакции против внутриклеточных патогенов, локализованных в фаголизосомах, осуществляется так же, как при запуске любой формы иммунного ответа: дендритные клетки, захватившие патоген или его фрагмент, презентируют антигенный пептид CD4+ Т-клеткам, которые активируются, пролиферируют и дифференцируются в хелперные Т-лимфоциты. Уже на этапе распознавания антигена происходит ориентация дифференцировки CD4+ Т-лимфоцитов в хелперы Thl-типа, которая затем поддерживается цитокинами, продуцируемыми дендритными клетками — IL-12, IFNy (см. раздел 2.5.5.5).

Рис. 3.109. Схема развития клеточного иммунного ответа воспалительного типа
Активирующее взаимодействие Thl-клеток с макрофагами
Этот этап характерен именно для воспалительного иммунного ответа. Он состоит во взаимодействии специфических TM-клеток с макрофагами, которые содержат на своей поверхности молекулы MHC-II, несущие пепидный фрагмент антигена. При взаимодействии формируется иммунный синапс. В результате генерируются активирующие сигналы, направленные как в ТЫ-клетку, так и в макрофаг. В TW-лимфоцит сигналы поступают через молекулы TCR/CD4 и CD28. В результате этой повторной стимуляции Т-клетки (первая стимуляция была вызвана презентацией антигена дендритной клеткой) происходит усиление выработки цитокинов, важных для реализации последующих событий (в частности IFNy и TNFa).
Стимуляция макрофага при взаимодействии с TW-клеткой реализуется с помощью двух механихмов (рис. 3.110). Один из них — контактный — через костимулирующую молекулу CD40, с которой связывается ее лиганд CD154. CD40 спонтанно экспрессируется макрофагами, тогда как ее лиганд появляется на поверхности TM-клеток в результате активации при формировании иммунного синапса. В передаче сигнала от молекулы CD40 участвуют адапторные факторы TRAF-1, TRAF-2, TRAF-6. В результате происходят активация фактора NF-kB и запуск Rac-зависимой ветви MAP-каскада, завершающейся формированием транскрипционного фактора с-Jun. Второй механизм активации опосредуется IFNy. При связывании этого цитокина с рецептором включается сигнальный путь, вовлекающий киназы Jak1 и Jak2, транскрипционный фактор STAT1, а также дополнительные пути с участием MAP-каскада.
Результат активации макрофагов — экспрессия многочисленных генов, приводящая к повышению содержания на поверхности клетки молекул MHC-I и особенно MHC-II, сборке NADPH-оксидазы, активации ферментов окислительного метаболизма. Наиболее специфичное проявление ответа макрофагов на стимулирующее действие IFNy — экспрессия гена индуцибельной NO-синтазы. Именно NO и его производные, такие

Рис. 3.110. Активация макрофагов Т-хелперами. Показаны механизмы воздействия Thl-клеток на макрофаги (контактный и опосредованный цитокинами), а также индуцируемые Т-клетками проявления активации макрофагов
как пероксинитрит (ОО*NO), вызывают гибель микобактерий и других внутриклеточных патогенов, сохранявшихся и даже размножавшихся в фагосомах. Все эффекты IFNy, в том числе способность индуцировать образование NO-синтазы, усиливаются TNFa, продуцируемым как Th1- клетками, так и самими макрофагами. Эффективность действия цитокинов, вырабатываемых TM-клетками, существенно повышается в связи с сосредоточением их секреции в области контакта с макрофагами. Это, кроме того, уменьшает активацию посторонних клеток и их повреждение. Для обеспечения этой ориентированной секреции необходима поляризация клеток в ходе формирования иммунного синапса.
Особого внимания заслуживает взаимодействие цитокинов IL-12 и IFNy при воспалительном иммунном ответе (рис. 3.111). Экспрессия IL-12 в макрофагах индуцируется при связывании PAMP с TLR. Экспрессия гена IL12 — один из результатов сигнального пути, вовлекающего адапторный белок MyD88 и транскрипционный фактор NF-kB. IL-12 играет решающую роль в индукции дифференцировки TM-клеток и стимулирует выработку этими клетками IFNy, один из важнейших эффектов которого — усиление выработки макрофагами IL-12. Таким образом, эти цитокины вместе с рецепторами и сигнальными путями, ответственными за экспрессию их генов, образуют единую функциональную систему, которой принадлежит ключевая роль в реализации воспалительной формы клеточного иммунного ответа. Дефекты в любом звене этой системы приводят к развитию иммунодефицитов, сопровождающихся повышенной чувствительностью к микобактериям и другим патогенам, в ответ на которые вовлечены ТЫ-клетки и макрофаги.
Воспалительная составляющая Thl-клеточного иммунного ответа
В отличие от цитотоксического иммунного ответа, не связанного очевидным образом с воспалительной реакцией, иммунный ответ, опосредованный TW-клетками, полностью реализуется в ее рамках. Запуск ответа происходит по классической схеме. В очаге инфицирования (обычно в

Рис. 3.111. Роль интерферона у в дифференцировке и реализации функций Т-хел- перов. Интерферон у, продуцируемыйклеткамиврожденногоиммунитета, определяет направление развития адаптивного иммунного ответа, в ходе которого он также секретируется Thl-клетками и активирует основные эффекторы воспалительной формы клеточного ответа — макрофаги
барьерных тканях) дендритные клетки поглощают патоген или его фрагмент и транспортируют его в региональный лимфатический узел или иные вторичные лимфоидные органы. Дифференцировавшиеся специфические ХЫ-клетки поступают в рециркуляцию. Подобно цитотоксическим Т-лимфоцитам, они утрачивают мембранные молекулы, направляющие их миграцию в лимфоидные органы (CD62L, CCR7) и приобретают обычные свойства эффекторных клеток, включая усиленную экспрессию мембранных интегринов (LFA-1, VLA-4) и рецепторов для хемокинов, секретируе- мых в очагах воспаления и барьерных тканях (для Thl-клеток — CXCR3, CCR5, CCR2 и др.).
Оказавшись в очагах инфицирования, Thl-клетки в кооперации с макрофагами осуществляют реакции, описанные выше. В результате взаимодействия этих клеток, особенно действия IFNy, происходит максимально выраженная активация макрофагов. Эта активация результативна с точки зрения защиты от внутриклеточных патогенов, но деструктивна для окружающих тканей. Активированные макрофаги выделяют весь спектр своих секреторных продуктов. Он включает разнообразные провоспалительные факторы и факторы бактерицидности. К последним относят активные формы кислорода, их галоидные производные, оксид азота и его дериваты, ферменты и т.д. Среда в окружении таких клеток закисляется. Поскольку контакт макрофагов с Thl-клетками к этому моменту прекращается, секреция уже не носит ориентированного характера. Выделяемые молекулы выступают как факторы внеклеточной
микробицидности и одновременно вызывают повреждение окружающих нормальных клеток организма. Таким образом, продукты Th1-клеток дополнительно усиливают воспалительную реакцию, в то же время придавая ей специфичность в отношении конкретных возбудителей.
Вариант воспаления, реализуемый с участием Th1-клеток, называют иммунным воспалением, а сам Th1-клеточный иммунный ответ носит название воспалительного клеточного иммунного ответа. В рамках этой формы иммунного ответа особенно ярко проявляется соотношение факторов врожденного и адапативного иммунитета: эффекторным механизмом служит типичная реакция врожденного иммунитета — фагоцитоз, однако он усиливается и приобретает специфичность в отношении конкретных антигенов благодаря вовлечению в реакцию клеток адаптивного иммунитета.
Гранулема

При неэффективном клеточном ответе воспалительного типа, т.е. в случаях, когда разрушения и переваривания внутриклеточных патогенов не происходит, формируется гранулема (рис. 3.112). Гранулема представляет собой морфологическую структуру округлой формы, в центре которой расположены инфицированные макрофаги, а также клеточный детрит и патогены, освободившиеся в результате разрушения макрофагов. Вследствие слияния макрофагов образуются гигантские многоядерные клетки. Некоторые макрофаги претерпевают морфологические изменения, приобретая фенотип так называемых эпителиоидных клеток. Периферическая часть гранулемы образована активированными макрофагами, лишенными патогенов, и Т-лимфоцитами (преимущественно TM-клетками). Т-клетки постоянно
перемещаются, причем эта подвижность важна для сохранения структурной целостности гранулемы. Формирование гранулемы сопряжено с деструкцией ткани и нарушением функционирования большого участка пораженных органов (например, легких при туберкулезе), что делает ее патологическим образованием. С другой стороны, гранулема представляет способ изоляции патогена, с уничтожением которого иммунная система не справляется, и в этом смысле выступает как защитное приспособление организма.
Эффекторные реакции, опосредованные ТН2-клетками
^2-клетки участвуют в эффекторных реакциях, направленных на защиту от многоклеточных паразитов. Эти реакции изучены пока крайне мало. При этом, подобно TM-клеткам, ^2-лимфоциты вовлекают в защитную реакцию клетки миелоидного ряда. В отличие от реакций, опосредованных TW-клетками, эти клетки представлены не макрофагами, а эозинофилами и тучными клетками.
Роль ^2-клеток в этих процессах в значительной степени состоит в секреции цитокинов: IL-4, IL-5, IL-13, IL-9, IL-3 и GM-CSF. Каждый из них в той или иной степени участвует во взаимодействии с исполнительными клетками. Основную роль при этом играет IL-5. Этот цитокин служит фактором выживания эозинофилов, поддерживает их развитие и привлекает эти клетки в очаг поражения. Эозинофилы инфильтрируют ткань вокруг паразита и выделяют продукты своих гранул, из которых главный белок эозинофилов (MBP), пероксидаза эозинофилов (EPO) и катионный белок эозинофилов (ECP) обладают цитопатогенной активностью в отношении клеток гельминтов и других макропаразитов.
Вспомогательную роль в подобных реакциях играют антитела класса IgE. Полагают, что этот минорный класс иммуноглобулинов, известный как ключевой фактор аллергии немедленного типа, предназначен для осуществления антипаразитарной защиты. Помимо прямого блокирующего действия на паразитов, IgE способен «армировать» макрофаги, связываясь с высокоаффинными FceRI-рецепторами на их поверхности, что придает прицельность действию макрофагов и служит дополнительным фактором их активации.
Иммунная
система объединяет органы и ткани, в
которых происходит образование и
взаимодействие клеток – иммуноцитов
, выполняющих функцию распознавания
генетически чужеродных субстанций
(интигенов) и осуществляющих специфическую
функцию.
Иммунная
система представлена красным костным
мозгом — источником стволовых клеток
для иммуноцитов , центральным органом
лимфоцитопоэза (тимус), периферическими
органами лимфоцитопоэза (селезенка,
лимфатические узлы, скопления лимфоидной
ткани в органах), лимфоцитами крови и
лимфы, а также популяциями лимфоцитов
и плазмоцитов, проникающими во все
соединительные и эпителиальные ткани.
Все органы иммунной системы функционируют
как единое целое благодаря нейрогуморальным
механизмам регуляции, а также постоянно
совершающимся процессам миграции и
рециркуляции клеток по кровеносной и
лимфатической системам.
Клетки
иммунной системы ( иммуноциты ) могут
быть разделены на три группы:
1.
Иммунокомпетентные клетки, способные
к специфическому ответу на действие
антигенов. Этими свойствами обладают
исключительно лимфоциты, каждый из
которых изначально обладает рецепторами
для какого-либо антигена.
2.
Вспомогательные (антиген-представляющие)
клетки, способные отличать собственные
антигены от чужеродных и представлять
их иммунокомпетентным клеткам, без
чего невозможен иммунный ответ на
большинство чужеродных антигенов
3.
Клетки антиген-неспецифической защиты,
отличающие компоненты собственного
организма от чужеродных частиц, в первую
очередь от микроорганизмов, и уничтожающих
последние путем фагоцитоза или
цитотоксического воздействия.
Лимфоциты.
Лимфоциты, как и другие клетки иммунной
системы, являются производными
полипотентной стволовой клетки костного
мозга. В результате пролиферации и
дифференцировки стволовых клеток
формируются две основные группы
лимфоцитов, именуемые В- и Т-лимфоцитами,
которые морфологически не отличимы
друг от друга.
Макрофаги
играют важную роль как в естественном,
так и в приобретенном иммунитете
организма. Участие макрофагов в
естественном иммунитете проявляется
в их способности к фагоцитозу и в синтезе
ряда активных веществ — пищеварительных
ферментов, компонентов системы
комплемента, фагоцитина, лизоцима,
интерферона, эндогенного пирогена и
tip., являющихся основными факторами
естественного иммунитета. Их роль в
приобретенном иммунитете заключается
в пассивной передаче антигена
иммунокомпетентным клеткам (Т- и
В-лимфоцитам), в индукции специфического
ответа на антигены. Макрофаги также
участвуют в обеспечении иммунного
гомеостаза путем контроля над размножением
клеток, характеризующихся рядом
отклонений от нормы (опухолевые клетки).
При
гуморальном иммунитете эффекторными
клетками являются плазматические
клетки, которые синтезируют и выделяют
в кровь антитела.
Клеточный
иммунный ответ формируется при
трансплантации органов и тканей,
инфицировании вирусами, злокачественном
опухолевом росте.
Гуморальный
иммунный ответ обеспечивают макрофаги
(ан-тигенпрезентирующие клетки), Тх и
В-лимфоциты. Попавший в организм антиген
поглощается макрофагом. Макрофаг
расщепляет его на фрагменты, которые
в комплексе с молекулами МНС класса II
появляются на поверхности клетки.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
02.05.20152.78 Mб97propedevtika_sam_rab.doc
- #
