Противовирусный и противогрибковый иммунитет
Особенности противовирусного, противогрибкового,
противоопухолевого, трансплантационного иммунитета.
Противовирусный иммунитет. Основой противовирусного
иммунитета является клеточный иммунитет. Клетки-мишени, инфицированные
вирусом, уничтожаются цитотоксическими лимфоцитами, а также NK-клетками и
фагоцитами, взаимодействующими с Fc-фрагментами антител, прикрепленных к
вирусспецифическим белкам инфицированной клетки. Противовирусные антитела
способны нейтрализовать только внеклеточно расположенные вирусы, как и факторы
неспецифического иммунитета — сывороточные противовирусные ингибиторы. Такие
вирусы, окруженные и блокированные белками организма, поглощаются фагоцитами
или выводятся с мочой, потом и др. (так называемый «выделительный иммунитет»).
Интерфероны усиливают противовирусную резистентность, индуцируя в клетках
синтез ферментов, подавляющих образование нуклеиновых кислот и белков вирусов.
Кроме этого, интерфероны оказывают иммуномодулирующее действие, усиливают в
клетках экспрессию антигенов главного комплекса гистосовместимости (МНС).
Противовирусная защита слизистых оболочек обусловлена секреторными IgA, которые, взаимодействуя с вирусами, препятствуют их
адгезии на эпителиоцитах.
Противогрибковый иммунитет. Антитела (IgM, IgG) при микозах
выявляются в низких титрах. Основой противогрибкового иммунитета является
клеточный иммунитет. В тканях происходит фагоцитоз, развивается эпителиоидная
гранулематозная реакция, иногда тромбоз кровеносных сосудов. Микозы, особенно
оппортунистические, часто развиваются после длительной антибактериальной
терапии и при иммунодефицитах. Они сопровождаются развитием
гиперчувствительности замедленного типа. Возможно развитие аллергических заболеваний после
респираторной сенсибилизации фрагментами условно-патогенных грибов родов Aspergillus, Penicillium, Mucor, Fusarium и др.Антигены
грибов имеют относительно низкую иммуногенность: они практически не индуцируют
антителообразование (титры специфических антител остаются низкими), но
стимулируют клеточное звено иммунитета — активированные макрофаги, которые
осуществляют антителозависимую клеточноопосредованную цит о токсичность г
рибов. Активированные макрофаги продуцируют перекисные и N0’—ион-радикалы
и ферменты,
которьК поражают мембрану клетки на расстоянии или
после фагоцитирования. Первичное распознавание чужеродных клеток происходит при
помощи FcR по антителам, которые связались с поверхностными антигенами
клеток-мишеней. При микозах наблюдается аллергизация макроорганизма. Кожные и
глубокие микозы сопровождаются, как правило, ГЗТ. Грибковые поражения слизистых
дыхательных и мочеполовых путей вызывают аллергизацию по типу ГНТ (реакция I
типа). Напряженность противогрибкового иммунитета оценивается по результатам
кожно-аллергических проб с грибковыми аллергенами.
Трансплантационным
иммунитетом — иммунную реакцию
макроорганизма, направленную против пересаженной в него чужеродной ткани
(трансплантата). Иммунная реакция на чужеродные клетки и ткани обусловлена чем,
что в их составе содержатся генетически чужеродные для организма антигены-
гистосовместимости, наиболее полно представлены на ЦПМ клеток. Реакция
отторжения не возникает лишь у однояйцовых близнецов. Выраженность реакции от
степени чужеродности, объема трансплант ируемою материала и состояния
иммунореактивност и реципиента. Основным фактором клеточного
трансплантационного иммунитета являются Т-киллеры. После сенсибилизации
антигенами донора мигрируют в ткани трансплантата и оказывают на них
антителонезависимую клеточноопосредованную цитотоксичность.Специфические
антитела, которые образуются на чужеродные антигены (гемагглютинины,
гемолизины, лейкотоксины, цитогоксины), имеют важное значение в формировании
трансплантационного иммунитета. Они запускают ан тителоопосредованный ци толиз
трансплантата (комплемен-опосредованный и антителозависимая
клеточноопосредован- ная цитотоксичность).
Механизм отторжения. В первой фазе вокруг трансплантата и сосудов
наблюдается скопление иммунокомпетентных клеток (лимфоидная инфильтрация), в
том числе Т- киллеров. Во второй фазе происходит деструкция клеток
трансплантата Т-киллерами, активируются макрофагапьное звено, естественные
киллеры, специфический антителогенез. Возникает иммунное воспатение, тромбоз кровеносных
сосудов, нарушается питание трансплантата и происходит его гибель. Разрушенные
ткани утилизируются фагоцитами.-В процессе реакции отторжения формируется клон
Т- и B-клеток иммунной памяти. Повторная попытка пересадки тех же органов и
тканей вызывает вторичный иммунный ответ, который протекае т очень бурно и
быстро заканчивае тся отторжением трансплантата. С клинической точки зрения
выделяют ос трое, сверхострое и отсроченное отторжение трансплантата.
Различаются они по времени реализации реакции и отдельным механизмам. Острое
отторжение — это «нормальная» реакция иммунной системы по механизму
первичного ответа, которая развивается в течение первых недель или месяцев
после трансплантации в отсутствие иммуносупрессивной терапии. В ее основе лежит
комплекс всевозможных цитолитических реакций, как с участием антител, так и
независимых от них.
Отсроченное
отторжение имеет тот же механизм, что
и острое. Возникает через несколько лет после операции у пациентов, получавших
иммуносупрессивную терапию. Сверхострое отторжение, или криз
отторжения, развивается в течение первых суток после трансплантации у
пациентов, сенсибилизированных к антигенам донора, по механизму вторичного
иммунного ответа. Основу составляет антительная реакция: специфические антитела
связываются с антигенами эндотелия сосудов трансплантата и поражают клетки,
активируя систему комплемента по классическому пути. Параллельно инициируется
иммунное воспаление и свертывающая система крови. Быстрый тромбоз сосудов
трансплан тата вызывает его острую ишемию и ускоряет некрогизацию пересаженных
тканей.
Иммунитет
противоопухолевый. Мутантиые клетки возникают в результате нелетального действия химических,
физических и биологических канцерогенов Мутантные клетки отличаются от
нормальных метаболическими процессами и антигенным составом, имеют измененные
антигены гистосовместимости.Они активируют гуморальное и клеточное звенья
иммунитета, осуществляющие надзорную функцию. Важную роль в этом процессе
играют специфические антитела (запускают комплемент-опосредованную реакцию и
антителозависимую клеточно-опос- редованную цитотоксичность) и Т-киллеры,
осуществляющие антителонезависимую клеточноопосредованную цитотоксичность.
Противоопухолевый
иммунитет имеет свои особенности,
связанные с низкой иммуногенностью раковых клеток. Эти клетки практически не
отличаются от нормальных, интактных морфологических элементов собственного
организма. Специфический антигенный «репертуар» опухолевых клеток также
скуден. В число опухольассоциированных антигенов входит группа раково-
эмбриональных антигенов, продукты онкогенов, некоторые вирусные антигены и
гиперэкспрессируемые нормальные белки. Слабому иммунологическому распознаванию
опухолевых клеток способствует отсутствие воспалительной реакции в месте
онкогенеза, а также их иммуносупрессивная активность — биосинтез ряда
«негативных» цитокинов, а также экранирование раковых клеток противоопухолевыми
антителами.
Механизм
основную роль в нем играют активированные макрофаги; определенное значение
имеют также естественные киллеры. Защитная функция гуморального иммунитета во
многом спорная — специфические антитела могут экранировать антигены опухолевых
клеток, не вызывая их цитолиза.
Вместе с тем, в последнее время
получила распространение иммунодиагностика рака основана на определении
раково-эмбриональных антигенов и опухоль-ассоциированных
Противобактериальный,
противовирусный, противогрибковый,
противопротозойный и противоопухолевый
иммунитет
Противобактериальный
иммунитет направлен как против бактерий,
так и против их токсинов (антитоксический
иммунитет). Бактерии и их токсины нейтрализуются
антибактериальными и антитоксическими
антителами. Комплексы бактерия
(антигены)-антитела активируют комплемент,
компоненты которого присоединяются к
Fc-фрагменту антитела, а затем образуют
мембраноатакующий комплекс, разрушающий
наружную мембрану клеточной стенки
грамотрицательных бактерий. Пептидогликан
клеточных стенок бактерий разрушается
лизоцимом.
Антитела (Fc-фрагмент) и комплемент (С3b),
обволакивают бактерии и “приклеивают” их к Fc- и
С3b-рецепторам фагоцитов, выполняя роль опсонинов вместе с другими
белками, усиливающими фагоцитоз (C-реактивным
белком, фибриногеном, маннансвязывающим
лектином, сывороточным амилоидом).
Фагоцитоз является основным
механизмом антибактериального иммунитета
Фагоциты направленно перемещаются к объекту
фагоцитоза, реагируя на хемоаттрактанты:
вещества микробов, активированные компоненты
комплемента (С5a, C3a) и цитокины.
Противобактериальная защита слизистых оболочек
обусловлена секреторными IgA, которые,
взаимодействуя с бактериями, препятствуют их
адгезии на эпителиоцитах.
| Противовирусный иммунитет. Основой противовирусного иммунитета является клеточный иммунитет. Клетки-мишени, инфицированные вирусом уничтожаются цитотоксическими лимфоцитами, а также NK-клетками и фагоцитами, взаимодействующими с Fc-фрагментами антител, прикрепленных к вирусспецифическим белкам инфицированной клетки. Противовирусные антитела способны нейтрализовать только внеклеточно расположенные вирусы, как и факторы неспецифического иммунитета — сывороточные противовирусные ингибиторы. Такие вирусы, окруженные и блокированные белками организма, поглощаются фагоцитами или выводятся с мочой, потом и др. (так наз. “выделительный иммунитет“). Интерфероны усиливают противовирусную резистентность, индуцируя в клетках синтез ферментов, подавляющих образование нуклеиновых кислот и белков вирусов. Кроме этого интерфероны оказывают иммуномодулирующее действие, усиливают в клетках экспрессию антигенов главного комплекса гистосовместимисти (MHC) Противовирусная защита слизистых оболочек обусловлена секреторными IgA, которые, взаимодействуя с вирусами, препятствуют их адгезии на эпителиоцитах. |
Противогрибковый
иммунитет. Антитела (IgM, IgG) при
микозах выявляются в низких титрах. Основой
противогрибкового иммунитета является клеточный иммунитет. В
тканях происходит фагоцитоз, развивается
эпителиоидная гранулематозная реакция, иногда
тромбоз кровеносных сосудов.
Микозы, особенно оппортунистические, часто
развиваются после длительной антибактериальной
терапии и при иммунодефицитах. Они
сопровождаются развитием гиперчувствительности
замедленного типа. Возможно развитие
аллергических заболеваний после респираторной
сенсибилизации фрагментами условно-патогенных
грибов родов Aspergillus, penicillium, Mucor, Fusarium и др.
Противопротозойный
иммунитет. Антитела (IgM, IgG) против
простейших действуют на внеклеточные формы
паразитов. Часто иммунитет является
стадиоспецифическим, т.е. против различных форм,
стадий развития паразита появляются
соответствующие антитела. Паразит, имеющий
различные стадии развития в организме (например, плазмодии малярии), как бы
“ускользает”, отклоняется от ранее
образовавшихся антител. Фагоцитоз может быть
незавершенным, например, при лейшманиозах.
Выявление гиперчувствительности замедленного
типа используют при диагностике токсоплазмоза, лейшманиоза и некоторых
других протозойных инфекций.
Противоопухолевый
иммунитет основан на Th1-зависимом клеточном иммунном ответе,
активирующем цитотоксические T-лимфоциты,
макрофаги и NK-клетки.
Теория по иммунологии. Оценка иммунного статуса, аллергия, иммунитет при бактериальных, вирусных, грибковых, протозойных, глистных инфекциях; новообразования.
При создании данной страницы использовалась лекция по соответствующей теме, составленная Кафедрой репродуктивного здоровья человека ИДПО с курсом иммунологии
Навигация:
- Оценка уровня естественной резистентности
- Оценка иммунного статуса
- Исследование Т-системы иммунитета
- Исследование В-системы иммунитета
- Диагностические мероприятия при аллергических заболеваниях
- Особенности иммунитета при бактериальных инфекциях
- Особенности противовирусного иммунитета
- Особенности противогрибкового иммунитета
- Особенности иммунитета при протозойных инвазиях
- Особенности противоглистного иммунитета
- Трансплантационный иммунитет
- Иммунитет против новообразований
Иммунодиагностика – это решение двух вопросов:
- Изменена ли иммунологическая реактивность организма?
- Если она изменена, в чем выражено это изменение и в какой степени?
Методы исследования иммунологической реактивности:
- оценка уровня естественной резистентности;
- оценка уровня иммунного статуса.
Оценка уровня естественной резистентности
Исследование клеточных факторов неспецифической резистентности
1. Определение бактерицидной активности кожи путем посевов-отпечатков по методу Клемпарской (N>95%).
2. Определение фагоцитарной активности лейкоцитов.
- Фагоцитарный показатель (N=79%).
- Фагоцитарный индекс (N=1,3-3,0, для частиц латекса=10,2).
- Завершенность фагоцитоза.
- НСТ-тест – способность фагоцитирующих клеток (супероксидные радикалы) восстанавливать бесцветный реактив нитросиний тетразоль в краситель, окрашивающий активную клетку в синий цвет (N=48-80%).
Исследование гуморальных факторов неспецифической резистентности:
- уровень комплемента в сыворотке крови;
- содержание лизоцима в слюне или сыворотке крови;
- титры сывороточных β – лизинов;
- С-реактивный белок в сыворотке крови;
- сывороточный интерферон.
Оценка иммунного статуса
Исследование Т-системы иммунитета
1. Количественное определение Т-лимфоцитов:
- в реакции розеткообразования с бараньими эритроцитами (ЕРОК) (N=50-76%).
- Розеткой считается лимфоцит, прикрепивший не менее 3 эритроцитов.
- по кластерам дифференцировки CD-2 и CD-3 с диагностическими меченными моноклональными антителами в непрямых вариантах реакции иммунофлюоресценции (РИФ) и иммуноферментного анализа (ИФА).
2. Определение CD4+ и CD8+ лимфоцитов и их соотношения:
- в непрямой РИФ с моноклональными антителами. (NCD4+=31-46% всех Т-лимфоцитов, а NCD8+=30-35%. Соотношение CD4+ : CD8+ = 1,0:2,2 – 1,0:1,5)
3. Функциональная активность Т-лимфоцитов:
- реакция бластной трансформации (РБТ) (N=20-100%);
- цитотоксическая функция Т-клеток в реакциях с клетками мишенями;
- реакция торможения миграции лейкоцитов (РТМЛ).
Исследование В-системы иммунитета
1. Количественное изучение В-лимфоцитов:
- в реакции розеткообразования с эритроцитами мышей (ЕАРОК);
- в реакции розеткообразования с бараньими эритроцитами, сенсибилизированными антителами и комплементом (ЕАСРОК) (N=10-20%);
- по кластерам дифференцировки CD-19, 20, 22 в непрямой РИФ и ИФА.
2. Определение функциональной активности В-лимфоцитов:
- РБТ;
- уровень нормальных антител в реакции агглютинации (РА) с эритроцитами барана и с микробными антигенами;
- содержание иммуноглобулинов классов G, М, А методом Манчини (реакция преципитации в геле), непрямым ИФА и радиоиммунным анализом (РИА). N IgM=109 МЕ/мл (0,5 – 1,9 мг/мл) N IgG=233 МЕ/мл (8,0 –16,0 мг/мл) N IgA=147 МЕ/мл (1,4 – 4,2 мг/мл).
Практическое использование методов исследования иммунной системы
- Оценка состояния иммунной системы (оценка иммунного статуса).
- Серотипирование бактериальных и вирусных культур, выделенных из организма человека.
- Серодиагностика инфекционных болезней.
- Выявление иммунопатологических состояний.
- Определение состава и характеристики тканей человека: групп крови, Rh-фактора, HLA антигенов.
- Выявление в организме человека или во внешней среде любых веществ, обладающих антигенными свойствами (гормонов, ферментов, ядов, лекарств, наркотических средств).
Оценка иммунного статуса:
I этап – клиническая долабораторная диагностика иммунодефицитных и других иммунопатологических состояний:
- иммунологический анамнез (частота инфекционных заболеваний, характер их течения, выраженность температурной реакции, наличие очагов хронической инфекции);
- клинический анализ крови (содержание лейкоцитов, в т.ч. лимфоцитов, моноцитов, сегментоядерных);
- результаты бактериологического (вирусологического) и серологического исследований на бактерио- (вирусо-) носительство.
II этап предусматривает применение тестов 2-х уровней:
Тесты первого уровня позволяют выявить грубые нарушения функций иммунной системы:
- процентное содержание и абсолютное количество Т — и В-лимфоцитов;
- уровень иммуноглобулинов сыворотки крови классов М, G, А, Е;
- титр комплемента;
- фагоцитарная активность нейтрофилов.
Тесты второго уровня проводятся при выявлении грубых нарушений функции иммунной системы и включают углубленное иммунологическое обследование для установления регуляторных нарушений и дисфункций иммунитета:
- субпопуляции Т-лимфоцитов (CD4+, CD8+), их соотношение;
- функциональная активность Т- и В-лимфоцитов в РБТ и РТМЛ;
- цитотоксическая активность лейкоцитов;
- кожные тесты.
Диагностические мероприятия при аллергических заболеваниях
- аллергологический анамнез (наличие аллергических реакций на антибиотики, пищевые продукты, пыльцу растений и т. д.);
- данные клинико-лабораторных исследований (лейкоцитоз, эозинофилия);
- при аллергических реакциях I – содержание сывороточного JgE;
- при аллергических реакциях II типа – выявление в сыворотке крови антиэритроцитарных, антилейкоцитарных, антитромбоцитарных антител, оказывающих цитолитическое действие в присутствии комплемента на клетки-«мишени»;
- при аллергических реакциях III типа – иммунные комплексы, циркулирующие в крови или фиксированные на тканях органа- «мишени»;
- для изучения клеточно-опосредованной сенсибилизации при аллергии IV типа проводят РБТ и РТМЛ;
- при реакциях I и IV типов проводят кожно-аллергические пробы.
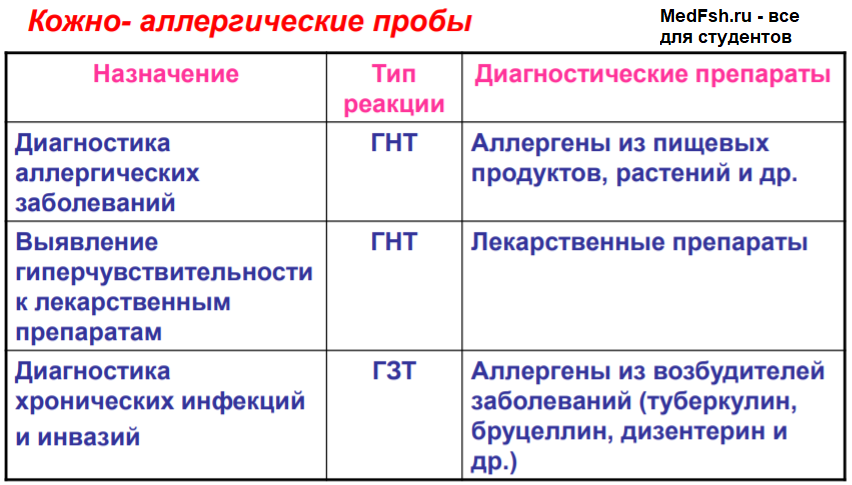
Метод кожных проб основан на том, что Ig Е находится не только в шоковом органе, но и в коже. В месте введения аллергена происходит аллергическая реакция АГ-АТ с высвобождением гистамина (через 20-30 минут – покраснение, волдырь).
Выраженность кожной реакции зависит от степени сенсибилизации организма.
В основе кожных проб на внутрикожное введение аллергена в специфически сенсибилизированный (инфицированный или вакцинированный) организм лежат аллергические реакции клеточного типа (на месте введения – через 24-48 часов образуется мононуклеарный инфильтрат, величина которого зависит от степени сенсибилизации).
Практическое применение:
- диагностика туберкулеза (проба Манту с туберкулином);
- диагностика туляремии (проба с тулярином);
- диагностика дизентерии (проба Цуверкалова с дизентерином) и т. д.
Лабораторная диагностика аутоиммунных процессов осуществляется с помощью выявления аутоантител и циркулирующих иммунных комплексов методом осаждения полиэтиленгликолем.
Особенности иммунитета при бактериальных инфекциях
- Иммунная реакция макроорганизма в ответ на бактериальную инфекцию в значительной степени определяется факторами патогенности микроба и в первую очередь его способностью к токсинообразованию. Различают иммунитет антибактериальный — против структурных компонентов бактериальной клетки и антитоксический — против белковых токсинов.
- Основными факторами антибактериальной защиты являются антитела и фагоциты. Антитела эффективно инактивируют биологически активные молекулы бактериальной клетки (токсины, ферменты агрессии и др.), маркируют их, запускают антителозависимый бактериолиз и иммунный фагоцитоз. Фагоциты непосредственно осуществляют фагоцитоз, в том числе иммунный, антителозависимый бактериолиз и внеклеточный киллинг патогена при помощи ион-радикалов и ферментов. Важная роль в борьбе с грамположительными микробами принадлежит лизоциму, а с грамотрицательными — комплементу (альтернативный путь активации), кроме того, существенное значение имеют белки острой фазы (С-реактивный и маннозосвязывающий протеин).
- Ряд бактерий, относящихся к факультативным внутриклеточным паразитам, отличается повышенной устойчивостью к действию комплемента, лизоцима и фагоцитов (незавершенный фагоцитоз). К их числу относятся микобактерии, йерсинии, бруцеллы, сальмонеллы и некоторые другие. В такой ситуации макроорганизм вынужден переключать нагрузку на клеточное звено иммунитета, что ведет к аллергизации организма по механизму ГЗТ. Особое значение приобретают активированные макрофаги и естественные киллеры, осуществляющие АЗКЦТ, а такжеТ-лимфоциты.
- Напряженность специфического антибактериального иммунитета оценивают в серологических тестах по титру или динамике титра специфических антител, а также по состоянию клеточной иммунореактивности (например, по результатам кожно-аллергической пробы).
Особенности противовирусного иммунитета
- Особенности иммунной защиты макроорганизма при вирусных инфекциях обусловлены двумя формами существования вируса: внеклеточной и внутриклеточной. Основными факторами, обеспечивающими противовирусный иммунитет, являются специфические антитела, Т-киллеры, естественные киллеры, интерферон и сывороточные ингибиторы вирусных частиц.
- Специфические противовирусные антитела способны взаимодействовать только с внеклеточным вирусом, так как у них нет доступа внутрь живой клетки. Антитела нейтрализуют вирусные адгезины и нейраминидазы, препятствуя адсорбции вирусов на клетках-мишенях и их инфицированию. Они также связывают вирусные белки и нуклеиновые кислоты, образовавшиеся после разрушения зараженных вирусами клеток. Сформировавшиеся иммунные комплексы элиминируются путем иммунного фагоцитоза.
- Клетки, инфицированные вирусом и приступившие к его репликации, экспрессируют вирусные белки на цитоплазматической мембране в составе молекул антигенов гистосовместимости — MHC I класса. Измененная структура MHC I класса этих антигенов гистосовместимости является маркером для Т-киллеров, которые распознают зараженные вирусом клетки и уничтожают их.
- Мощным противовирусным свойством обладает интерферон. Он не действует непосредственно на внутриклеточный вирус, а связывается с рецептором на мембране клетки и подавляет в ней все биосинтетические процессы.
- Напряженность противовирусного иммунитета оценивают преимущественно в серологических тестах по нарастанию титра специфических антител в парных сыворотках в процессе болезни. Определяют также концентрацию интерферона в сыворотке крови.
Особенности противогрибкового иммунитета
- Антигены грибов имеют относительно низкую иммуногенность: они практически не индуцируют антителообразование (титры специфических антител остаются низкими), но стимулируют клеточное звено иммунитета. Основными действующими факторами противогрибкового иммунитета являются активированные макрофаги, которые осуществляют АЗКЦТ грибов.
- При микозах наблюдается аллергизация макроорганизма. Кожные и глубокие микозы сопровождаются, как правило, ГЗТ. Грибковые поражения слизистых оболочек дыхательных и мочеполовых путей вызывают аллергизацию по механизму ГНТ (реакция I типа). Напряженность противогрибкового иммунитета оценивается по результатам кожно-аллергических проб с грибковыми аллергенами.
Особенности иммунитета при протозойных инвазиях
- Паразитарная инвазия сопровождается формированием в макроорганизме гуморального и клеточного иммунитета. В крови определяются специфические антитела классов M и G, которые чаще всего не обладают протективным свойством. Однако они активируют АЗКЦТ с участием макрофагов, а в случае внутриклеточного паразитирования — естественных киллеров и T лимфоцитов. Паразитарные инвазии сопровождаются аллергизацией макроорганизма по механизму ГЗТ.
- Характер противопаразитарного иммунитета определяется биологическими особенностями паразита. Многие паразиты обладают высокой антигенной изменчивостью, что позволяет им избегать действия факторов иммунитета. Например, каждой стадии развития малярийного плазмодия соответствуют свои специфические антигены.
- Напряженность противопаразитарного иммунитета оценивается в серологических тестах по титру специфических антител и в кожноаллергических пробах с протозойным антигеном.
Особенности противоглистного иммунитета
- Ведущую роль в осуществлении иммунной защиты макроорганизма от глистной инвазии играют эозинофилы, которые осуществляют АЗКЦТ. Эти клетки распознают паразитов, отмеченных специфическими IgE или IgA. Активированный эозинофил выделяет путем дегрануляции ряд токсичных субстанций (ферменты, белковые токсины), губительно действующих на гельминты.
- Антигены гельминта, связываясь также с рецепторными комплексами тучных клеток слизистой оболочки, вызывают их дегрануляцию. Экскретированные биологически активные соединения вызывают интенсивную перистальтику, удаляющую паразита или его останки из просвета кишки.
- Эозинофилы и тучные клетки синтезируют цитокины и липидные медиаторы, потенцирующие воспалительную реакцию в месте внедрения гельминта. Глистная инвазия сопровождается аллергизацией в основном по механизму ГЗТ.
Трансплантационный иммунитет
- Макроорганизм формирует иммунную реакцию, направленную против пересаженной в него чужеродной ткани (трансплантата). Это является основной проблемой, препятствующей успешной пересадке органов и тканей. Иммунная реакция на чужеродные клетки и ткани обусловлена тем, что в их составе содержатся генетически чужеродные для организма антигены. Эти антигены получили название трансплантационных или антигенов гистосовместимости. Наиболее полно они представлены на цитоплазматической мембране клеток.
- Реакция отторжения не возникает в случае полной совместимости донора и реципиента по антигенам гистосовместимости — такое возможно лишь для однояйцовых близнецов. Выраженность реакции отторжения во многом зависит от степени чужеродности, объема трансплантируемого материала и состояния иммунореактивности реципиента.
- На чужеродные трансплантационные антигены организм реагирует факторами клеточного и гуморального иммунитета. Основным являются Т-киллеры и специфические антитела. Т-киллеры осуществляют АНКЦТ тканей трансплантата (реакция реципиент против трансплантата) или реципиента (реакция трансплантат против реципиента). Специфические антитела, которые образуются к антигенам трансплантата, запускают комплемент- или клеточно-опосредованный цитолиз трансплантата.
- Возможен адаптивный перенос трансплантационного иммунитета с помощью активированных лимфоцитов или со специфической антисывороткой от сенсибилизированной особи интактному макроорганизму.
- Механизм иммунного отторжения пересаженных клеток и тканей имеет две фазы. В первой фазе вокруг трансплантата и сосудов наблюдается скопление иммунокомпетентных клеток (лимфоидная инфильтрация), в том числе Т-киллеров. Во второй фазе происходит деструкция клеток трансплантата Т-киллерами, активируются макрофагальное звено, естественные киллеры, специфический антителогенез. Затем возникают иммунное воспаление, тромбоз кровеносных сосудов, нарушается питание трансплантата и происходит его гибель. Разрушенные ткани утилизируются фагоцитами. Ткани трансплантата реагируют на ткани реципиента подобным же образом. Однако иммунная реакция трансплантата слабее, так как ограничена его ресурсами.
- В процессе реакции отторжения формируется клон клеток иммунологической памяти. Повторная попытка пересадки тех же органов и тканей вызывает вторичный иммунный ответ, который протекает очень бурно и быстро заканчивается отторжением трансплантата.
Иммунитет против новообразований
- Противоопухолевый иммунитет имеет свои особенности, связанные с низкой иммуногенностью раковых клеток. Эти клетки практически не отличаются от нормальных, интактных морфологических элементов собственного организма. Специфический антигенный репертуар опухолевых клеток также скуден.
- В число опухоль-ассоциированных антигенов входят группа раково-эмбриональных антигенов, продукты онкогенов, некоторые вирусные антигены и гиперэкспрессируемые нормальные белки. Слабому иммунологическому распознаванию опухолевых клеток способствуют отсутствие воспалительной реакции в месте онкогенеза, их иммуносупрессивная активность — биосинтез ряда негативных цитокинов (β-ТФР и др.), а также экранирование раковых клеток противоопухолевыми антителами.
- Механизм противоопухолевого иммунитета до сих пор слабо изучен. Считается, что основную роль в нем играют активированные макрофаги, определенное значение имеют также естественные киллеры. Защитная функция гуморального иммунитета во многом спорная — специфические антитела могут экранировать антигены опухолевых клеток, не вызывая их цитолиза.
- В последнее время получила распространение иммунодиагностика рака, которая основана на определении в сыворотке крови раково-эмбриональных и опухоль-ассоциированных антигенов. Так, в настоящее время удается диагностировать некоторые формы рака печени, желудка, кишечника, простаты и др.
- Между состоянием иммунной защиты и развитием новообразований существует тесная связь. Злокачественные новообразования наблюдаются чаще у индивидуумов с иммунодефицитами и престарелых (в связи с понижением активности иммунной системы). Иммуносупрессивная химиотерапия также нередко сопровождается пролиферативными процессами. Поэтому в лечении опухолей нашли применение иммуномодуляторы (интерлейкины, интерфероны), а также адъюванты (мурамилдипептиды, вакцина БЦЖ и др.).
2
0
