Противовирусный и противораковый иммунитет клетки

Противобактериальный иммунитет направлен как против бактерий, так и против их токсинов (антитоксический иммунитет). Бактерии и их токсины нейтрализуются антибактериальными и антитоксическими антителами. Комплексы бактерия (антигены)-антитела активируют комплемент, компоненты которого присоединяются к Fc-фрагменту антитела, а затем образуют мембраноатакующий комплекс, разрушающий наружную мембрану клеточной стенки грамотрицательных бактерий. Пептидогликан клеточных стенок бактерий разрушается лизоцимом. Антитела и комплемент (СЗЬ) обволакивают бактерии и «приклеивают» их к Fc- и СЗЬ-рецепторам фагоцитов, выполняя роль опсонинов вместе с другими белками, усиливающими фагоцитоз (С-реактивным белком, фибриногеном, маннан-связывающим лектином, сывороточным амилоидом).
Основным механизмом антибактериального иммунитета является фагоцитоз. Фагоциты направленно перемещаются к объекту фагоцитоза, реагируя на хемоаттрактанты: вещества микробов, активированные компоненты комплемента (С5а, СЗа) и цитокины (рис. 7.21). Противобактериальная защита слизистых оболочек обусловлена секреторными IgA, которые, взаимодействуя с бактериями, препятствуют их адгезии на эпителиоцитах.

Рис. 33 Схема противобактериального иммунитета
Противовирусный иммунитет. Основой противовирусного иммунитета является клеточный иммунитет. Клетки-мишени, инфицированные вирусом, уничтожаются цитотоксическими лимфоцитами, а также NK-клетками и фагоцитами, взаимодействующими с Fc-фрагментами антител, прикрепленных к вирусспеци- фическим белкам инфицированной клетки (рис. 7.22). Противовирусные антитела способны нейтрализовать только внеклеточно расположенные вирусы, как и факторы неспецифического иммунитета — сывороточные противовирусные ингибиторы. Такие вирусы, окруженные и блокированные белками организма, поглощаются фагоцитами или выводятся с мочой, потом и др. (так называемый «выделительный иммунитет»). Интерфероны усиливают противовирусную резистентность, индуцируя в клетках синтез ферментов, подавляющих образование нуклеиновых кислот и белков вирусов. Кроме этого, интерфероны оказывают иммуномодулирующее действие, усиливают в клетках экспрессию антигенов главного комплекса гистосовместимости (МНС). Противовирусная защита слизистых оболочек обусловлена секреторными IgA, которые, взаимодействуя с вирусами, препятствуют их адгезии на эпителиоцитах.
Противогрибковый иммунитет. Антитела (IgM, IgG) при микозах выявляются в низких титрах. Основой противогрибкового иммунитета является клеточный иммунитет. В тканях происходит фагоцитоз, развивается эпителиоидная гранулематозная реакция, иногда тромбоз кровеносных сосудов. Микозы, особенно оппортунистические, часто развиваются после длительной антибактериальной терапии и при иммунодефицитах. Они сопровождаются развитием гиперчувствительности замедленного типа. Возможно развитие аллергических заболеваний после рес
пираторной сенсибилизации фрагментами условно-патогенных грибов родов Aspergillus, Penicillium, Mucor, Fusarium и др.
Противопротозойный иммунитет. Антитела (IgM, IgG) против простейших действуют на внеклеточные формы паразитов. Часто иммунитет является стадиоспецифическим, т. е. против различных форм, стадий развития паразита появляются соответствующие антитела. Паразит, имеющий различные стадии развития в организме (например, плазмодии малярии), как бы «ускользает», отклоняется от ранее образовавшихся антител. Фагоцитоз может быть незавершенным, например, при лейшманиозах. Выявление гиперчувствительности замедленного типа используют при диагностике токсоплазмоза, лейшманиоза и некоторых других протозойных инфекций.
Противоопухолевый иммунитет* основан на Thl-зависи- мом клеточном иммунном ответе, активирующем цитотоксические Т-лимфоциты, макрофаги и NK-клетки. Роль гуморального (антительного) иммунного ответа невелика, поскольку антитела, соединяясь с антигенными детерминантами на опухолевых клетках, экранируют их от цитопатогенного действиях иммунных лимфоцитов. Опухолевый антиген распознается антиген-презентирующими клетками (дендритными клетками и макрофагами) и непосредственно или через Т-хелперы (Thl) представляется цитотоксическим Т-лимфоцитам, разрушающим опухолевую клетку-мишень.
Кроме специфического противоопухолевого иммунитета, иммунный надзор за нормальным составом тканей реализуется за счет неспецифических факторов. Неспецифические факторы, повреждающие опухолевые клетки: 1) NK-клетки, система мононуклеарных клеток, противоопухолевая активность которых усиливается под воздействием интерлейкина-2 (ИЛ-2) и а-, (i-интерферонов; 2)ЛАК-клетки (мононуклеарные клетки и NK-клетки, активированные ИЛ-2); 3) цитокины (α- и β-интерфероны, ФНО-а и ИЛ-2).

Рис. 7.22. Противовирусный иммунитет
Противобактериальный,
противовирусный, противогрибковый,
противопротозойный и противоопухолевый
иммунитет
Противобактериальный
иммунитет направлен как против бактерий,
так и против их токсинов (антитоксический
иммунитет). Бактерии и их токсины нейтрализуются
антибактериальными и антитоксическими
антителами. Комплексы бактерия
(антигены)-антитела активируют комплемент,
компоненты которого присоединяются к
Fc-фрагменту антитела, а затем образуют
мембраноатакующий комплекс, разрушающий
наружную мембрану клеточной стенки
грамотрицательных бактерий. Пептидогликан
клеточных стенок бактерий разрушается
лизоцимом.
Антитела (Fc-фрагмент) и комплемент (С3b),
обволакивают бактерии и “приклеивают” их к Fc- и
С3b-рецепторам фагоцитов, выполняя роль опсонинов вместе с другими
белками, усиливающими фагоцитоз (C-реактивным
белком, фибриногеном, маннансвязывающим
лектином, сывороточным амилоидом).
Фагоцитоз является основным
механизмом антибактериального иммунитета
Фагоциты направленно перемещаются к объекту
фагоцитоза, реагируя на хемоаттрактанты:
вещества микробов, активированные компоненты
комплемента (С5a, C3a) и цитокины.
Противобактериальная защита слизистых оболочек
обусловлена секреторными IgA, которые,
взаимодействуя с бактериями, препятствуют их
адгезии на эпителиоцитах.
| Противовирусный иммунитет. Основой противовирусного иммунитета является клеточный иммунитет. Клетки-мишени, инфицированные вирусом уничтожаются цитотоксическими лимфоцитами, а также NK-клетками и фагоцитами, взаимодействующими с Fc-фрагментами антител, прикрепленных к вирусспецифическим белкам инфицированной клетки. Противовирусные антитела способны нейтрализовать только внеклеточно расположенные вирусы, как и факторы неспецифического иммунитета — сывороточные противовирусные ингибиторы. Такие вирусы, окруженные и блокированные белками организма, поглощаются фагоцитами или выводятся с мочой, потом и др. (так наз. “выделительный иммунитет“). Интерфероны усиливают противовирусную резистентность, индуцируя в клетках синтез ферментов, подавляющих образование нуклеиновых кислот и белков вирусов. Кроме этого интерфероны оказывают иммуномодулирующее действие, усиливают в клетках экспрессию антигенов главного комплекса гистосовместимисти (MHC) Противовирусная защита слизистых оболочек обусловлена секреторными IgA, которые, взаимодействуя с вирусами, препятствуют их адгезии на эпителиоцитах. |
Противогрибковый
иммунитет. Антитела (IgM, IgG) при
микозах выявляются в низких титрах. Основой
противогрибкового иммунитета является клеточный иммунитет. В
тканях происходит фагоцитоз, развивается
эпителиоидная гранулематозная реакция, иногда
тромбоз кровеносных сосудов.
Микозы, особенно оппортунистические, часто
развиваются после длительной антибактериальной
терапии и при иммунодефицитах. Они
сопровождаются развитием гиперчувствительности
замедленного типа. Возможно развитие
аллергических заболеваний после респираторной
сенсибилизации фрагментами условно-патогенных
грибов родов Aspergillus, penicillium, Mucor, Fusarium и др.
Противопротозойный
иммунитет. Антитела (IgM, IgG) против
простейших действуют на внеклеточные формы
паразитов. Часто иммунитет является
стадиоспецифическим, т.е. против различных форм,
стадий развития паразита появляются
соответствующие антитела. Паразит, имеющий
различные стадии развития в организме (например, плазмодии малярии), как бы
“ускользает”, отклоняется от ранее
образовавшихся антител. Фагоцитоз может быть
незавершенным, например, при лейшманиозах.
Выявление гиперчувствительности замедленного
типа используют при диагностике токсоплазмоза, лейшманиоза и некоторых
других протозойных инфекций.
Противоопухолевый
иммунитет основан на Th1-зависимом клеточном иммунном ответе,
активирующем цитотоксические T-лимфоциты,
макрофаги и NK-клетки.
Глава 16. Противовирусный иммунитет
ЗАЩИТНЫЕ МЕХАНИЗМЫ С УЧАСТИЕМ Т- И В-КЛЕТОК
При отсутствии Т-клеток организм-хозяин весьма восприимчив к атакам вирусов. Так, у бестимусных мышей (мыши nude — голые, или бесшерстные) с врожденным отсутствием зрелых Т-клеток вирус простого герпеса (HSV, от herpes simplex virus), введенный в кожу, вызывает распространяющееся поражение и в конце концов, проникая в центральную нервную систему, гибель животных. Чтобы защитить этих мышей, достаточно вскоре после заражения перенести им HSV-специфичные Т-клетки. Важное значение Т- и В-клеток, противодействующих вирусным инфекциям, будет рассмотрено ниже.
Антитела и комплемент способны ограничить распространение вируса и предотвратить повторную инфекцию
Антитела могут нейтрализовать инфекционность вирусов. Если вирусу удается преодолеть барьеры врожденного иммунитета, он вызывает развитие адаптивного (специфического) иммунного ответа с появлением цитотоксических Т-клеток, хелперных Т-клеток и противовирусных антител. Антитела служат главным препятствием для распространения вируса в другие клетки и ткани, особенно для проникновения его в кровоток. В лимфоидной ткани слизистых оболочек образуются преимущественно антитела класса IgA, предотвращающие повторную инфекцию.
Антитела могут быть направлены против любого вирусного антигена, синтезируемого в инфицированной клетке, однако сдерживание инфекции обеспечивают только те из антител, которые специфичны к гликопротеинам, экспрессированным на оболочке вирусов иди на мембране инфицированных клеток. Механизмы гуморального противовирусного иммунитета могут быть различными. Так, способ устранения инфекционности вирусных частиц зависит от их локализации — внеклеточной или внутриклеточной (рис. 16.5). О действии in vivo защитных механизмов, перечисленных на рис. 16.5, свидетельствует то, что инъекция моноклональных вирус-нейтрализующих антител весьма эффективно угнетает репродукцию вирусов. Присутствие в кровотоке нейтрализующих вирус антител — это и важный фактор предотвращения повторной инфекции.
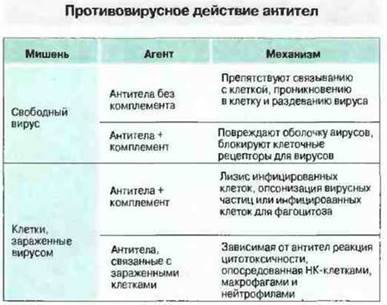
Рис. 16.5. Антитела нейтрализуют свободные вирусные частицы или участвуют в разрушении инфицированных вирусами клеток.
Комплемент участвует в нейтрализации внеклеточных вирусов некоторых видов. Комплемент также способен повреждать оболочку вируса — осуществлять виролиз. Некоторые вирусы непосредственно вызывают активацию комплемента по классическому или альтернативному пути. Тем не менее комплемент не рассматривают как главный фактор защиты против вирусов, поскольку при недостаточности компонентов системы комплемента не отмечено предрасположенности к тяжелым вирусным инфекциям у человека.
Антитела мобилизуют комплемент и/или эффекторные клетки для разрушения инфицированных вирусами клеток организма. Действие антител, помимо нейтрализации внеклеточных вирусов, состоит в том, что они вызывают разрушение инфицированных вирусами клеток, активируя систему комплемента. В результате его активации происходит сборка лизирующего мембрану комплекса и лизис зараженных клеток (см. гл. 4). Комплемент-зависимый цитолиз возможен лишь при высокой плотности экспрессии вирусных антигенов па клеточной мембране (примерно 5 х 106на клетку). В противоположность этому, для лизиса по механизму АЗКЦ необходимо присутствие на поверхности клетки-мишени лишь 103 молекул IgG — такое количество обеспечивает связывание с ней НК-клеток. Эти клетки связываются с нагруженной антителами мишенью через FcγRIII (CD16) и быстро разрушают ее посредством перфоринов (см. гл. 10). Насколько важен in vivo каждый из этих механизмов, пока трудно понять. Лучшее доказательство в пользу АЗКЦ получено на мышах при изучении защитного эффекта противовирусных моноклональных антител; не проявляя нейтрализующей активности in vitro, они оказались способны защитить С5-дефицитных животных при введении им высокой дозы вируса. (Эта линия мышей была использована для того, чтобы исключить антивирусный эффект терминальных компонентов системы комплемента.)
Т-клетки участвуют в формировании и действии противовирусного иммунитета несколькими путями
В иммунитете к вирусным инфекциям Т-клетки выполняют разнообразные функции. Образование антител в ответ на большинство антигенов зависит от тимуса, поскольку для переключения изотипа и созревания аффинности необходимо участие Т-клеток CD4+. Кроме того, эти клетки помогают в индукции цитотоксических Т-клеток CD8+, а также в привлечении макрофагов в очаг вирусной инфекции и в их активации.
Цитотоксические Т-клетки CD8+. Это главная Т-клеточная система для осуществления в организме противовирусного иммунологического надзора, и действует она весьма эффективно и избирательно. Цитотоксические Т-клетки CD8+, рестриктированные по антигенам МНС класса I, скапливаются в очагах размножения вирусов и разрушают инфицированные ими клетки. Данный механизм иммунологического надзора, по-видимому, весьма важен, так как фактически все клетки тела экспрессируют молекулы МНС класса I.
Процессинг и презентация вирусных белков. Вероятно, любой вирусный белок может быть процессирован в цитоплазме АПК с образованием пептидов, которые затем транспортируются к эндоплазматическому ретикулуму и ассоциируют с молекулами МНС класса I. Для организма-хозяина это создает определенные преимущества, так как белки вируса, экспрессируемые клеткой в начале цикла его размножения, становятся доступными для Т-клеточного распознавания задолго до появления нового поколения вирусных частиц. Например, Т-клеточный иммунитет к цитомегаловирусной инфекции у мыши специфичен в отношении наиболее раннего вирусного белка рр89. Его протективный эпитоп определен как пептид Lb, состоящий из девяти аминокислотных остатков и презентируемый молекулой МНС класса I. Иммунизация мышеи рекомбинантным вирусом коровьей оспы, несущим ген рр89, полностью защищает их от инфекции CMV. Делеция участка ДНК, кодирующего нано-пептид Ld, лишает белок рр89, экспрессируемый вирусом коровьей оспы, протективной активности.
Важность Т-клеточных механизмов в противовирусном иммунитете in vivo установлена различными способами:
• путем адоптивного переноса антигенспецифичных субпопуляций или клонов Т-клеток зараженным животным для проверки на способность устранения вируса;
• на животных, лишенных Т-клеток CD4+или CD8+путем введения специфических моноклональных антител, и
• на мышах, избирательно лишенных эмбриональных генов CD4, CD8 и β2-микроглобулина методом генного нокаута.
Как установлено, мыши, лишенные методом генного нокаута определенных субпопуляций лимфоцитов, сохраняют способность к иммунному ответу на вирусную инфекцию. Можно рассматривать это как хорошую иллюстрацию многократного функционального дублирования, вероятно свойственного иммунной системе. Например, Т-клетки CD4+в отсутствие Т-клеток CD8+могут компенсировать иммунологическую недостаточность и устранять инфекцию.
Т-клетки CD4+ способны выполнять важные эффекторные функции в иммунном ответе на вирусную инфекцию. В иммунном ответе на инфекцию эпителиальных покровов, вызванную вирусом простого герпеса I типа (HSV-I), главной эффекторной клеточной популяцией служат Т-клетки CD4+. Они, как и в реакциях гиперчувствительности замедленного типа (см. гл. 26), мобилизуют и привлекают макрофаги, и эго ускоряет ликвидацию вируса. Макрофаги служат важными участниками этого процесса (рис. 16.6). В качестве ключевых цитокинов в ответе на герпесвирусную инфекцию действует ИФγ, необходимый для активации моноцитов, и фактор некроза опухолей (ФИО), оказывающий ряд противовирусных эффектов, сходных с эффектами ИФγ, но осуществляемых иными путями.

Рис. 16.6. При кожной герпесвирусной (HSV) инфекции в качестве защитных факторов действуют Т-клетки СD4+, макрофаги и ИФγ. Т-клетки CD4+получали от мышей, зараженных HSV за 8 сут до опыта, и переносили сингенным мышам, вскоре после этого зараженным HSV внутрикожно. Одной группе этих мышей вводили антитела к CR3 (чтобы блокировать миграцию макрофагов в место заражения), другой — антитела к ИФγ (чтобы блокировать активацию макрофагов), остальные животные служили контролем. Мышей дополнительной контрольной группы заражали, но не переносили им Т-клетки CD4+. Через 5 сут после заражения определяли количество оставшегося инфекционного вируса. Результаты показывают, что протективный эффект Т-клеток CD4+реализуется при участии макрофагов и ИФγ.
Цитотоксические Т-клетки CD4+. При заражении вирусом кори в организме образуются цитотоксические Т-клетки CD4+, которые распознают и лизируют инфицированные вирусом клетки-мишени, экспрессирующие молекулы МНС класса II. Это указывает, что процессинг и презентация антигенов вируса кори происходят обычным способом — путем фагоцитоза и расщепления (см. гл. 9). Однако существует, предположительно, и другой, еще неизвестный механизм, посредством которого белки или пептиды вируса кори перемещаются из цитозоля в везикулы класса II.
Защитные противовирусные механизмы обобщенно представлены на рис. 16.7, а динамика их индукции — на рис. 16.8.

Рис. 16.7. Проникновению вирусов в клетки слизистой оболочки препятствуют антитела IgA. После первоначального инфицирования вирус может поражать и другие ткани, распространяясь с кровью. Интерфероны, образующиеся как факторы врожденного (ИФα и ИФβ) и приобретенного (ИФγ) иммунитета, делают близлежащие клетки устойчивыми к инфицированию распространяющимся вирусом. Антитела нужны для устранения свободных вирусных частиц, а Т- и НК-клетки — для разрушения инфицированных вирусом клеток-мишеней. (АЗКЦ — антителозависимая клеточноопосредованная цитотоксичность.)

Рис. 16.8. Динамика обнаружения факторов иммунитета при ответе на типичную вирусную инфекцию. После заражения вирусом (например, гриппа или герпеса) в крови и в инфицированных тканях раньше всего выявляются НК-клетки и интерферон. Затем в регионарных лимфоузлах или селезенке обнаруживаются активированные цитотоксические Т-клетки (Тц). После этого в сыворотке начинают определяться нейтрализующие вирус антитела. Активированные цитотоксические Т-клетки исчезают уже на второй или третьей неделе, но им на смену появляются Т-клетки иммунологической памяти, способные сохраняться многие годы.
