Распознавание патогенов клетками врожденного иммунитета
Врожденный иммунитет животных и людей
Врожденный иммунитет — самая ранняя форма иммунной защиты организма от экзогенных (патогенные микроорганизмы) и эндогенных (продукты клеточного распада, так называемые иммунные сигналы опасности) паттернов (англ. pattern — образец). Чувствительные белки, распознающие такие структуры, обозначаются как «паттернраспознающие рецепторы» (ПРР) (англ. Pattern Recognition Receptor, PRR). В активации врожденного иммунитета можно условно выделить три фазы:
- первая фаза распознавания — распознавание чужеродных структур микроорганизмов комбинацией поверхностных рецепторов (сенсоров) врожденного иммунитета;
- вторая фаза — передача сигнала через систему адаптерных молекул;
- третья фаза — выработка эффекторных молекул (цитокинов, хемокинов, противомикробных пептидов, костимулирующих молекул), направленных на элиминацию патогена и/или подключение механизмов адаптивного иммунного ответа.
Стратегия распознавания микроорганизмов клетками врожденного иммунитета основана на распознавании консервативных структур микроорганизмов, общих для разных патогенов и, как правило, отсутствующих у млекопитающих, — так называемых патогенассоциированных молекулярных паттернов (от англ. Pathogen Associated Molecular Pattern; PAMP). Образующиеся при повреждении клеток организма, так называемые сигналы опасно сти (белки теплового шока, модифицированный коллаген, липиды низкой плотности и др.), распознаваемые системой врожденного иммунитета, обозначаются как молекулярные паттерны, связанные с опасностью (англ. Danger Associated Molecular Pattern; DAMP).
Выделяют два способа распознавания патогена клетками системы врожденного иммунитета — опосредованное или прямое.
При опосредованном распознавании сначала происходит опсонизация микроорганизмов антителами с участием комплемента (опсонины) в биологических средах организма. А фагоциты связывают микроорганизмы не напрямую, а опосредованно через рецепторы к иммуноглобулинам и компонентам комплемента.
Растворимые чувствительные белки: рецептор для Clq-комплемента, ЛПО связывающий протеин, маннозосвязывающий лектин, С-реактивный белок (СРБ) — распознают микроорганизмы в биологических средах, а затем взаимодействуют с родственными рецепторами на клетках врожденного иммунитета. Данный белок встречается у плода уже во время родов, что можно наблюдать на бесплатных видео родов. Прямое распознавание патогена осуществляется через мембранные белки, представленные на клетках врожденного иммунитета. К ним относятся рецепторы-«мусорщики» (англ. scavenger), маннозные рецепторы, чувствительные белки комплемента (CR1 CR3 CR4), белки для Fc-фрагмента иммуноглобулина, лектиновые рецепторы и многие другие.
Белки-«мусорщики» (CD163) участвуют в поглощении апоптотировавших клеток, модифицированных липопротеинов, полианионных лигандов (ЛПС, липотейхоевая кислота), а также отдельных бактерий типа нейссерий. Неэффективное удаление апоптотировавших клеток из организма может способствовать развитию аутоиммунного заболевания, например системной красной волчанки (СКВ).
Среди лектиновых рецепторов наиболее изучен маннозный белок, реагирующий с маннозилированными углеводами и связанными с ними гликоконъюгатами. Микроорганизмы, которые экспрессируют структуры, богатые маннозой, распознаются при помощи этого белка. Эндогенные лиганды маннозного белка — миелопероксидаза, лизосомальные гидролазы и др.

ТОП 10:
Распознающие рецепторы врожденного иммунитета
Активация врожденного иммунитета начинается с распознавания антигенных структур с помощью многочисленных рецепторов.
Таблица Распознавание в системе врожденного иммунитета
| Мембранные рецепторы (передают сигнал внутрь клетки) | Toll – подобные (TRL1-10) C -лектиновые Рецепторы-мусорщики (Skavender-рецепторы) Интегриновые |
| Внутриклеточные (цитозольные) | NOD RID DAI |
| Секретируемые | Пентаксины Коллектины Компоненты системы комплемента Фиколины |
Особую группу рецепторов врожденного иммунитета составляют паттерн-распознающие рецепторы (patern recognition recepror – PRR). К ним относятся Toll , NOD , RID – рецепторы. Эти рецепторы распознают общие для многих типов микроорганизмов структуры – липополисахариды, пептидогликаны, флагеллин.
Toll – рецепторы имеют на своей поверхности различные клетки иммунной системы – моноциты, макрофаги, дендритные клетки, нейтрофилы, лимфоциты, а также другие клетки организма – фибробласты, эпителиальные, эндотелиальные клетки. В настоящее время у человека идентифицировано 10 Toll – подобных рецепторов.
Таблица. Toll -подобные рецепторы (TLR) человека и их лиганды
| TLR | Лиганды | Патогены |
| TLR1 | Липопептиды | Грамотрицательные бакетрии, микобактерии |
| TLR2 | Пептидогликан, липотейхоевые кислоты | Грамположительные бактерии, грибы |
| TLR3 | Двухцепочные РНК | Вирусы |
| TLR4 | Липополисахарид | Грамотрицательные бактерии |
| TLR5 | Флагеллин | Бактерии |
| TLR6 | Диациллипопептиды, липотейхоевые кислоты | Микобактерии, грамположительные бактерии, грибы |
| TLR7 | Одноцепочечные РНК | Вирусы |
Таблица. Toll -подобные рецепторы, расположенные на клетках иммунной системы
| Клетки иммунной системы | Toll — рецепторы |
| Нейтрофилы | TLR1,2,4,5,6,7,8,9,10 |
| Моноциты/макрофаги | TLR1,2,4,5,6,7,8 |
| Дендритные клетки | TLR1,2,4,5,6,8,10 |
| В-лимфоциты | TLR1,3,6,7,9,10 |
| Т-лимфоциты (Th1/Th2) | TLR2,3,5,9 |
| Т-лимфоциты (регуляторные) | TLR2,5,8 |
Экспрессия Toll – рецепторов обеспечивает важную связь между врожденным и адаптивным иммунитетом, поскольку их активация приводит к превращению фагоцитов в эффективные антигенпрезентирующие клетки. Экспрессия большинства Toll – рецепторов увеличивается при действии провоспалительных цитокинов.
NOD – рецепторы распознают вещества, которые образуются при повреждении клеток организма (АТФ, кристаллы мочевой кислоты) и вызывают развитие воспалительного процесса. NOD – рецепторы имеются на макрофагах, дендритных клетках, эпителии слизистых оболочек.
Особую группу представляют рецепторы, повышающие эффективность фагоцитоза. К ним относятся рецепторы к С3-компоненту комплемента и Fc -фрагменту иммуноглобулинов. Антиген в комплексе с антителом захватывается клетками врожденного иммунитета через Fc-рецепторы, которые взаимодействуют с Fc-фрагментом иммуноглобулинов. Фагоцитоз опсонизированного объекта (покрытого антителом) в сотни раз более эффективен, чем фагоцитоз свободного объекта.
Гуморальные факторы врожденного иммунитета
Гуморальные факторы врожденного иммунитета – это белки, присутствующие в сыворотке крови, секретах слизистых оболочек, которые синтезируются клетками иммунной системы и могут оказывать бактерицидное, опсонизирующее и т.д. действие на организмы.
Система комплемента
Комплемент – система сывороточных белов крови, каскадная активация которых приводит к лизису бактерий, собственных клеток, инфицированных внутриклеточными паразитами, разрушению иммунных комплексов.
Состоит более, чем из 20 инертных белков сыворотки, 9 из которых являются основными и обозначаются как С1, С2 и т.д. — С9. Формирование комплемента в единое целое или его активация происходит при внедрении в организм чужеродных антигенов.
Комплемент может активироваться двумя путями: классическим и альтернативным.
Противомикробные пептиды
Противомикробные пептиды – катионные белка, способные поражать вирусы, грибы, простейшие. Синтезируются нейтрофилами и эпителиальными клетками при взаимодействии их Toll – рецепторов с антигеном. Осуществляют мгновенный иммунитет. Часто их называют эндогенными антибиотиками. Различают 2 основных вида – дефенсины и кателицидины.
Механизм действия: противомикробные пептиды разрушают наружные мембраны микроорганизмов. Мембраны бактериальных клеток заряжены отрицательно, а пептиды положительно. Разность зарядов обеспечивает их взаимодействие. Катионные белки встраиваются в мембрану микробной клетки, образуя поры. Бактериальная клетка теряет ионы калия, аминокислоты. Внутрь клетки поступает вода, обеспечивая ее гибель.
Белки острой фазы продуцируются моноцитами, макрофагами, фибробластами. Синтез белков острой фазы существенно повышается в ответ на инфекцию.
С-реактивный белок ( CRB ) связывается с поверхностью бактерий, активирует систему комплемента. При бактериальной инфекции увеличивается в 100 раз.
Маннозосвязывающий лектин активирует систему комплемента по лектиновому пути.
Сывороточный амилоид А выступает в роли хемоаттрактанта.
Фибриноген выступает как опсонин
Лизоцим – фермент, содержащийся в отделяемом слизистых оболочек глаз, ротовой полости, носоглотки, грудном молоке. Вырабатывается моноцитами крови и тканевыми макрофагами. Разрушает пептидогликаны клеточных стенок бактерий.
Фагоцитоз
Фагоцитоз – это активное распознавание и поглощение микроорганизмов фагоцитирующими клетками с их последующей инактивацией и перевариванием. Фагоцитоз – самый древний вид защиты, унаследованный нами в ходе эволюции. Выраженной фагоцитарной активностью обладают нейтрофилы, моноциты и макрофаги.
Нейтрофилы происходят от стволовой клетки костного мозга. Это короткоживущие неделящиеся клетки с сегментированным ядром и набором гранул, содержащих большое количество бактерицидных веществ. Их время жизни составляет 2-3 суток. Нейтрофилы являются основными клетками, осуществляющими уничтожение внеклеточных микроорганизмов.
Макрофаги образуются из стволовой клетки красного костного мозга, на территории которого дифференцируются до стадии моноцита. Моноциты попадают в ток крови и расселяются по тканям, превращаясь в тканевые макрофаги, где функционируют в течение недель или месяцев. Для них характерно изобилие гранул, близких по составу к содержимому гранул нейтрофилов.
Их функциями является поглощение и уничтожение внедрившихся микроорганизмов (в основном внутриклеточных), а также поврежденных, дегенерированных, вирусинфицированных и опухолевых клеток и образующихся иммунных комплексов. Это клетки — «мусорщики».
Нейтрофилы осуществляют основную защиту от пиогенных (внеклеточных) бактерий, макрофаги – от внутриклеточных паразитов (вирусы, грибы, простейшие).
Нейтрофилы – это основные участники острого воспаления, макрофаги – хронического, они способны стимулировать образование гранулем.
Функции фагоцитов:
n Фагоцитарная – захват и внутриклеточное переваривание микроорганизмов.
n Антигенпрезентирующая – презентация антигена Т-лимфоцитам в комплексе с молекулами главного комплекса гистосовместимости (HLA). Этой функцией обладают антигенпрезентирующие макрофаги.
n Секреторно-регуляторная – синтез и секреция некоторых белков системы комплемента, отдельных цитокинов, лизоцима, белков системы свертывания крови.
n Цитотоксическое действие фагоцитов.
Связывание патогена с фагоцитом может быть прямым и опосредованным. Прямое распознавание происходит с участием Toll-рецепторов. При опосредованном распознается опсонизированный объект, покрытый антителами или C3b – компонентом комплемента.
Хемотаксис
Для того, чтобы процесс фагоцитоза произошел, необходимо сближение фагоцитирующих клеток с антигеном, который вызвал повреждение. Для этого нейтрофилы должны покинуть кровеносное русло, поскольку очаги внедрения антигена чаще имеют тканевую локализацию. Это возможно благодаря хемотаксису. Хемотаксис – движение фагоцитов по концентрационному градиенту химических веществ – хемоаттрактантов. В роли хемоаттрактантов для нейтрофилов выступают продукты жизнедеятельности бактерий, белки системы комплемента, цитокины и.т.д.
Основными хемоаттрактантами для макрофагов являются гамма-интерферон, хемотаксический макрофагальный фактор.
Адгезия – прилипание
Начинается с адгезии (прилипания) микробной частицы к поверхности фагоцита. Процесс поглощения идет эффективнее, если микробные клетки опсонизированы, то есть покрыты белками системы комплемента и специфическими антителами класса IgG. Особенно важно это для бактерий, имеющих капсулу (пневмококк, менингококк, кишечная палочка, гемофильная палочка и т.д.)
Эндоцитоз (поглощение)
Участок мембраны фагоцита в месте контакта с объектом уплотняется, вытягивается и надвигается на объект подобно механизму застежки «молния» до тех пор пока объект не будет полностью поглощен в фагосому.
Дегрануляция
Цитоплазматические гранулы фагоцитирующих клеток сливаются с фагосомой и образуется фаголизосома, в которой происходит киллинг и разрушение захваченной микробной частицы с помощью антимикробных факторов. Антимикробные системы делятся на те, которые требуют кислород – кислородзависимые и те, которые не требуют кислород – кислороднезависимые.
Кислородзависимые факторы (активные формы кислорода) образуются в ходе респираторного взрыва, представляющего собой каскад окислительных реакций.
Включают:
n супероксидный анион (О2-)
n перекись водорода (Н2О2)
n синглетный кислород (О2)
n гидроксильный радикал (ОН˙)
n оксид азота (NO)
Активные формы кислорода являются очень мощными окислителями, вызывают повреждение липидов, белков, ДНК мироорганизмов, оказывают летальное действие на биологические системы.
К кислороднезависимой группе бактерицидных факторов относятся лизоцим, некоторые протеолитические ферменты, лактоферрин, катионные белки, дефенсины.
Лактоферрин – связывает железо, предотвращает рост и размножение бактерий.
Катионные белки – вызывают повреждение клеточных мембран, лизируют бактериальные клетки.
Дефенсины – встраиваются в липидный слой клеток, нарушают ее проницаемость, обладают летальным действием на широкий спектр бактерий, грибов, вирусов.
Экзоцитоз – удаление продуктов разрушения
Распознающие рецепторы врожденного иммунитета
Активация врожденного иммунитета начинается с распознавания антигенных структур с помощью многочисленных рецепторов.
Таблица Распознавание в системе врожденного иммунитета
| Мембранные рецепторы (передают сигнал внутрь клетки) | Toll – подобные (TRL1-10) C -лектиновые Рецепторы-мусорщики (Skavender-рецепторы) Интегриновые |
| Внутриклеточные (цитозольные) | NOD RID DAI |
| Секретируемые | Пентаксины Коллектины Компоненты системы комплемента Фиколины |
Особую группу рецепторов врожденного иммунитета составляют паттерн-распознающие рецепторы (patern recognition recepror – PRR). К ним относятся Toll , NOD , RID – рецепторы. Эти рецепторы распознают общие для многих типов микроорганизмов структуры – липополисахариды, пептидогликаны, флагеллин.
Toll – рецепторы имеют на своей поверхности различные клетки иммунной системы – моноциты, макрофаги, дендритные клетки, нейтрофилы, лимфоциты, а также другие клетки организма – фибробласты, эпителиальные, эндотелиальные клетки. В настоящее время у человека идентифицировано 10 Toll – подобных рецепторов.
Таблица. Toll -подобные рецепторы (TLR) человека и их лиганды
| TLR | Лиганды | Патогены |
| TLR1 | Липопептиды | Грамотрицательные бакетрии, микобактерии |
| TLR2 | Пептидогликан, липотейхоевые кислоты | Грамположительные бактерии, грибы |
| TLR3 | Двухцепочные РНК | Вирусы |
| TLR4 | Липополисахарид | Грамотрицательные бактерии |
| TLR5 | Флагеллин | Бактерии |
| TLR6 | Диациллипопептиды, липотейхоевые кислоты | Микобактерии, грамположительные бактерии, грибы |
| TLR7 | Одноцепочечные РНК | Вирусы |
Таблица. Toll -подобные рецепторы, расположенные на клетках иммунной системы
| Клетки иммунной системы | Toll — рецепторы |
| Нейтрофилы | TLR1,2,4,5,6,7,8,9,10 |
| Моноциты/макрофаги | TLR1,2,4,5,6,7,8 |
| Дендритные клетки | TLR1,2,4,5,6,8,10 |
| В-лимфоциты | TLR1,3,6,7,9,10 |
| Т-лимфоциты (Th1/Th2) | TLR2,3,5,9 |
| Т-лимфоциты (регуляторные) | TLR2,5,8 |
Экспрессия Toll – рецепторов обеспечивает важную связь между врожденным и адаптивным иммунитетом, поскольку их активация приводит к превращению фагоцитов в эффективные антигенпрезентирующие клетки. Экспрессия большинства Toll – рецепторов увеличивается при действии провоспалительных цитокинов.
NOD – рецепторы распознают вещества, которые образуются при повреждении клеток организма (АТФ, кристаллы мочевой кислоты) и вызывают развитие воспалительного процесса. NOD – рецепторы имеются на макрофагах, дендритных клетках, эпителии слизистых оболочек.
Особую группу представляют рецепторы, повышающие эффективность фагоцитоза. К ним относятся рецепторы к С3-компоненту комплемента и Fc -фрагменту иммуноглобулинов. Антиген в комплексе с антителом захватывается клетками врожденного иммунитета через Fc-рецепторы, которые взаимодействуют с Fc-фрагментом иммуноглобулинов. Фагоцитоз опсонизированного объекта (покрытого антителом) в сотни раз более эффективен, чем фагоцитоз свободного объекта.
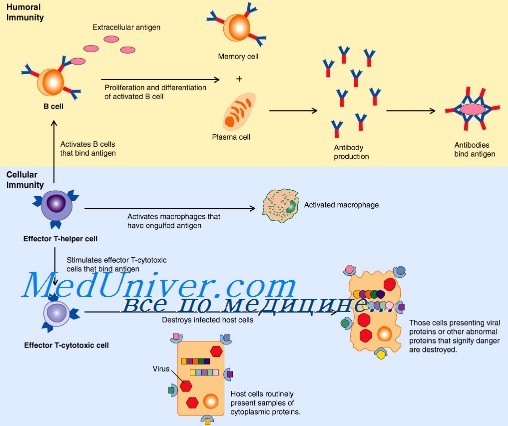
Активация врожденного иммунитета. Стадия активации врожденного иммунитетаВрожденная иммунная защита первично нацелена на распознавание и элиминацию чужеродных структур. Инфекционные агенты располагают многими факторами вирулентности, воздействие которых может быть разрушительным для защитных механизмов врожденного иммунитета. Организм хозяина выработал уникальные стратегии распознавания патогенных структур микроорганизмов, процессинга их и презентации антигенов Т-лимфоцитам. Активация врожденного иммунитета, обеспечивающая оптимальное развитие специализированных эффекторных механизмов, может быть концептуально разделена на две стадии: 1 — фаза детекции, в течение которой комбинация поверхностных рецепторов распознает присутствие чужеродных структур при вторжении микрорганизмов, и 2 — фаза трансмиссии этой сенсорной информации на язык, понятный для клеток адаптивной иммунной системы, например, через продукцию хемокинов и цитокинов. Универсальная стратегия распознавания микроорганизмов эффекторами врожденного иммунитета основана на детекции доменных структур, которые называются патоген-ассоциированными молекулярными образами — PAMPs (pathogen-associated mollecular patterns), а распознающие их рецепторы врожденной иммунной системы — образраспознающими рецепторами — PRRs (pattern-recognition receptors). PAMPs — консервативные (неспецифические, невариабельные) структуры микроорганизмов общие для разных патогенов, их нет у млекопитающих, поэтому они распознаются иммунной системой как «чужое» с помощью паттерн-распознающих рецепторов (PRRs), включая семейство сигнальных Toll-подобных рецепторов (TRL). Существуют еще и альтернативные рецепторы врожденного иммунитета, такие как нуклеотид-связывающий олигомеризующийся домен (nucleotide-binding oligomerization domain — NOD), локализующийся внутриклеточно. NOD распознают РАМР независимо от участия TLR, активируют ядерный фактор KB (NF-kB) и усиливают продукцию IFN-y.
Эти эволюционно законсервированные рецепторы распознают PAMPs, включающие различные компоненты бактериальной стенки, среди которых наиболее известные — это липополисахариды, пептидогликан, липотейхоевые кислоты, маннаны, флагеллин, бактериальная ДНК, вирусные двуспиральные РНК, глюканы. До недавнего времени рассматривалось, что PAMPs обычно экспрессируются на поверхностях микробов и отсутствуют на клетках организма хозяина, однако в последнее время появляются работы, демонстрирующие наличие паттернов хозяина, распознаваемых рецепторами этого класса. В настоящее время известно два типа рецепторов врожденного иммунитета, обеспечивающих информирование организма о проникновении патогена. К первому типу относятся растворимые рецепторы для патогенов: C1q комплемента, ЛПС-связывающий белок, маннозосвязывающий лектин, С-рективный белок. Второй тип рецепторов для патогенов — рецепторы, экспрессирующиеся клетками врожденного иммунитета. Закодированные в геноме, рецепторы врожденной иммунной системы имеют ряд отличий от рецепторов лимфоцитов. Они экспресси-руются на эффекторных клетках врожденной иммунной системы, осуществляющих первую линию защиты, а также на профессиональных антигенпрезентирующих клетках (макрофагах, дендритных клетках и В-лимфоцитах). — Также рекомендуем «Варианты образраспознающих рецепторов PRRs. Toll-подобные рецепторы» Оглавление темы «Врожденный иммунитет»:
|
