Реакция иммунитета на бактерии

Оглавление темы «Клеточные имунные реакции. Иммунная память. Иммунное реагирование при инфекциях. Иммунодефициты.»:
1. Клеточные имунные реакции. Индукция Т-клеточно-опосредованных реакций. Клеточный иммунитет.
2. Уничтожение клетки-мишени цитотоксическими Т лимфоцитами. Альтернативный механизм уничтожения клетки-мишени. Реакции ГЗТ. Реакции гиперчувствительности замедленного типа.
3. Иммунная память. Бустер эффект. Вакцинопрофилактика.
4. Иммунное реагирование при инфекциях. Иммунный ответ при вирусных инфекциях. Гуморальные иммунные реакции при вирусемии ( вирусных инфекциях ).
5. Клеточные иммунные реакции при вирусных инфекциях. Иммунный ответ при бактериальных инфекциях.
6. Иммунный ответ при грибковых инфекциях. Иммунитет и грибы. Гуморальные реакции иммунитета при грибковых инфекциях. Клеточный иммунитет при грибковых инфекциях.
7. Иммунные реакции при протозойных инфекциях. Иммунитет при паразитах. Иммунная система при простейших в организме.
8. Толерантность иммунитета. Устойчивость иммунной системы. Механизмы поддержания толерантности иммунитета.
9. Естественная толерантность иммунитета. Искусственная толерантность иммунной системы. Иммунный паралич. Расщеплённая толерантность иммунитета. Нарушения толерантности иммунной системы. Аутоимунные заболевания.
10. Иммунодепрессивное состояние. Иммунодефициты. Врождённые иммунодефициты. Гиперкортицизм ( синдром Кушинга ). Двусторонняя гиперплазия коры надпочечников ( болезнь Иценко-Кушинга ) при иммунодефицитах. Ионизирующая радиация и иммунодефицит.
Клеточные иммунные реакции при вирусных инфекциях. Иммунный ответ при бактериальных инфекциях.
Клеточные иммунные реакции — основная система уничтожения и удаления патогенных вирусов. Нарушения свойств иммунокомпетентных клеток значительна осложняют течение вирусных заболеваний: возбудители обычно лёгких и самоограничивающихся поражений могут вызывать тяжёлые, трудно излечиваемые инфекции. Важнейшую роль в разрушении инфицированных клеток играют цитотоксические Т-лимфоциты. После появления достаточных титров AT способность убивать заражённые вирусами клетки приобретают макрофаги и гранулоциты.
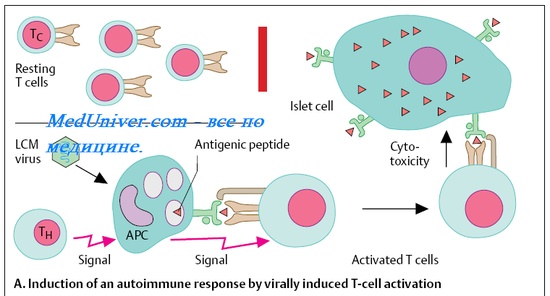
Иммунный ответ при бактериальных инфекциях
Первую ступень защиты от патогенных бактерий образуют факторы неспецифической резистентности — кожные и слизистые барьеры, а после их преодоления — фагоцитирующие клетки. Действие факторов неспецифической резистентности направлено не на А г бактерий, а на бактериальную клетку в целом.
Вторую ступень защиты при бактериальных инфекциях образуют факторы специфической защиты, среди которых наиболее значимую роль играют антибактериальные AT. Характер специфических защитных реакций определяется особенностями патогенеза того или иного заболевания. Если возбудитель продуцирует экзотоксины, то доминируют механизмы их нейтрализации; при этом сам возбудитель может выживать и длительно сохраняться в организме реконвалесцентов и здоровых лиц (например, возбудитель дифтерии). Ig различных классов нейтрализуют (агглютинируют или пре-шшитируют) бактерии и их токсины; опосредуют разрушение бактерий (преимущественно через комплементзависимый цитолиз); опсонизируют их, стимулируя фагоцитоз бактерий, а также экранируют рецепторы чувствительных клеток.
Проникновение бактерий, способных к внутриклеточному паразитированию, увеличивает значимость клеточных реакций, уничтожающих заражённые клетки. Следует упомянуть о реакциях ГЗТ, практически постоянно встречающихся при многих бактериальных инфекциях с длительным инкубационным периодом (туберкулёз, бруцеллёз). В некоторых случаях иммунные механизмы не в состоянии обеспечить полное удаление возбудителя, что приводит к развитию носительства или хронизации инфекции.
— Также рекомендуем «Иммунный ответ при грибковых инфекциях. Иммунитет и грибы. Гуморальные реакции иммунитета при грибковых инфекциях. Клеточный иммунитет при грибковых инфекциях.»
Источник
Иммунитет, как специфическая система организма, имеет прекрасные и эффективно действующие механизмы и реакции для борьбы с внешними угрозами здоровью. Как инфекция и иммунитет влияют друг на друга, так проявляется иммунный ответ, так протекает заболевание и вырабатывается схема действий и реакций на повторное развитие болезни.
Иммунитет
Иммунная система — это совокупность защитных мер организма для противостояния и защиты от генетически чужеродных микроорганизмов.
Главными рычагами для начала иммунного ответа являются:
- Местный иммунитет — специальная система слизистых оболочек и кожных покровов для защиты организма в местах непосредственного контакта с внешней средой;
- Общий иммунитет — функционирование лейкоцитов, иммуноглобулинов, системы комплимента при взаимодействии всех иммунных органов и реакций на возбудителя болезни.
Физиология иммунных ответов на инфекционные болезни подразделяет иммунитет на два подтипа:
- Стерильным подтипом считается наличие эффективного ответа на возбудителя заболевания при повторном заражении им, и после проведение вакцинации. При этом патогенный объект полностью удаляется из организма;
- Нестерильным или инфекционным подтипом предполагают отсутствие иммунного ответа на патогенный объект, вследствие его наличия в организме продолжительное время. В развитии инфекционного иммунитета особую роль играют фагоциты, гуморальный и клеточный механизмы. Он развивается после начала распространения и размножения чужеродной частицы, вызывающей инфекцию.

Инфекция
Инфекция — это угроза заражением вредоносным вирусом, бактерией, грибками, паразитами, простейшими, способными развить в организме человека инфекционный процесс.
Инфекционное течение болезни — заболевание, вызванное проникновением, размножением, продуктами жизнедеятельности болезнетворных объектов, которые имеют способность преодолевать сопротивляемость организма и приводить к интоксикационным процессам в нем.
Стадии инфекционного заболевания:
- Инкубационная, то есть период, при котором происходит проникновение вредоносного микроорганизма, его развитие, увеличение численности, выделение токсинов в кровь;
- Продромальная — стадия, время при котором организм проявляет симптоматическую картину заболевания;
- Развивающая — период развития болезни, симптоматика дополняется более четкими признаками, характеризующими заболевание;
- Время реконвалесценции — период, при котором происходит: либо выздоровление, либо кризис или лизис болезни, либо переход в хроническое состояние. В свою очередь выздоровление бывает полноценным или с наличием осложнений различного характера.
Инфекции распределяются по видам:
- Общий — через проникновение в кровеносную систему, возбудитель распространяется по всем органам и системам;
- Локальный — проникновение возбудителя через поврежденную ткань, при котором происходит развитие местного воспалительного процесса;
- Генерализованный — распространение инфекции по кровеносной и лимфатической системам;
- Латентный — патогенный организм, ведя свою жизнедеятельность не проявляет внешней симптоматики, переводя заболевание в хроническую форму;
- Интеркуррентный — тип инфекций, относящийся к иммунодефицитным состояниям;
- Манифестный — вид болезней с острым проявлением клинической картины;
- Очаговый — воспалению подвергается определенный орган, приводящее к нарушению его функционирования и разрушению его тканей.

Особенности противостояния к инфекциям
Инфекции носят разный характер, соответственно, и защита организма на каждого возбудителя имеет свои наиболее активные механизмы и реакции. Инфекционный иммунитет развивается:
- При воздействии болезнетворных микробов, бактерий, вирусов, паразитов, грибков, простейших;
- На наличие токсических веществ для предупреждения интоксикации.
Особенности иммунитета при бактериальных инфекциях состоит в том, что иммунный ответ на возникновение бактериального возбудителя имеет двойную структуру:
- Специфический для уничтожения болезнетворной бактерии;
- Антитоксический — для утилизации продуктов жизнедеятельности патогенной флоры.
Для бактериальных инфекционных процессов действия механизмов иммунной защиты зависят от: патогенеза возбудителя, уровня токсичности, проявлением аллергии у больного.
В борьбе с бактериями система иммунитета использует клетки фагоцитов, специальные антитела, макрофаги, естественные киллеры и С-реактивные и маннозосвязывающие протеины, так же начинает вырабатываться вещества для утилизации токсинов, вырабатываемых бактериями.
В момент наступления вирусной инфекции, внеклеточной или внутриклеточной, иммунная система включает в работу особые антитела, клетки-киллеры естественного типа и типа Т, интерферонные компоненты, специальные парализаторы вирусов. Получается комплекс механизмов иммунитета, направленный на уничтожение вируса и пораженных клеток.
Если организм человека подвергся грибковой инфекции, то иммунные функции выстраиваются таким образом, чтобы вырабатывать достаточное количество противогрибковых макрофагов на клеточном уровне. Работа макрофагов по антителозависимой клеточной цитотоксичности, позволяет прицепиться к грибку-паразиту и уничтожать его, что проявляется высоким уровнем аллергических реакций при появлении возбудителя болезни.
Вследствие заражения инвазивными микроорганизмами, иммунная защита действует на уровне гуморальной и клеточной защиты. Макрофаги и лимфоциты, под влиянием антител типов М и G, начинают уничтожать простейших, вызывая сильные аллергические реакции.
Иммунная система совершенно по иному распространяет свое действие на паразитарные инфекции гельминтного типа. Здесь главным оружием борьбы являются клетки эозинофилы, вырабатывающие особые ферментные вещества, токсины и белки, которые уничтожают паразитов и их яйца внутри организма. Слизистые кишечника вырабатывают специальные вещества, которые усиливая перисталическую функцию, изгоняют гельминтов и продукты их жизнедеятельности из организма.

Постинфекционная защита
Какой иммунитет возникает после перенесения инфекционного заболевания —
постинфекционная реакция организма на повторное заражение возбудителем проявляется долгое время, в среднем от одного года до трех-пяти лет. На некоторые инфекции организм имеет пожизненную защиту, вторичное заражение практически исключено. Данный вид не передается по наследству от матери к ребенку, для него характерна индивидуальность. Постинфекционный иммунитет специфичен и развивается только на определенное заболевание.
Развитие инфекционного иммунитета на примере инфекции
Инфекционный мононуклеоз — это болезнь, вызывающаяся вирусом семейства герпесвирусов, четвертый тип, подтип Эпстайна-барр. Для него характерно наличие антигенных компонентов.
Источник заражения — это инфицированный человек, путем является воздушно-капельный или контактный способ.
Главная характеристика — симптоматическая картина:
- Высокая температура тела;
- Увеличение лимфатических узлов на шее, углочелюстной области, в брыжейке;
- Головная боль;
- Боль в горле;
- Общая слабости;
- Воспаление небных миндалин;
- При пальпации обнаруживается увеличение печени и селезенки;
- Характерные высыпания в виде мелких папул, держащиеся на теле не более трех дней;
- Нарушения в формуле крови: лейкоцитоз, нейтрофилез, повышение лимфоцитов, моноцитов, атипичных мононуклеаров.
Вирус инфекционного мононуклеоза поражает ткани: лимфатическую, строму органов кроветворения, так же молекулы вируса поражают кровь, циркулирующею вне органов кроветворения. Вызывает сопутствующее заболевания стафилококком и стрептококком.
После недельного скрытого развития внутри организма, инфекционный мононуклеоз отличается острым выявлением признаков. На третий день наступает интоксикация, признаки болезни ярко выражены.
Осложнения:
- Гемолитическая анемия аутоиммунного типа, при которой кровяные красные клетки — эритроциты принимаются за чужеродные;
- Тромбоцитопения;
- Гранулоцитопения;
- Разрыв сесезенки;
- Параличи разного характера;
- Энцефалит, менингит;
- Гепатит;
- Пневмония;
- Перикардит;
- Психоз.
Действия иммунной системы на внедрение вируса: лимфоциты типа В, пораженные вирусом, переходят в плазмоциты, вырабатывающие иммунноглобулиновые тела с небольшой специфичностью, постепенно увеличивается активность лимфоц. Т, супрессоров Т, которые сдерживают изменение лимфоцитов В. Начинается активная выработка цитоксических лимфоцитов типа Т, уничтожающих инфицированные клетки. При этом вирус сохраняется в организме всю жизнь, а заболевание имеет хроническое течение. Таким образом, вырабатывается нестерильный инфекционный иммунитет.
Видео
Источник
Бактерии являются высокоорганизованными микроорганизмами, относятся к классу прокариотов, имеют независимый метаболизм, размножаются бинарным делением и существуют в гаплоидном состоянии. Они имеют сложное строение. Снаружи бактерии покрыты оболочкой (клеточной стенкой), представляющей собой биогетерополимер сложного состава. Основу клеточной стенки составляет пептидогликан. Под клеточной стенкой располагается цитоплазматическая мембрана (ЦПМ), состоящая, в основном, из белков, липидов и небольшого количества углеводов и РНК. Компоненты ЦПМ для организма человека являются сильными эндотоксинами. Ряд бактерий содержит жгутики, являющиеся средством передвижения. У преобладающего числа бактерий имеются фимбрии, которые используются для прикрепления к клеткам хозяина. Многие бактерии имеют капсулу (пневмококки, менингококки, гемофильные бактерии). Как правило, капсулы образованы полисахаридными молекулами или белковыми молекулами. Многие полисахариды капсулы и некоторые белки жгутиков являются Т-независимыми антигенами. Ряд бактерий обладает способностью вырабатывать экзотоксины, способные поражать различные органы и ткани и нарушать в них жизнеобеспечивающие процессы.
Бактерии проникают в организм, как правило, через респираторный тракт, желудочно-кишечную трубку, мочеполовую систему или через поврежденную кожу. В зависимости от количества проникших микробов и их вирулентности включаются разные механизмы защиты организма. При попадании в организм малого количества микробов, обладающих низкой вирулентностью, реакция неспецифических гуморальных факторов и фагоцитирующих клеток оказывается достаточной для эффективного их элиминирования. При проникновении в организм высоковирулентных бактерий или массивных количеств бактерий на помощь неспецифическим факторам защиты приходят иммунные механизмы. На внеклеточные бактерии реагирует гуморальный иммунитет, на внутриклеточные бактерии – клеточный иммунитет.
Среди неспецифических факторов защиты организма от бактериальной инфекции ведущее место занимают лизоцим, комплемент и система фагоцитарных клеток.
Лизоцим – фермент мурамидаза, обладающий антибактериальной активностью. Продуцируется тканевыми макрофагами и нейтрофилами. В крови присутствует в концентрации 1 мг/мл. Способен лизировать многие сапрофиты (например, Micrococcus lysodeicticus) и некоторые патогенные бактерии. Лизоцим также повышает фагоцитоз бактерий в результате изменения их поверхностных свойств и усиливает литическое действие гидролитических ферментов на бактерии.
Комплемент – комплекс белков сыворотки крови, который способен индуцировать воспаление, лейкотаксис и вызывать лизис бактериальных клеток. Бактерии и их продукты (ЛПС) активизируют систему комплемента по альтернативному пути, активируя С3 компонент комплемента В результате такой активации формируется мембраноатакующий комплекс (МАК), состоящий из молекул С5, С6, С7, С8, С9, который, встраиваясь в мембрану клетки, формирует трансмембранную пору, через которую происходит гипергидратация клетки, вызывающая ее гибель. Компоненты комплемента С3b способны выступать в качестве опсонинов, тем самым стимулируя фагоцитоз микробов.
Полиморфноядерные нейтрофилы и макрофаги среди клеток с фагоцитарной активностью играют решающую роль в борьбе с бактериальной инфекцией. ПМЯЛ обеспечивает основную защиту организма от пиогенных бактерий, макрофаги – от внутриклеточных бактерий. Поглощенные бактерии под влиянием бактерицидных систем (кислородзависимых и кислороднезависимых механизмов) в большинстве случаев разрушаются и перевариваются (с помощью протеолитических ферментов) внутри фагоцитов В ряде случаев этого не происходит в силу либо высокой устойчивости микробов к действию бактерицидных факторов клетки, либо сниженной литической активности самих фагоцитов.
Источник

Иммунный ответ при инвазии внеклеточных микроорганизмов Иммунный ответ, направленный против внеклеточно паразитирующих бактерий (стафилококки, стрептококки, клостридии, возбудители дифтерии, кишечных инфекций и др.), а также некоторых крупных вирусов (кори, полиомиелита), преследует две цели: элиминацию самих возбудителей и нейтрализацию их токсинов.
Большинство возбудителей бактериальных инфекций, размножающиеся внеклеточно, обусловливают образование специфических антител, которые связываются с поверхностью бактерий и в присутствии комплемента вызывают цитотоксические реакции (бактериолиз). Кроме того, нагруженные антителами или комплементом бактерии легко подвержены фагоцитозу (опсонизация).
Таким образом, главную протективную роль в иммунном ответе против бактериальных инфекций играет гуморальный иммунный ответ, проявляющийся синтезом специфических антител — иммуноглобулинов. В реализации такого ответа участвуют В-лимфоциты, Т-хелперы (CD4 Т-лимфоциты) и антиген-представляющие клетки.
Специфические Т-клеточные рецепторы (TcR) способны распознавать чужеродный антиген только в комплексе с собственными клеточными антигенами главного комплекса гистосовместимости (MHC) на поверхности вспомогательных антигенпредставляющих клеток. Професиональными АПК организма являются макрофаги, дендритные клетки и В-лимфоциты. Их роль в различных типах иммунного ответа неодинакова. Так, в гуморальном иммунном ответе в основном функцию АПК осуществляют В-лимфоциты. В-лимфоциты способны распознавать антиген в растворе и связывать белковые, полисахаридные и липопротеидные растворимые антигены с помощью специфических IgМ-рецепторов (а также рецепторов CR1 к C3b-компоненту комплемента, который в свою очередь может быть связан с микробом), тогда как CD4 Т-лимфоциты могут распознать только короткие пептидные фрагменты белковых антигенов в комплексе с молекулами MHC II класса. Таким образом, чтобы Т-лимфоцит распознал антиген и активировался, необходим “процессинг” антиген/MHC II антигенпредставляющей клеткой. При этом антиген фагоцитируется АПК и расщепляется в кислой среде фаголизосомы. Среди образовавшихся фрагментов идет отбор по способности комплексироваться с молекулами MHC II, пресинтезированными в эндоплазматическом ретикулуме той же клетки. Специальная молекула — шаперон — переносит MHC II внутрь эндосомы, где и образуется ее комплекс с пептидом, который далее презентируется на мембране клетки. Комплекс антигенного пептида с MHC II распознается TcR при участии корецепторной молекулы CD4. Причем начальный контакт между АПК и Т-лимфоцитом обеспечивается взаимодействием адгезионных молекул B7 и CD28, которые играют также роль костимулирующих факторов. Дополнительным сигналом активации CD4 Т-лимфоцита служит выделяемый активированной антигенпредставляющей клеткой IL-1b. IL-1b продуцируется многими клетками организма в ответ на инфекцию, действие микробных токсинов, воспалительных агентов, некоторых других цитокинов, активированных компонентов комплемента и обладает способностью стимулировать Т- и В-лимфоциты, повышать продукцию гепатоцитами острофазных белков, продукцию и секрецию других цитокинов различными клетками, усиливать клеточную пролиферацию.
После активации в результате распознавания антигена CD4 Т-лимфоцит дифференцируется в Т-хелпер (Тх). Причем, при гуморальной форме иммунного ответа, осуществляемой против внеклеточных инфекционных агентов, наблюдаются реакции воспаления в рыхлой соединительной ткани. В ней участвуют базофилы и тучные клетки, которые при активации выделяют интерлейкин-4. В присутствии IL-4 CD4 Т-лимфоциты (Тх0) дифференцируются в Т-хелперы II типа (Тх2) и начинают сами синтезировать IL-4, который является главным фактором роста Тх2 и В-лимфоцитов. В результате образуется клон Тх2, способных активировать специфические В-лимфоциты, связавшие конкретный антиген, вызвавший данный иммунный ответ. При этом Тх2 распознает с помощью CD4 молекулы антиген, ассоциированный с MHC II, адгезионными молекулами в данном случае являются CD40L и CD40. Вторым сигналом для активации В-лимфоцитов служит выделяемый Тх2 IL-4, а также необходимо присутствие на мембране В-лимфоцитов иммуноглобулинового рецептора, связанного с антигеном. Активированные Тх2 специфические В-лимфоциты начинают усиленно продуцировать соответствующие по специфичности антитела — иммуноглобулины.
Антитела могут участвовать в различных способах элиминации инфекционных агентов: опсонизации бактерий и усиления их фагоцитоза через FcR и CR1-рецепторы фагоцитов; нейтрализации бактериальных экзотоксинов; активации системы комплемента с последующим действием ее мембраноатакующего комплекса. Кроме того, специфические антитела класса IgA, присутствующие на поверхности слизистых оболочек (sIgA), препятствуют колонизации поверхности слизистых бактериями и участвуют в нейтрализации их токсинов.
Формирование механизмов саногенеза (выздоровления) при различных бактериальных инфекциях лежит в основе некоторых особенностей иммунитета, возникающего в течение таких заболеваний.
Так, при бактериальных инфекциях, возбудители которых продуцируют экзотоксин (дифтерия, столбняк ботулизм, газовая гангрена и др.) ведущую роль в формировании иммунитета играют образующиеся в организме антитела (антитоксины). Взаимодействие молекулы антитоксина и молекулы токсина может приводить к разным результатам:
· Блокаде рецепторного участка молекулы токсина и, вследствие этого, ограничению фиксации токсина на рецепторах клеток-мишеней;
· Прямой нейтрализации каталитического (энзиматического, токсического) участка молекулы токсина;
· к образованию иммунного комплекса с нейтрализацией токсического, рецепторного и (или) транслокационного участков (субъединиц) токсина. Такие комплексы фагоцитируются и утилизируются клетками макроорганизма . Однако антитоксические антитела не блокируют адгезию бактерий на поверхности клеток-мишеней и их колонизацию. Вследствие этого, искусственный антитоксический иммунитет не создает полной защиты макроорганизма и не предотвращает фиксацию бактерий на поверхности клеток-мишеней, колонизацию клеток и ткани, размножение бактерий.
В тех случаях, когда патогномоничные возбудители образуют экзотоксины (столбняк, дифтерия), антитоксины легко нейтрализуют токсические вещества, однако при первичной инфекции они могут синтезироваться слишком поздно и не в состоянии защитить организм.
При другой группе бактериальных инфекций (менингококковая инфекция, коклюш, легионеллез и др.) решающая роль принадлежит иммунному лизису и фагоцитозу бактерий. Образующиеся при этих заболеваниях IgG инициируют целый ряд антителоопосредованных биологических реакций:
а) при фиксации АТ на поверхности бактерий происходит активация комплемента по классическому варианту с образованием мембраноатакующего комплекса и последующим лизисом обнаженных участков мембран бактерий;
б) опсонизация бактерий антителами с последующим взаимодействием Fс — фрагментов антител с Fс — рецепторами макрофагов, что приводит к усилению поглотительной и периваривающей активности фагоцита;
в) образующийся комплекс «бактериальный АГ-АТ-С 1,4,2,3В» фиксируются на рецепторах макрофагов к С3В , что также ведет к усилению поглотительной активности таких комплексов фагоцитами;
г ) нейтрализация антителами антифагинов , выделяемых бактериями наружу (фактор, препятствующий образованию фагоцитами псевдоподий; фактор, препятствующий миграции макрофагов) или входящих в состав их анатомических структур (М-протеин стрептококков, капсульные вещества пневмококков и др.).
Таким образом, формирующийся при менингококковой инфекции, коклюше, легионеллезе иммунитет зависит от уровня циркулирующих IgG, содержания и активности компонентов комплемента, а также от функционального состояния фагоцитов.
Иммунный ответ при инвазии внутриклеточных микроорганизмов Внутриклеточные паразиты, способны длительно существовать внутри фагоцитов и даже размножаться в них (туберкулез, туляремия, бруцеллез, листериоз и др.).
Основными механизмами, позволяющими бактериям осуществлять внутриклеточный паразитизм являются :
· Блокада фаголизосомального слияния (микобактерии туберкулеза);
· Резистентность бактерий к действию лизосомальных ферментов (гонококки, стафилококки);
· Способность бактерий быстро покидать фагосомы после поглощения и длительно пребывать в цитоплазме (листерии).
Клеточный иммунитет имеет особое значение в тех случаях, когда реакции фагоцитоза оказываются несостоятельными, вследствие чего возникает персистенция патогенных бактерий, формируется скопление лимфоидных клеток и макрофагов (гранулема). Иногда это приводит к неспецифической стимуляции макрофагов, что обусловливает повышение резистентности к другим инфекциям. Например, при высоком уровне клеточного иммунитета против туберкулеза повышается устойчивость к грибам, простейшим, бруцеллам, листериям.
Следовательно, для заболеваний с длительным внутриклеточным пребыванием и размножением возбудителя (персистенция) характерно образование гранулем в пораженной ткани. Такие бактерии становятся недоступными для действия антител и гуморальных антибактериальных факторов. Механизм саногенеза и формирования иммунитета при таких заболеваниях связан, прежде всего, с образованием цитотоксических Т-лимфоцитов, оказывающих киллинг-эффект на клетки-мишени, содержание в них паразитирующих бактерий и маркированных рецепторами MHC-I, презентирующих антигены этих бактерий.
Основная протективная роль в иммунном ответе, направленном против внутриклеточных паразитов (Micobacterium tuberculosis, грибов, простейших, вирусов), принадлежит клеточным механизмам. Способность перечисленных микробов переживать и размножаться внутри клеток делает их защищенными от действия антител и системы комплемента. Для элиминации таких микробов необходим специфический клеточно-опосредованный ответ.
Дата добавления: 2015-11-23; просмотров: 4167 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org — Контакты — Последнее добавление
Источник
