Роль секреторных иммуноглобулинов в местном иммунитете
Секреторные
иммуноглобулины препятствуют адгезии
микроорганизмов на эпителиальных
клетках слизистых оболочек полости
рта, кишечника, респираторных и
мочевыводящих путей. В агрегированной
форме активирует комплимент по
альтернативному пути, что приводит к
стимуляции местной фагоцитарной защиты.
Препятствуют адсорбции и репродукции
вирусов в эпителиальных клетках слизистой
оболочки, например, при кори, полиомиелите.
Иммуноглобулины
женского молока:
они представлены классами G,
M
и А, однако доминирующим является
секреторный IgА (SIgA)
SIgA
синтезируется В-лимфоцитами в лимфоидных
тканях молочной железы женщины и
поступает в молоко. Незадолго до конца
беременности в молочную железу мигрируют
иммунокомпетентные В-клетки из лимфоидных
образований кишечника, дых. Путей и др.
локализации. В лимфоидной ткани молочной
железы они размножаются и начинают
активно синтезировать SIgA антитела той
же специфичности, что и раньше – против
возбудителей острых инфекций кишечного,
респираторного тракта, мочеполовых
путей.
Защитная
роль SIgA заключается
в экранировании эпителия пищеварительного
тракта от чужеродных Аг инфекционного
и неинфекционного порядка. Эта фун-ия
реализуется путем специфического
связывания секреторными Ат бактерий,
вирусов, токсинов. В результате
предотвращается адгезия и колонизация
бактерий, проникновение в клетки и
кровоток вирусов и некоторых инвазивных
микробов.
Секреторные
Ат класса IgA – главный фактор местного
иммунитета пищеварительного тракта
против разнообразных энтеропатогенных
бактерий, вирусов и токсинов
Усилению
барьерной фун-ии слизистой кишечника
ребенка также способствует и др.
гуморальные факторы грудного молока –
лизоцим, лактоферрин, комплемент,
пропердин, лактопероксидаза. В грудном
молоке ак же содержатся сывороточные
Ig класса М, G,
A,
макрофаги, ЕК-кл-ки, В- и Т-лимфоциты,
иммуноцитокины (интерлейкины, интерферон)
Вместе
с тем замечено, что вскармливание
нативным грудным молоком существенно
активирует процесс становления иммунного
статуса ребенка, из крови быстрее
элиминируются малодифференцированные
формы клеток, созревание лимфоцитов
протекает более энергично.
19. Клеточный иммунный ответ.
Субпопуляции:
СD4+
лимфоциты: мембранные молекулы СD4 несут
различные популяции клеток, условно
разделяемые на регуляторные (хелперы)
и эффекторные (Тгтз)
Т-хелперы:
спецефически распознают Аг и взаимодействуют
с макрофагами и В-клетками в ходе индукции
гуморального иммунного ответа.
Аг-распознающие Т-лимфоциты «узнают»
чужеродный эпитоп вирусного или
опухолевого Аг в комплексе с молекулой
МНС на плазматической мембране
клетки-мишени.
Тгтз
(Т-эффекторные реакции гиперчувствительности
замедленного типа) опосредуют реакции
ГТЗ.
СD8+
лимфоциты: мембранные Аг СD8 экспрессируют
субпопуляции Т-клеток, разделяемые на
регуляторные (супрессорв) и эффекторные
(цитотоксические Т-лимфоциты)
Т-супрессоры:
регулируют интенсивность иммунного
ответа, подавляя активность СD4+ клеток.
Т-супрессоры предотвращают развитие
аутоиммунных реакций, защищают организм
от нежелательных последствий иммунных
реакций. Эти клетки обеспечиваю
толерантность матери к чужеродным Аг,
представленным на клетках вынашиваемого
плода. Это дает возможность развиваться
чужеродному в иммунном отношении плоду
в организме матери. Активация супрессоров
находится вне контроля МНС и представления
Аг макрофагом не требуется. Аутоантигены
могут стимулировать развитие
ауторегуляторных Т-супрессоров.
Чужеродные Аг в неиммунногенной форме
(гаптены) или иммуногенные Аг в очень
высокой концентрации также способны
индуцировать специфическую супрессерную
активность клеток. После распознавания
Аг зрелые лимфоциты препяттвуют развитию
иммунного ответа, действуя непосредственно
на клетки или секретируя супрессорные
факторы.
Цитотоксические
Т-лимфоциты (ЦТЛ) или Т-киллеры лизируют
клетки-мишени, несущие чужеродные или
видоизмененные аутоантигены (напр.
Клетки опухолей, трансплантатов,
инфицированные вирусами, клетками,
несущие поверхностные вирусные Аг). ЦТЛ
распознает чужеродный вирусный,
опухолевый или трансплантационный Аг
в комплексе с молекулой МНС I
на мембране клетки-мишени. Индукция
цитотоксических свойств клетки-предшественницы
Т-киллера происходит под действие двух
сигналов. Первый сигнал включает
взаимодействие между двумя комплексами:
поверхностной молекулой CD8
лимфоцита и комплексом эпитоп-молекула
МНС
I на клетке-мешени. Второй сигнал: ИЛ,
секретируемые близлежащими макрофагами
и т-клетками. Т-хелпер играет ключевую
роль в активации ЦТЛ в качестве источника
необходимых цитокинов, усиливающих их
пролиферацию и созревание до функционально
активных ЦТЛ. Цитотоксический эффект
Т-киллеров реализуется через образование
в клетках-мишенях пор под действие
особых белков-перфоринов. Нарушение
осмотического баланса с внеклеточной
средой приводит к гибели клетки.
Т-клетки
памяти: образуются при первичном иммунном
ответе. Специфически распознают Аг и
участвуют в иммунном ответе при вторичном
попадании Аг. Большинство клеток памяти
обладают функциями Т-клеток, экспрессируют
CD4 и рестригированы по молекулам МНС
II,
т.е. узнают Аг только на Аг-представляющих
клетках в связи с молекулой
МНС
II.
Возрастные
особенности клеточного иммунитета
Для
периода новорожденности характерен
слабый иммунный ответ на Аг из-за
незрелости Т-лимфоцитов, а также в связи
слабой функциональной слабостью
фагоцитоза (мала концентрация опсонинов
в крови, снижен процессинг Аг макрофагами,
что ведет к невыразительной антигенной
презентации). Еще недостаточно развиты
естественные киллеры
(ЕК-клетки).
Этим, в частности, объясняется низкий
уровень гамма-интерферона.
К
концу 1-го года концентрация лимфоцитов
в крови достигает максимума, хелперная
функция уже доминирует над супрессерной.
Так же реакция замедленной
гиперчувствительности достигает полного
развития.
В
12-13 лет уменьшается масса лимфоидных
органов, что связано с пубертатным
скачком роста и веса детей. Подавляется
функция Т-системы (клеточный иммунитет),
стимулируется функция В-системы
(гуморальный иммунитет).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
Иммуноглобулин А. Секреторный IgA в иммунитете слизистых оболочек.
Известно, что степень защиты от локальных вирусных инфекций респираторного и желудочно-кишечного трактов прежде всего зависит от содержания в организме специфического секреторного IgA, а не от наличия сывороточного IgG к энтеропатогенным или пневмотропным вирусам.
Стабильная структура, выраженный аффинитет к поверхности слизистых оболочек, преобладающее содержание в секрете молочной железы обусловливают биологическую роль секреторного IgA в защите организма от неблагоприятного воздействия различных патогенных агентов, в том числе вирусов.
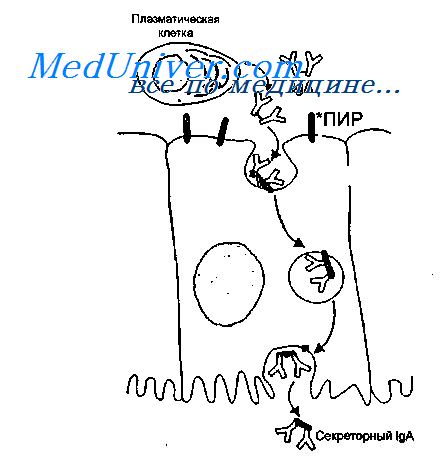
IgA синтезируется в димерной форме в клетках lamina propria и после связывания с иммуноглобулиновым рецептором, синтезированным в эпителиальных клетках, транспортируется на поверхность слизистой оболочки. В момент выхода IgA в просвет кишечника рецептор частично расщепляется, в результате чего в составе IgA остается фрагмент рецептора, который называют секреторным компонентом.
Таким образом, секреторный IgA является продуктом кооперации двух типов клеток — плазматических и эпителиальных.

Секреторный IgA образуется не только в димерной, но и в тетрамерной форме, что усиливает его вируснейтрализующую способность. Секреторный компонент предохраняет IgA от расщепления протеолитическими ферментами, что обусловливает его значительные преимущества перед антителами других классов. Секреторный IgA нейтрализует вирус не только в просвете кишечника, но и при транспортировке его внутрь клетки. Димер IgA может нейтрализовать вирус в подслизистой оболочке кишечника, а затем, связавшись с рецептором, транспортировать его в просвет кишечника.
Димерные иммуноглобулины класса A (US IgA), соединенные посредством j-цепи в единую структуру с секреторным компонентом, представляют собой уникальный пример эволюционной адаптации иммуноглобулинов на слизистых покровах для эффективного функционирования в условиях постоянного воздействия антигенов различной природы.
Исходя из способности к локальному синтезу молекул секреторного компонента, а также димерной формы IgA-местно расположенными плазматическими клетками, ткани слизистых покровов можно разделить на три основных класса.
В слизистых оболочках индуктивная и продуктивная фазы гуморального иммунного ответа разобщены пространственно в большей степени, чем в других отделах иммунной системы.
Клеточные и гуморальные превращения, связанные с появлением IgA во внешних секретах, представлены на рисунке.
В молоко и, по-видимому, в другие внешние секреты молекулы IgA поступают из двух главных источников. Большая часть IgA, выделяемого со слюной, секретами слезной и молочной желез, а также пищеварительного и респираторного трактов, образуется плазматическими клетками. Однако IgA, обнаруживаемые в различных внешних секретах, могут иметь и системное происхождение. Продуцируясь клетками слизистых оболочек одних органов, они поступают в кровь и переносятся в слизистые покровы других органов.
Антиген после проникновения внутрь пейеровой бляшки активирует Т- и В-лимфоциты, которые по лимфатическому протоку поступают в мезентериальный лимфатический узел, а затем в кровь, селезенку, снова в кровь и селективно локализуются в лимфатических образованиях всех слизистых оболочек и экзокринных секреторных железах — молочных, слюнных и слезных. При этом Т-лимфоциты локализуются преимущественно между эпителиальными клетками слизистой оболочки, обеспечивая клеточный иммунный ответ, а В-лимфоциты — в lamina propria, где они дифференцируются в плазматические клетки и синтезируют IgA.
Около 90% плазматических клеток в lamina propria продуцируют IgA, в то время как в лимфатических узлах доля таких клеток составляет всего 2—5%.
Уникальна в этом отношении роль печени. Имеются убедительные данные, свидетельствующие о том, что гепатоциты избирательно связывают и в последующем транспортируют IgA в желчь, тем самым усиливая систему секреторного IgA кишечника.
Возможной функцией печени также является удаление комплексов антиген — IgA из циркулирующей крови с желчью в кишечник. Изучение противовирусного иммунитета убедительно продемонстрировало, что степень защиты респираторного и желудочно-кишечного трактов от локальных вирусных инфекций прямо коррелирует с уровнем специфических секреторных IgA, а не с уровнем антител сыворотки крови. В основе противовирусного действия секреторного IgA лежит инактивация вируса.
— Также рекомендуем «Кишечник и иммунитет. Роль кишечника в работе иммунной системы человека.»
Оглавление темы «Патогенез и механизмы противовирусной защиты организма.»:
1. Иммунная система слизистых оболочек. Слизистая оболочка и вирусная инфекция.
2. Строение иммунной системы слизистых. Концепция общей иммунной системы слизистых оболочек.
3. Иммуноглобулин А. Секреторный IgA в иммунитете слизистых оболочек.
4. Кишечник и иммунитет. Роль кишечника в работе иммунной системы человека.
5. Респираторные органы и вирусная инфекция. Роль дыхательной системы в противовирусном иммунитете.
6. Молочная железа и вирусная инфекция. Роль молочной железы в противовирусном иммунитете.
7. Особенности иммунитета при вирусных инфекциях. Патогенез противовирусного иммунного ответа.
8. Разрушение эффекторных клеток иммунитета и макрофагов вирусами. Устранение действия цитокинов вирусами.
9. Индукция иммунологической толерантности вирусами. Иммуносупрессия при вирусной инфекции.
10. Гуморальный противовирусный иммуннитет. Клеточный противовирусный иммунный ответ.
Автор: Зеленов Петр Васильевич
Дыхательный тракт человека – это входные ворота для веществ, загрязняющих окружающую среду, и возбудителей различных болезней, поэтому состояние иммунной защиты в этом органе должно быть решающим фактором в элиминации неблагоприятного компонента при вдыхании. Состояние местного иммунитета слизистой оболочки зависит от ее целостности, содержания иммуноглобулинов А, G и М, состояния лимфоидной ткани [Иванов В.Д. с соавт., 2006].
Физиологические механизмы защиты всех отделов респираторного тракта сходны. В норме существует баланс между агрессивными факторами внешней среды и защитной системой организма. Это равновесие достаточно неустойчиво и при наличии вирусной или бактериальной инфекции, при переохлаждении, курении, значительном загрязнении воздуха, а также у людей с врожденными аномалиями органов дыхания развивается воспаление. Роль воспаления при респираторной инфекции состоит в захвате и уничтожении патогенов, однако выраженная воспалительная реакция, как правило, вызывает повреждение тканей и процесс приобретает характер замкнутого патологического круга [Зайцева О.В, 2005, Беляева Н.Н., 2001].
Защищает организм человека от проникновения инфекции слизистая оболочка верхних дыхательных путей. Она обладает весьма совершенными и сложно организованными механизмами защиты от неблагоприятного внешнего воздействия [Рязанцев С.В. с соавт., 2000]. Среди этих механизмов ведущими являются мукоцилиарный барьер и иммунная защита. Дыхательные рефлексы, такие как кашель, чиханье и бронхоконстрикция, а также мукоцилиарный клиренс препятствуют адгезии и обеспечивают удаление микроорганизмов и инородных частиц с поверхности респираторного эпителия. Важным защитным фактором является секретируемая бокаловидными клетками и эпителиоцитами слизь, в состав которой входят обладающие антибактериальной активностью лизоцим, лактоферрин, cекреторный иммуноглобулин А (sIgA) [Лучихин Л.А., 2003].
Если возбудителю удается преодолеть мукоцилиарный барьер, срабатывают неспецифические механизмы защиты – нейтрофилы и макрофаги, мигрирующие из кровеносного русла и способные уничтожать микроорганизмы путем фагоцитоза, за счет секреторной дегрануляции, продукции активных форм кислорода и оксида азота. В противовирусных реакциях принимают участие также естественные клетки-киллеры, располагающиеся в подслизистом слое и тесно связанные с внутриэпителиальными лимфоидными фолликулами. Наконец, иммунная защита слизистой оболочки обеспечивается многими гуморальными и клеточными факторами, среди которых наиболее важную роль играет синтезируемый в ответ на воздействие специфических антигенов sIgA [Лучихин Л.А., 2003].
Действия факторов окружающей среды на иммунную систему реализуется через ряд стадий: на ранней стадии контакта с ними наблюдается повышение показателей в том или ином звене иммунитета, что рассматривается как адаптационная реакция организма на новые условия существования. Для ранней стадии, при отсутствии клинических проявлений, в первой фазе характерно только повышение концентрации sIgA, во второй фазе – всех классов иммуноглобулинов [Иванов В.Д. с соавт., 2006].
В дальнейшем, при продолжении контакта с неблагоприятными факторами, развивается состояние нарушения процесса адаптации (донозологическое), которое характеризуется преобладанием неспецифических изменений над специфическими. В случае дальнейшего развития патологических процессов наступает состояние срыва адаптации и развитие клинических симптомов болезни. При этом наступает повреждение внутриклеточных структур, нарушаются межклеточные кооперативные связи, развиваются аутоиммунные реакции, иммунодепрессия, формируется сенсибилизация организма, накапливаются токсичные метаболиты [Иванов В.Д. с соавт., 2006, Хаитов Р.М. с соавт., 1995].
Одним из иммуноглобулинов играющим не мало важную роль в здоровом респираторном тракте и в защите легких от болезней является секреторный иммуноглобулин А (sIgA). Он представляет собой димер, состоящий из двух мономеров, ковалентно связанных с секреторным компонентом, что предохраняет его от деструкции. Живет данный иммуноглобулин всего 5 дней. Поэтому для его постоянного пополнения в организме ежедневно происходит дифференцировка В-лимфоцитов в плазматические клетки, так как именно они синтезируют sIgA. В связи с этим окружающие клетки продуцируют цитокины, которые способствуют переходу В-лимфоцитов в плазматические клетки и началу синтеза sIgA. К тому же эпителиальные клетки продуцируют гликопротеин, называемый секреторным компонентом, являющимся основным звеном в местной иммунной системе, который дает стабильность sIgA и обеспечивает транспортировку IgA и IgM. Последние исследования предположили возможную роль эпителиальных клеток в антигенной презентации. Дендритные клетки, находящиеся в эпителии воздушных путей могут непосредственно предоставлять антигены В-лимфоцитам и, таким образом, стимулировать их к дифференцировке при помощи цитокинов, синтезируемых эпителиальными клетками, в плазматические и к синтезу sIgA [Salvis S. et al., 1999, V.H.J. van der Velden et al., 1998, Рабсон Л. с соавт., 2006].
Таким образом, sIgA отвечает за местную защиту, а его регуляторная роль в сочетании с местным синтезом, транспортом и секрецией отличают иммунитет слизистых оболочек от системного иммунитета [Иванов В.Д. с соавтр., 2006,]. Этот иммуноглобулин не способен связывать комплемент или вызывать его активацию. Однако он осуществляет различные защитные функции посредством взаимодействия с различными рецепторами иммунной системы, что предохраняет слизистые поверхности тела от проникновения микроорганизмов в ткани. sIgA может связывать токсины и вместе с лизоцимом проявляет бактерицидную и антивирусную активность. Он действует как агглютинатор микроорганизмов и нейтрализатор токсинов, ингибируя связывание вирусов и бактерий с поверхностью слизистых оболочек, и таким образом ингибируя репликацию [Леонова М.В., 2002; Wines B.D. et al, 2006; Woof J.M.et al, 2006].
Уровень sIgA у человека меняется в зависимости от его возраста, факторов внешней среды и болезней. С возрастом этот показатель уменьшается. Так у детей в возрасте от 0-до 3 лет уровень sIgA в слюне равен 370-670 мг/л [МР., 1999], а с восьми лет и у взрослых нормой считается 115,3 — 299,7 мг/л [Петрова И.В. с соавт., 2001].
Последние исследования показали, что уровень sIgA может иметь и прогностическую значимость в оценке состояния здоровья населения при массовых обследованиях [Иванов В.Д. с соавт., 2006]. Так установлено, что снижение sIgА может указывать на недостаточность функции местного иммунитета, а его повышенное количество – на дисбаланс в иммунной системе [Маковецкая А.К. с соавт., 2005].
В ряде исследований показано, что при снижение местного иммунитета, и в частности sIgA, возможно приводит к хронической патологии. Например, в исследовании Calvo M. с соавт. (1990) показано, что у здоровых детей, имеющих нормальный уровень sIgA, риск развития хронической легочной патологии, в том числе и бронхиальной астмы, составляет 46%, а при низком уровне sIgA повышается до 86%. В исследовании Бяховой М.М. (2008) показано, что у здоровых детей с низким sIgA повышается уровень цитогенетических показателей буккального эпителия на фоне снижения апоптического индекса, т.е. нарушается процесс удаления генетически не полноценных эпителиальных клеток.
Изменения уровня sIgA в условиях загрязнения атмосферного воздуха так же показано в ряде исследований. Например, в работе Richter J. c соавторами (1996) показано, что у детей, изначально проживающих в условиях загрязнения атмосферного воздуха, повышен уровень sIgA и лизоцима в слюне. Однако через две недели после переезда в более чистый район наблюдается нормализация повышенных иммунологических показателей. В то же время в работе Мизерницкого Ю.Л. (2002) выявлено снижение sIgA у детей дошкольного возраста, проживающих в условиях интенсивного загрязнения окружающей среды древесной пылью и формальдегидом. Таким образом, загрязнение окружающей среды может вызывать как повышение sIgA, что скорей всего является компенсаторной реакцией, так и его снижение в слюне в результате повреждающего действия поллютантов атмосферного воздуха, приводящего к нарушению местной защиты слизистых [Handzel Z.T., 2000].
sIgA может изменяться и при различных патологических состояниях бронхолегочной системы, и в частности при бронхиальной астме. Так известно, что у детей с этим заболеванием отмечаются различные изменения иммунной системы, сопровождающимися склонностью к частым вирусным и бактериальным инфекциям. Развитию бронхиальной астмы у детей способствуют перенесенные ранее ребенком острые респираторные инфекции, бронхиты, пневмонии. У половины детей с бронхиальной астмой первый приступ затрудненного дыхания часто возникает на фоне ОРЗ или в период реконвалесценции после него. У часто болеющих детей с этим заболеванием отмечается снижение sIgA в секрете ротоглотки [Рылеева И.В., 2003]. Так же в работе Кузьменко Л.Г. и соавторов (1999) показано, что у детей, больных бронхиальной астмой с частыми обострениями, вызываемыми вирусной инфекцией, sIgA в слюне ниже, чем у здоровых. Скорей всего, низкий уровень этого иммуноглобулина может быть связан с угнетающим действием вирусов на его синтез или истощением его продукции при чрезвычайно высокой потребности в условиях частого возникновения вирусных инфекций.
Так же, в исследованиях Balzar S. с соавторами (2006) и Peebles R.S.Jr. с соавторами (1995) также показаны изменения sIgA у больных бронхиальной астмы. Было исследовано 15 здоровых, 9 со средней тяжестью и 22 с тяжелой степенью астмы людей. Иммуноглобулины во всех группах в основном были в пределах нормы. Однако IgA и IgG были ниже у тяжелых астматиков, по сравнению со здоровыми людьми. Кроме того, в этих группах была найдена корреляция между sIgA и симптомами астмы. Чем тяжелее текло заболевание, тем ниже был уровень этого иммуноглобулина. Похожие изменения прослеживаются в работе Бяховой М.М. (2008), где у детей больных бронхиальной астмой уровень sIgA в два раз ниже, чем в группе здоровых детей. Предполагается, что при бронхиальной астме воспаление слизистой бронхов обуславливает дефект местной защиты и нарушение местного синтеза sIgА [Саликаева Ю.О. с соавт., 2000, Fukushima C. et al.,2005].
Подводя итог, можно сказать, что sIgA играет не мало важную роль в защите организма от различных факторов окружающей среды, а кроме того он имеет прогностическое значение в массовых исследованиях.
Список литературы.
1. Беляева Н.Н., Шамарин А.А., Петрова И.В., Малышева А.Г. Связь изменений слизистых оболочек носа и рта с иммунным статусом при воздействии факторов окружающей среды // Гигиена и санитария. — 2001. — № 5. — С. 62-64.
2. Бяхова М.М Цитогенетический статус, показатели пролиферации и апоптоза у детей с бронхиальной астмой, проживающих в условиях загрязнения атмосферного воздуха. Автореферат на соискание ученой степени кандидата медицинских наук. – Москва. – 2008. – 22 с.
3. Зайцева О.В. Противовоспалительная терапия в лечении заболеваний органов дыхания. // Consilium provisorum. – Том 5, №6. – 2005.
4. Иванов В.Д., Маковецкая А.К. Возможности использования неинвазивных иммунологических методов в оценке здоровья населения. // Неинвазивные методы в оценке здоровья населения. Под ред. Академика РАМН Ю.А. Рахманина. – М. – 2006. – С. 112-125.
5. Кузьменко Л.Г., Баталова Т.Н., Сойджодах Р. И др. Содержание иммуноглобулинов в слюне детей с хроническим тонзиллитом и бронхиальной астмой. // Вестник РУДН Серия «Медицина». – 1999. – №2. – С. 73-79.
6. Леонова М.В., Ефременкова О.В. Местная иммуномодуляция при заболеваниях верхних дыхательных путей. // Качественная практическая практика. – 2002. — №1. – С.14-22.
7. Лучихин Л.А. Рациональные подходы к лечению и профилактики респираторных инфекций // Consilium Medicum. – 2003. – Том. 5, № 2.
8. Маковецкая А.К., Высоцкая О.В., Иванов В.Д. Изучение состояния местного иммунитета слизистых оболочек дыхательного тракта у лиц с аллергической патологией.//Материалы пленума «Экологически обусловленные ущербы здоровью: методология, значение и перспективы оценки. – Москва. – 22-23 декабря 2005г. – С.436-438.
9. Методические рекомендации. – Оценка состояния здоровья и выявления предпатологических состояний у детей. – М. – 1999. – 36 с.
10. Мизерницкий Ю.Л. Значение экологических факторов при бронхиальной астме у детей. // Пульмонология. – 2002.-Vol.12, №1- С. 56-62.
11. Петрова И. В., Мольков Ю.Н, Лещенко Г.М. и др. Оценка состояния и системы у детей неинвазивными методами. // В кн. Гигиеническая наука и практика на рубеже XXI века. Материалы IX Всероссийского съезда гигиенистов и санитарных врачей. Москва. — 2001. — т. 2 — С. 433 — 436.
12. Рабсон Л., Ройт А., Делвиз П. Основы медицинской иммунологии: пер. с англ. // М.: Мир.- 2006. -320с.
13. Рязанцев С.В., Хмельницкая Н.М., Тырнова Е.В. Роль слизистой оболочки в защите ЛОР-органов от потенциально патогенных для организма антигенных факторов. // Вестник оториноларингологии. – 2000. — №3. – стр. 60-64.
14. Рылеева И.В., Балаболкин И.И. Бактериальные иммуномодуляторы ИРС19 и Имудон в педиатрической практике. // Вопросы современной педиатрии. – 2003. – Т. 2, №2. – С 78-81.
15. Саликаева Ю.А., Волкова Л.И., Геренг Е.А. и др. Эффективность фликсотида у больных атопической бронхиальной астмой. // Пульмонология. – 2000. — №3. – С. 73-77.
16. Хаитов Р.М., Пинегин Б.В., Истамов Х.И. Экологическая иммунология. – М.: Издательство ВНИРО. – 1995.
17. Balzar S., Strand M., Nakano T. et al. Subtle immunodeficiency in severe asthma: IgA and IgG2 correlate with lung function and symptoms. // Int. Arch. Allergy Immunol. – 2006. – Vol. 104,№2. – P. 96-102.
18. Calvo M., Grob K., Bertoglio J et al. Secretory IgA deficiency in pediatric patients: clinical and laboratory follow-up. // Allergol Immunopathol (Madr.) – 1990. – Vol. 18,№3. – P. 149-153.
19. Fukushima C., Matsuse H., Saeki S. et al. Salivry IgA and oral candidiasis in asthmatic pationts treated with inhaled corticosteroid. // J Asthma. -2005. – Vol. 42, №7. – P. 601-604.
20. Eccles R Rhinitis as a mechanism of respiratory defence. Eur Arch Otorhinolaryng 1995; 252: Suppl 1: 2-7.
21. Handzel Z.T. effects of environmental pollutants on airways, allergic inflammation, and the immune response. // Rev Environ Health. – 2000. – Vol. 15, №3. – P. 325-336.
22. Peebles RS Jr., Liu MC, Lichtenstein L.M. et al. IgA, IgG and IgM quantification in bronchoalveolar lavage fluids from allergic rhinitics, allergic asthmatics, and normal subjects by monoclonal antibody-based immunoenzymetric assays. // J Immunol Methods. – 1995. – Vol 179, № 1. – P. 77-86.
23. Richter J., Pelech L. Immunological findings in groups of children after compensatory measures. // Toxicol Lett. – 1996. – Vol. 88, № 1-3. – P. 165-168.
24. Salvi S., Holgate S.T. Could the airway epithelium play an important role in mucosal immunoglobulin A production? // Clin. Exp. Allergy. – 1999. – Vol. 29, №12. P. 1597-1605.
25. V.H.J. van der Velden, Savelkoul H.F.J., Versnel M.A. Bronchial epithelium: morphology, function, and pathophysiology in asthma. // Eur. Cytokine Netw. – Vol. 9,№4. – P. 585-597.
26. Wines B.D., Hogarth P.M. IgA receptors in health and disease. // Tissue Antigens. – 2006. – Vol. 68,№2. – P. 103-114.
27. Wilson R, Dowling RB, Jackson AD. The biology of bacterial colonization and invasion of the respiratory mucosa. Eur Respir J 1996; 30: 289-9.
28. Woof J.M., Kerr M.A. The function of immunoglobulin A in immunity. // J. Pathol. – 2006. – Vol. 208,№2. – P. 270-282.
