Toll like рецепторы роль в формировании адаптивного иммунитета

ТОЛЛ-ПОДОБНЫЕ РЕЦЕПТОРЫ (TLR) И ИММУННЫЙ ОТВЕТ
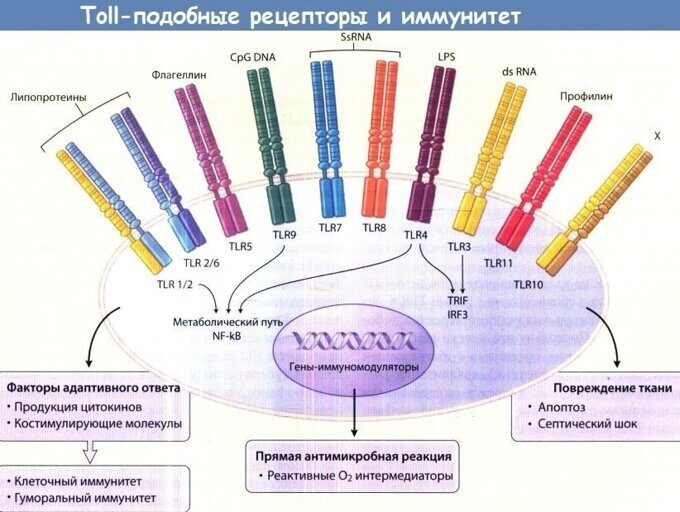
TOLL-ПОДОБНЫЕ РЕЦЕПТОРЫ ВО ВРОЖДЕННОМ И АДАПТИВНОМ ИММУНИТЕТЕ
Толл-подобные рецепторы — класс клеточных рецепторов с одним трансмембранным фрагментом, которые распознают консервативные структуры микроорганизмов и активируют клеточный иммунный ответ. Играют ключевую роль во врождённом иммунитете. Например, толл-подобный рецептор 4 (TLR-4) узнаёт и связывается с консервативной структурой клеточной стенки грамотрицательных бактерий — липополисахаридом (LPS).
Toll-подобные рецепторы (TLR), относятся к семейству паттерн-распознающих рецепторов PRRs и осуществляют распознавание молекулярных структур патогенов PAMPs (экзогенных лигандов) и ряда эндогенных лигандов DAMPs (молекул, которые высвобождаются в ответ на повреждение клеток), обеспечивая быструю реакцию клетки. У млекопитающих и человека охарактеризованы 15 TLR (на 2016 г.), которые распложены на мембране, в эндосомах или в цитоплазме клеток, осуществляющих первую линию защиты (нейтрофилы, макрофаги, дендритные клетки и пр.). После связывания лиганда TLR запускают сигнальный каскад с вовлечением ряда адаптерных белков, что ведет к активации ядерных факторов и последующей продукции цитокинов и прочих молекул, ассоциированных с воспалением. TLR-сигнальный путь контролируется с помощью различных механизмов обратной связи. В целом, биологическая роль и механизмы функционирования TLR до конца не изучены.
Toll-подобные рецепторы (TLR), опосредующие распознавание молекулярных структур патогенов, экспрессируются на клетках разных типов, инициируя развитие иммунных реакций при связывании с различными лигандами. Несмотря на то, что у ряда организмов идентифицированы функциональные TLR, их биологическая роль и механизмы функционирования до конца не изучены.
Распознавание патогенов микробного происхождения является основополагающим компонентом иммунного ответа, включающим воспаление (Janeway, 1998). Этот ответ опосредуется рецепторами особого семейства, узнающими наиболее общие молекулярные компоненты (паттерны, PAMP – Pathogen Associated Molecular Patterns) микробов (вирусов, бактерий, паразитов и т.д.) и получившими название PRR (Pattern Recognition Receptors) (Medzhitov, 2000). После узнавания соответствующего специфического паттерна PRR запускают серию сигнальных каскадов, которые представляют собой первую линию защиты от микробов. Кроме того, инициируемый PRR сигнал запускает созревание дендритных клеток, которые подготавливают вторую линию иммунного ответа на инфекцию, известную как приобретенный иммунитет.
Toll-подобные рецепторы (TLR) были первыми идентифицированными PRRs — рецепторами распознавания образов – англ. Pattern recognition receptors) (См. рисунок 1) (Lemaitre, 1996; Medzhitov, 1997).
Активация провоспалительных цитокинов и интерферонов через Toll-like рецепторы

Рисунок 1. Механизмы действия толл-подобных рецепторов.
Комментарий к рисунку: Активация воспалительных цитокинов и интерферона через TLRs начинается с распознавания TLR соответствующих агонистов (красный цвет). Взаимодействие адаптеров ТLRs и киназ из семейства IRAKs (IRAK 1 — 4) приводит к активации NF-kB (ядерного фактора «каппа-би») и MAP-киназ, основных регуляторов транскрипции цитокинов и интерферона (Lemaitre, 1996; Medzhitov, 1997).
В состоянии покоя неактивированные TLRs находятся на мембране клеток в мономерной форме. После активации Toll-подобных рецепторов происходит их олигомеризация. Олигомерный рецептор способен связывать несколько внутриклеточных адаптерных белков, которые обеспечивают последующую передачу сигнала. Эти белки имеют участок специфического связывания с активированными Toll-подобными рецепторами, TIR (от англ. Toll-interleukin-1 receptor) домен, который состоит из 3 консервативных участков, участвующих в белок-белковом взаимодействии. Всего существует 5 адаптерных белков с TIR-доменом: MyD88, TIRAP, TRIF, TRAM и SARM. Различные рецепторы имеют свой набор этих адаптерных белков, необходимых для передачи сигнала. Только рецептор TLR4 способен связывать все 5 белков.
Строение Toll-like рецепторов
 Все TLRs имеют сходное строение и представляют собой интегральные трансмембранные белки, т.е. белки, которые насквозь пронизывают липидный бислой, в котором они постоянно находятся (интегральные, т.к. прочно связаны с цитоплазматической мембраной (интегрированы). Поверхностная зона молекулы, ответственная за связывание лиганда, представлена N-концевой областью аминокислотной последовательности из 19-25 повторяющихся участков, обогащенных лейцином. Далее следует переходный участок, отвечающий за прикрепление рецептора к клеточной мембране, обогащенный цистеином. Внутренняя дистальная часть рецептора представлена TIR (Toll/IL-receptor) доменом, получившим свое название из-за одинакового строения этого участка у TLRs и у рецепторов цитокинов семейства IL-1.
Все TLRs имеют сходное строение и представляют собой интегральные трансмембранные белки, т.е. белки, которые насквозь пронизывают липидный бислой, в котором они постоянно находятся (интегральные, т.к. прочно связаны с цитоплазматической мембраной (интегрированы). Поверхностная зона молекулы, ответственная за связывание лиганда, представлена N-концевой областью аминокислотной последовательности из 19-25 повторяющихся участков, обогащенных лейцином. Далее следует переходный участок, отвечающий за прикрепление рецептора к клеточной мембране, обогащенный цистеином. Внутренняя дистальная часть рецептора представлена TIR (Toll/IL-receptor) доменом, получившим свое название из-за одинакового строения этого участка у TLRs и у рецепторов цитокинов семейства IL-1.
Значимость Toll-like рецепторов

Важное значение участия TLRs в деятельности иммунной системы было показано в экспериментальных работах на нокаут-мышах, имеющих искусственно вызванные мутации генов различных TLRs. Так, мыши, имеющие мутацию гена, кодирующего TLR4, погибали при инфицировании 1-2 колониеобразующими единицами (КОЕ) Salmonela typhimurium, в то время как у нормальных животных гибель происходила при введении более 2000 КОЕ этих бактерий. В других экспериментах была показана высокая восприимчивость TLR4-дефицитных мышей к Escherichia coli, Neisseria meningitides и Candida albicans. Подобные результаты были получены и при изучении роли TLRs в защите от вирусных инфекций. Опубликованы результаты исследований, в которых показано участие TLRs при развитии опухолей.
Участие Толл-подобных рецепторов во врожденном иммунитете
Участие Toll-like рецепторов во врожденном иммунитете обеспечивается:
1. Инициацией выделения провоспалительных цитокинов, необходимых для физиологического иммунологического ответа при различных воздействиях, среди которых одно из центральных мест занимают различные инфекции;
2. регуляцией активности нейтрофилов; особую роль при этом играют TLR-2 и TLR-4, первый из которых защищает клетки от апоптоза, а второй проявляет себя как важный регулятор выживаемости нейтрофилов (см. рис. 3);
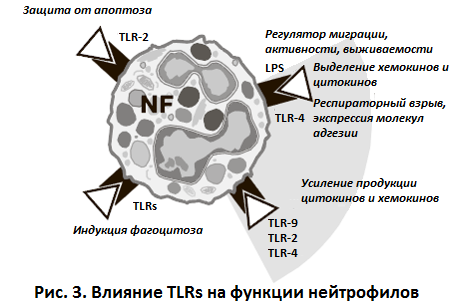
3. контролем активации, дифференциации и выживаемости В-лимфоцитов, в котором активное участие принимают TLR-2, TLR-4 и TLR-9 (этот путь активации В-лимфоцитов сопровождается усилением выброса кальция, фосфорилированием некоторых киназ, усилением эндоцитоза, синтеза иммуноглобулинов и рассматривается как альтернативный путь активации В-лимфоцитов);
4. обеспечением поддержания врожденного иммунитета кишечника, что связано с экспрессией TLRs эпителиальными клеками его слизистой;
5. участием в функционировании клеток центральной нервной ситемы, большинство которых экспрессируют TLRs (микроглия, нейроны, астроциты, эндотелиальные клетки сосудов мозга), имеются данные о дифференцированном влиянии TLRs на функции микроглии.
Участие Толл-подобных рецепторов в приобретенном иммунитете
Участие Toll-like рецепторов в приобретенном иммунитете обусловлено:
1. Активацией CD4+ и CD8+ T-лимфоцитов;
2. стимуляцией функций различных антиген-распознающих клеток: дендритных, которые экспрессируют TLR-2, TLR-3, TLR-4, TLR-7, TLR-9;

3. активацией макрофагов, тучных клеток, в частности, с участием TLR-9, что особенно выражено при действии генетического материала ДНК-вирусов бактерий, грибов;
4. активным включением в экспансию и функционирование регуляторных клеток — T-reg, которые экспрессируют высокий уровень TLR-4, TLR-5, TLR-7 и TLR-8 (см. рис. 3);

5. регуляцией гомеостаза фибробластов, миофибробластов, фибробластоподобных синовиоцитов, эндотелиальных и эпителиальных клеток, в частности, с участием TLR-2, TLR-4, TLR-6;
6. регуляцией клеток нормального эпителия (TLR-2, TLR-3, TLR-4, TLR-5), а также клеток эндотелия;
7. потенцированием приобретенного иммунитета с включением различных механизмов
Лиганды Толл-подобных рецепторов
Для TLRs также наиболее подробно изучен и идентифицирован спектр PAMPs. TLRs – это трансмембранные белки первого типа, содержащие лейцин-богатые повторы в эктодомене, трансмембранный и цитозольные домены. Эктодомен узнает микробные паттерны, в то время как цитозольный домен активирует сигнальные пути в цитоплазме клетки. В зависимости от локализации TLRs в клетке выделяют рецепторы, расположенные в цитоплазматической мембране (TLR1, TLR2, TLR4, TLR5, TLR6, TLR10 и TLR11) или в мембранах внутриклеточных органелл (TLR3, TLR7, TLR8 и TLR9) — лизосом, эндосом, аппарата Гольджи. Лигандами рецепторов, локализованных на цитоплазматической мембране, являются поверхностные структуры микроорганизмов — липопротеин, липополисахариды, флагеллин, зимозан.
Таблица 1. Toll-подобные рецепторы и их лиганды
PRRs | Локализация | Лиганд и его происхождение |
TLR | мембрана клетки | триациллипопротеин (бактерии) |
TLR2 | мембрана клетки | липопротеины, липопептиды (бактерии), гликолипиды (простейшие), зимозан (грибы) |
TLR3 | внутриклеточная | dsРНК (вирусы); мРНК (хозяин) |
TLR4 | мембрана клетки | липополисахариды (бактерии), маннаны (грибы), белковая оболочка вирусов; белки теплового шока Hsp60 и Hsp70, фибриноген, фибронектин, гиалуроновая кислота (хозяин) |
TLR5 | мембрана клетки | флагеллин (бактерии) |
TLR6 | мембрана клетки | диациллипопротеин (бактерии) |
TLR7 | внутриклеточная | ssРНК (вирусы) ssРНК (хозяин) |
TLR8 | внутриклеточная | ssРНК (бактерии, вирусы); ssРНК (хозяин) |
TLR9 | внутриклеточная | неметилированные CpG в молекулах ДНК (бактерии, простейшие, вирусы); комплекс хроматина и IgG (хозяин) |
TLR10 | мембрана клетки | нет данных |
TLR11 | мембрана клетки | профилин (простейшие) |
Итак, рецепторы, локализованные в мембранах внутриклеточных органелл, распознают молекулы ядерных структур микроорганизмов, но могут быть активированы и DAMPs, т.е. поврежденными молекулярными структурами собственного организма (выделено красным — ред.). Каждый TLR обнаруживает различные PAMPs вирусного, бактериального и другого происхождения. Так, например, липопротеины узнаются различными гетеродимерами из TLR1, TLR2 и TLR6 (Takeuchi, 1999), двуцепочечная РНК (ds) — TLR3 (Alexopoulou, 2001), одноцепочечная РНК (ss) — TLR7 и TLR8 (Hemmi, 2002; Heil, 2003), флагеллин — TLR5 (Smith, 2003), ДНК — TLR9 (Kumagai, 2008) (Таблица 1). TLR4 был первым рецептором с идентифицированным лигандом — бактериальным липополисахаридом (ЛПС или англ. LPS) (Poltorak, 1998). В настоящее время у человека и мыши идентифицированы 10 и 12 функциональных TLR, соответственно.
Механизмы Толл-подобных рецепторов
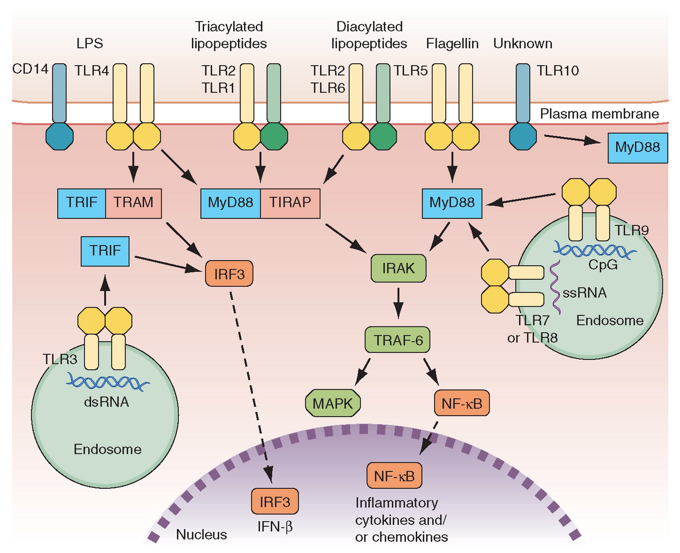
Рисунок 6. Механизмы активации провоспалительных цитокинов и / или хемокинов и интерферонов (вариант рис. 1.)
В состоянии покоя неактивированные TLRs находятся на мембране клеток в мономерном состоянии. После распознавания молекулярных «образов» патогенов TLRs активируют каскад реакций передачи сигнала в ядро клетки: при связывании с лигандом рецептор подвергается димеризации, сопровождающейся изменением конформации TIR-домена, который связывается с адапторной молекулой MyD88 (myeloid differentiation protein 88), необходимой для привлечения киназ семейства IRAK (IL-1 receptor associated kinase). После активации IRAK взаимодействует с внутриклеточным фактором TRAF6 (TNF receptor associated factor 6), в результате чего происходит высвобождение ядерного фактора каппа-В (NF-κB) и транслокация его в ядро клетки. Связываясь с промоторными участками генов, ядерный фактор активирует синтез провоспалительных цитокинов, молекул адгезии, костимулирующих молекул с последующей активацией структур адаптивного иммунитета.
Известен также механизм MyD88-независимой передачи активационных сигналов от TLRs (см. рис. 1 и 3). Его принципиальным отличием является то, что TIR-домен взаимодействует с адапторной молекулой TRIF (TIRdomain containing adaptor inducing IFNβ) с последующей активацией внутриклеточного фактора IRF3 (interferon regulatory factor 3), индуцирующего экспрессию генов интерферонов α и β (IFNα и IFNβ), являющихся важнейшими молекулами для дифференцировки Т-лимфоцитов.
Заключение
Инициированная TLRs схема передачи сигнала внутрь клетки оставляет открытыми много вопросов. В частности, каким образом активация одного и того же Тoll-рецептора в разных клетках приводит к продукции совершенно разного спектра цитокинов и других воспалительных белков. Например, известно, что TLR9 в макрофагах приводит к продукции классических цитокинов, таких как TNF и IL6, в то время как тот же TLR9 в плазмацитоидных дендритных клетках приводит к продукции IFN-I (Uematsu, 2005). Аналогично, будучи локализованным на клеточной мембране, TLR4 активирует классические цитокины, а транслокация в эндосому переключает TLR4 на продукцию типа 1 интерферона (Kagan, 2008). Только одним клеточным окружением трудно объяснить данную разницу.
Невозможно также объяснить с помощью такой простой схемы сложную и совершенную регуляцию многих сотен генов. Очевидно, что существуют дополнительные, неизвестные компоненты сигнальной активации с участием Тoll-подобных рецепторов. Вероятно также, что все эти вопросы требуют дальнейшего изучения.
Анимационное видео:
Толл-подобные рецепторы (TLRs) и иммунный ответ →
Вывод: Таким образом, Толл-подобные рецепторы являются первыми сигнальными молекулами, распознающими лиганды микроорганизмов и координирующими иммунный ответ. TLRs являются активными регуляторами не только врожденного и приобретенного иммунитета, но и гомеостаза различных клеток.
К разделу:
- Микробиом, иммунитет и пробиотики
Дополнительно см.:
- Механизм иммунного ответа
- Цитокины в системе иммунитета
- Иммунитет, лимфоциты и дендритные клетки
- T-лимфоциты и их циркуляция
- Регуляторные Т-клетки — миротворцы иммунной системы
- Развитие и поддержание регуляторных Т-клеток кишечника
- Арильный углеводородный рецептор и иммунитет
- Роль микробиоты в иммунитете и воспалении (+ видео)
- Кишечный дисбиоз и иммунометаболические нарушения
- ВЗК, микробиота и иммунитет слизистой оболочки
- Роль кишечной микробиоты и метаболитов в гомеостазе кишечника и заболеваниях человека
Библиография
- Alexopoulou L, Holt AC, Medzhitov R, Flavell RA. Recognition of double-stranded RNA and activation of NF-kappaB by Toll- like receptor 3. Nature 2001, 413:732-738.
- Benfey PN, Mitchell-Olds T. From genotype to phenotype: systems biology meets natural variation. Science 2008, 320:495-497.
- Brint EK, Xu D, Liu H, Dunne A, McKenzie AN, O’Neill LA, Liew FY. ST2 is an inhibitor of interleukin 1 receptor and Toll-like receptor 4 signaling and maintains endotoxin tolerance. Nat Immunol 2004, 5(4):373-379.
- Conner JR, Smirnova I, Poltorak A. Forward genetic analysis of Toll-like receptor responses in wild-derived mice reveals a novel antiinflammatory role for IRAK1BP1. J Exp Med 2008, 205:305-314.
- Conner JR, Smirnova I, Poltorak A. A mutation in Irak2c identifies IRAK-2 as a central component of the TLR regulatory network of wild-derived mice. J Exp Med 2009, 206 (7):1615-1631.
- Guenet JL, Bonhomme F. Wild mice: an ever-increasing contribution to a popular mammalian model. Trends Genet 2003, 19:24-31.
- Heil F, Ahmad-Nejad P, Hemmi H, Hochrein H, Ampenberger F, Gellert T, Dietrich H, Lipford G, Takeda K, Akira S, Wagner H, Bauer S. The Toll-like receptor 7 (TLR7)-specific stimulus loxoribine uncovers a strong relationship within the TLR7, 8 and 9 subfamily. Eur J Immunol 2003, 33:2987-2997.
- Hemmi H, Kaisho T, Takeuchi O, Sato S, Sanjo H, Hoshino K, Horiuchi T, Tomizawa H, Takeda K, Akira S. Small anti-viral compounds activate immune cells via the TLR7 MyD88- dependent signaling pathway. Nat Immunol 2002, 3(2):196-200.
- Janeway CA, Medzhitov R. Introduction: the role of innate immunity in the adaptive immune response. Semin Immunol 1998, 10(5):349-350.
- Kagan JC, Su T, Horng T, Chow A, Akira S, Medzhitov R. TRAM couples endocytosis of Toll-like receptor 4 to the induction of interferon-beta. Nat Immunol 2008, 9:361-368.
- Kumagai Y, Takeuchi O, Akira S. TLR9 as a key receptor for the recognition of DNA. Adv Drug Deliv Rev 2008, 60:795-804.
- Lemaitre B, Nicolas E, Michaut L, Reichhart JM, Hoffmann JA. The dorsoventral regulatory gene cassette spatzle/Toll/cactus controls the potent antifungal response in Drosophila adults. Cell 1996, 86(6):973-983.
- Losick VP, Stephan K, Smirnova I, Isberg RR, Poltorak A. A hemidominant Naip5 allele in mouse strain MOLF/Ei-derived macrophages restricts Legionella pneumophila intracellular growth. Infect Immun 2009, 77:196-204.
- Medzhitov R, Janeway CA. How does the immune system distinguish self from nonself? Innate immunity 2000, 343:338-344.
- Medzhitov R, Preston-Hurlburt P, Janeway CA. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity [see comments]. Nature 1997, 388(6640):394-397.
- Poltorak A, He X, Smirnova I, Liu MY, Huffel CV, Du X, Birdwell D, Alejos E, Silva M, Galanos C, Freudenberg M, Ricciardi-Castagnoli P, Layton B, Beutler B. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene. Science 1998, 282:2085-2088.
- Smith KD, Andersen-Nissen E, Hayashi F, Strobe K, Bergman MA, Barrett SL, Cookson BT, Aderem A. Toll-like receptor 5 recognizes a conserved site on flagellin required for protofilament formation and bacterial motility. Nat Immunol 2003, 4:1247-1253.
- Stephan K, Smirnova I, Jacque B, Poltorak A. Genetic analysis of the innate immune responses in wild-derived inbred strains of mice. Eur J Immunol 2007, 37:212-223.
- Suzuki Y, Roth FP. Systematic genetics swims forward elegantly. Mol Syst Biol 2006, 2:48.
- Takeuchi O, Hoshino K, Kawai T, Sanjo H, Takada H, Ogawa T, Takeda K, Akira S. Differential roles of TLR2 and TLR4 in recognition of gram-negative and gram-positive bacterial cell wall components. Immunity 1999, 11:443-451.
- Uematsu S, Sato S, Yamamoto M, Hirotani T, Kato H, Takeshita F, Matsuda M, Coban C, Ishii KJ, Kawai T, Takeuchi O, Akira S. Interleukin-1 receptor-associated kinase-1 plays an essential role for Toll-like receptor (TLR)7- and TLR9-mediated interferon-{alpha} induction. J Exp Med 2005, 201:915-923.
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
- ПРОБИОТИКИ
- ДОМАШНИЕ ЗАКВАСКИ
- БИФИКАРДИО
- КОНЦЕНТРАТ БИФИДОБАКТЕРИЙ ЖИДКИЙ
- ПРОПИОНИКС
- ЙОДПРОПИОНИКС
- СЕЛЕНПРОПИОНИКС
- БИФИДОБАКТЕРИИ
- ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
- ПРОБИОТИКИ И ПРЕБИОТИКИ
- СИНБИОТИКИ
- АНТИОКСИДАНТНЫЕ СВОЙСТВА
- АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
- АНТИМУТАГЕННАЯ АКТИВНОСТЬ
- МИКРОФЛОРА КИШЕЧНОГО ТРАКТА
- МИКРОФЛОРА И ФУНКЦИИ МОЗГА
- ПРОБИОТИКИ И ХОЛЕСТЕРИН
- ПРОБИОТИКИ ПРОТИВ ОЖИРЕНИЯ
- МИКРОФЛОРА И САХАРНЫЙ ДИАБЕТ
- ПРОБИОТИКИ и ИММУНИТЕТ
- ПРОБИОТИКИ и ГРУДНЫЕ ДЕТИ
- ДИСБАКТЕРИОЗ
- МИКРОЭЛЕМЕНТНЫЙ СОСТАВ
- ПРОБИОТИКИ С ПНЖК
- ВИТАМИННЫЙ СИНТЕЗ
- АМИНОКИСЛОТНЫЙ СИНТЕЗ
- АНТИМИКРОБНЫЕ СВОЙСТВА
- СИНТЕЗ ЛЕТУЧИХ ЖИРНЫХ КИСЛОТ
- СИНТЕЗ БАКТЕРИОЦИНОВ
- ФУНКЦИОНАЛЬНОЕ ПИТАНИЕ
- АЛИМЕНТАРНЫЕ ЗАБОЛЕВАНИЯ
- ПРОБИОТИКИ ДЛЯ СПОРТСМЕНОВ
- ПРОИЗВОДСТВО ПРОБИОТИКОВ
- ЗАКВАСКИ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- НОВОСТИ
Наши партнеры:
Осенью прошлого года я была ошеломлена, когда не увидела имени Руслана Меджитова среди лауреатов Нобелевской премии по физиологии и медицине 2011 года. Его вклад в открытие толл-подобных рецепторов широко признан: в 2010 году он разделил с Жюлем Хоффманом Премию Розенстила за разъяснение механизмов врождённого иммунитета и был среди лауреатов премии Шао в 2011-м. Чарльз Джейнуэй предложил революционную идею: толл-подобные рецепторы врождённого иммунитета активируют адаптивный иммунный ответ. Руслан Меджитов первым открыл толл-подобный рецептор позвоночных и подтвердил идею Джейнуэя экспериментально. Протест против решения Нобелевского комитета, который не упоминает о вкладе Чарльза Джейнуэя и Руслана Меджитова, уже выразили и известные иммунологи, и студенты.
В 80-х годах прошлого столетия в центре внимания иммунологов была адаптивная (или специфическая) иммунная система. Специфический иммунный ответ (например, продукция антител против конкретного вируса) адаптируется к разнообразию патогенов, с которыми организм сталкивается в течение жизни, и формирует иммунологическую память. Большинство иммунологов изучало молекулярные детали рецепторов Т- и В-лимфоцитов и эффекторных механизмов адаптивного иммунитета (таких как антитела и лимфоциты-киллеры). Было известно, что репертуар рецепторов на поверхности лимфоцитов до встречи с антигеном не лимитирован и способен узнать практически любую молекулу [1].
Чтобы успешно бороться с инфекцией, не нанося вреда организму, иммунная система должна отличать патогены от клеток своего организма, — то есть «своё от не своего», как сформулировал еще в конце 1950-х австралийский вирусолог Бернет (M. Burnet), создатель клонально-селекционной теории адаптивного иммунитета [1]. Предполагалось, что рецепторы Т- и В-лимфоцитов, которые узнают «своё», заранее исключаются из участия в иммунном ответе.
Механизмы врождённого иммунитета (например, функции макрофагов и нейтрофилов) также изучались, но их рассматривали отдельно от адаптивного иммунитета, не предполагая существования связи между ними. Рецепторы клеток врождённого иммунитета генетически закодированы и неизменны в течение жизни.
Революционная идея Чарльза Джейнуэя
Некоторые экспериментальные факты, известные к тому времени, нельзя было объяснить, если рассматривать адаптивный иммунитет изолированно.
- Во-первых, для активации Т- и В-лимфоцитов необходимо два сигнала: стимуляция рецептора Т- или В-клетки и второй, костимулирующий сигнал, на который впервые указали Бретчер (P. Bretscher) и Кон (M. Cohn) в 1970 году [2]. Было известно, что этот «второй» сигнал передаётся Т-лимфоцитам костимулирующими молекулами B7 (гликопротеины из семейства иммуноглобулинов), расположенными на поверхности антиген-презентирующих клеток, и что именно этот сигнал определяет, будет ли индуцирован иммунный ответ при взаимодействии Т-клеточного рецептора со своим лигандом. Если взаимодействие Т-клеточного рецептора с лигандом происходит в отсутствии «второго» сигнала, то лимфоциты не активируются. Что определяет наличие «второго» сигнала, оставалось загадкой.
- Во-вторых, антитела на очищенные белки нельзя получить без адъюванта, в состав которого входят инактивированные микробы или их компоненты.
- Кроме того, было известно, что некоторые компоненты микробов (например, липополисахарид (ЛПС) грамотрицательных бактерий) активируют макрофаги, индуцируя секрецию воспалительных цитокинов, и стимулируют деление В-клеток.
В 1989 году Ч. Джейнуэй (Charles Janeway) написал во введении к материалам симпозиума в лаборатории в Колд Спринг Харбор: «…наше понимание распознавания иммунной системой приближается к своего рода асимптоте, где будущие эксперименты очевидны, технически сложновыполнимы и нацелены на достижение большей степени точности, чем на революционные изменения в понимании … однако я уверен, что существует огромная пропасть между этой асимптотой и полным пониманием того, как индуцируется иммунный ответ» [3].
Джейнуэй предположил, что существуют рецепторы, которые распознают определенные молекулярные паттерны, характерные для микробов и отсутствующие в организме хозяина [3]. Он назвал их «паттерн-распознающими рецепторами» и предположил, что активация именно этих рецепторов индуцирует костимулирующие молекулы на поверхности антиген-презентирующих клеток и способность передавать «второй» сигнал. Этот сигнал от рецепторов врождённого иммунитета сообщает, что лиганд, взаимодействующий с рецепторами адаптивного иммунитета, — «чужой», и что необходимо активировать иммунный ответ.
Паттерн-распознающие рецепторы передают сигнал о присутствии патогенов в организме. Джейнуэй предположил, что эти рецепторы генетически закодированы и должны узнавать жизненно важные для микробов молекулы, которые не могут быть изменены в результате одной мутации. Возможные кандидаты — сложные углеводы клеточной стенки или липопротеины. Такие молекулы входят в состав адъювантов, механизм действия которых до этого был совершенно непонятен. Теория Джейнуэя объясняла, что молекулы микробов, входящие в состав адъювантов, взаимодействуют с паттерн-распознающими рецепторами, имитируя таким образом инфекцию и активируя антиген-презентирующие клетки.
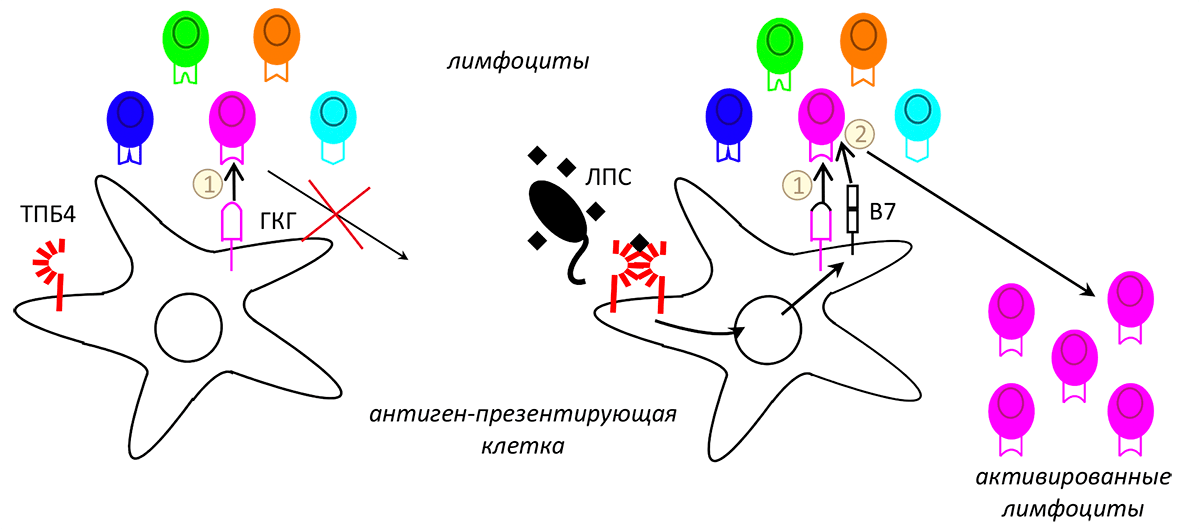
Рисунок 1. Адаптивный иммунный ответ не индуцируется, когда нет костимулирующего сигнала (слева). Липополисахарид микробов (ЛПС) активирует толл-подобные рецепторы (ТПБ-4) и индуцирует сигнал 2 (справа), вызывая размножение лимфоцитов. В этом случае белки главного комплекса гистосовместимости (ГКГ) презентируют пептиды рецепторам Т- и B-лимфоцитов (сигнал 1) при участии костимулирующей молекулы B7.
Джейнуэй провёл параллели между эффекторными механизмами врождённой и адаптивной иммунных систем. Он предположил, что паттерн-распознающие рецепторы существовали задолго до возникновения адаптивного иммунитета и активировали неспецифический иммунный ответ у беспозвоночных, у которых адаптивный иммунитет отсутствует [3]. В рамках теории Джейнуэя адаптивная иммунная система стала рассматриваться как дополнение, обеспечивающее специфичность распознавания, к эволюционно более древней врождённой иммунной системе.
Гипотеза в статье Джейнуэя была ясно изложена, объясняла механизмы действия адъювантов и индукции адаптивного иммунного ответа, эволюцию иммунной системы и открывала новые перспективы для исследования микробного распознавания. Несмотря на все это, статья осталась малозамеченной, так как такие рецепторы были неизвестны, и как их искать экспериментальным путём, было неясно. «Это привело к периоду в моей жизни, полному неудовлетворённости, — вспоминал Джейнуэй в своей автобиографии, — когда много работы проводилось по адаптивному иммунитету и относительно немного — по врожденному» [4].
Поиск паттерн-распознающих рецепторов
Все изменилось, когда в Москве Руслан Меджитов прочитал статью Джейнуэя. Аспирант без специального иммунологического образования понял, что необходимо было найти паттерн-распознающие рецепторы, и был полон решимости это сделать. Он написал Джейнуэю о своём желании работать над этой темой, однако тот далеко не сразу принял его в свою лабораторию. Несмотря на это, Джейнуэй впоследствии так отзывался о нем: «Хотя я обучил много отличных аспирантов и постдоков, Руслан Меджитов стал первой настоящей суперзвездой, работавшей в моей лаборатории, и я получал большое удовольствие от общения с ним» [4]. («Биомолекула» уже публиковала рассказ о жизни Руслана Меджитова и интервью с ним: «Интервью с профессором Йельского университета Русланом Меджитовым» [5].)
Руслан Меджитов в лаборатории Чарльза Джейнуэя сконцентрировался на поиске рецепторов на поверхности антиген-презентирующих клеток, которые способны распознавать микробные молекулярные паттерны (чаще всего это углеводы) и активировать костимуляторные молекулы [6]. Внеклеточный домен таких рецепторов должен узнавать углеводы. Белки, высокоспецифично связывающие углеводные остатки, называются лектинами; наиболее изученный иммунологами представитель этого семейства — лектин, связывающий маннозу. Его лектиновый домен типа C (кальций (Cа)-зависимый) был наиболее вероятным внеклеточным доменом нового рецептора [6]. Внутриклеточный домен нового рецептора должен передавать сигнал для активации костимулирующих молекул и воспалительных цитокинов. Рецептор, узнающий липополисахарид, был неизвестен, но было ясно, что он активирует сигнальный путь, ведущий к транскрипционному фактору NF-κB. Этот транскрипционный фактор является ключевым сигнальным компонентом врождённого иммунитета, вероятно также необходимым для активации костимулирующих молекул. Один из хорошо изученных рецепторов, активирующих NF-κB (рецептор интерлейкина 1), содержит внутриклеточный TIR домен, гомологичный такому же домену толл-рецептора дрозофилы. Предположение Руслана Меджитова, что новый рецептор также может содержать внутриклеточный TIR домен [6], впоследствии окажется верным. Итак, Р. Меджитов искал новый трансмембранный белок, содержащий внеклеточный лектиновый домен и внутриклеточный TIR домен [6].
В начале 1996 года он нашёл в базе данных экспрессируемых последовательностей ДНК последовательность, кодирующую белок, который имел сходство с TIR доменом; внеклеточный домен этого белка также имел сходство с толл-рецептором дрозофилы и не содержал лектинового домена. Теперь этот белок известен как толл-подобный рецептор 4.
Толл-рецептор дрозофилы

Рисунок 2. Жюль Хоффманн, руководитель научно-исследовательских работ французского Национального центра научных исследований в Страсбурге, президент Французской Академии наук
Отсутствие лектинового внеклеточного домена у толл-подобного рецептора 4 и его гомология с внеклеточным доменом толл-рецептора дрозофилы сначала вызвали разочарование. Дело в том, что известный лиганд толл-рецептора был эндогенным и никак не был связан с распознаванием микробов. Толл-рецептор, открытый в 1988 году [7], активируется во время эмбриогенеза, и его роль в иммунной системе была неизвестна.
В том же 1996 году Жюль Хоффманн (J. Hoffmann) опубликовал своё открытие: сигнальный путь толл-рецептора необходим для защиты дрозофилы от грибковых инфекций [8].
Профессора Хоффманна интересовало, как активируется экспрессия антимикробных пептидов [20] (одного из эффекторных механизмов врождённого иммунитета) у дрозофилы. Он заметил поразительное сходство между транскрипционным фактором NF-κB позвоночных и морфогенным транскрипционным фактором Dorsal у дрозофилы [8]. Dorsal активен во время эмбрионального развития, но сигнальный путь, ведущий к его активации, очень похож на сигнальный каскад, активный во время воспалительного ответа у позвоночных.
Жюль Хоффманн и его коллеги показали, что дрозофилы с мутацией в сигнальном пути толл-рецептора подвержены грибковым инфекциям, и что этот рецептор необходим для индукции противогрибкового пептида [8].
Это известие укрепило предположение Руслана Меджитова, что открытый им человеческий толл-подобный рецептор 4 и есть новый паттерн-распознающий рецептор, который активирует адаптивный иммунный ответ.
Экспериментальное подтверждение теории Джейнуэя
Чтобы подтвердить своё предположение экспериментально, Руслан Меджитов создал мутантный толл-подобный рецептор 4, находящийся в активированном состоянии постоянно (поскольку его природный лиганд был неизвестен). Клонирование человеческого толл-рецептора было описано в блестящей статье в Nature в 1997 году [9]. Этот рецептор индуцировал экспрессию костимулирующей молекулы В7 и воспалительных цитокинов, которые необходимы для активации наивных Т-лимфоцитов [9].
Эксперименты, описанные в этой статье, доказывали существование паттерн-распознающих рецепторов у позвоночных, активация которых приводит к инициации адаптивного иммунного ответа. Основное положение теории Джейнуэя было подтверждено экспериментально [10]. Это открытие привело к взрыву интереса иммунологов к врождённому иммунитету и заложило основу для интерпретации последующих экспериментов.
Дальнейшее развитие: лиганды для толл-подобных рецепторов
В течение последующих нескольких лет стало ясно, что толл-подобные рецепторы позвоночных узнают микробные компоненты непосредственно (в отличие от толл рецептора дрозофилы). Годовский (P.J. Godowsky) и коллеги первыми показали, что экстракт ЛПС, содержащий бактериальные липопротеины, активирует толл-подобный рецептор 2 [11]. Сейчас известно, что именно липопротеины являются лигандами этого рецептора.
В распознавании ЛПС участвует не один, а несколько белков, и поэтому выяснение этого механизма было нелёгким. Ещё с 1960-х годов известны линии мышей, нечувствительных к ЛПС. В 1998 году Джерард (C. Gerard) обратил внимание, что ген, кодирующий толл-подобный рецептор 4, находится в локусе, мутированном у мышей, нечувствительных к ЛПС [12]. Бётлер (B. Beutler) в 1998 году [13] и Мало (D. Malo) в 1999 году [14] методом позиционного клонирования подтвердили, что мутации именно в открытом Русланом Меджитовым гене, кодирующем толл-подобный рецептор 4, вызывают у этих мышей нечувствительность к ЛПС. Мияке (K. Miyake) и коллеги открыли недостающий компонент рецептора к ЛПС — МД-2 в 1999 году [15].
В настоящее время известно несколько классов паттерн-распознающих рецепторов, как мембранных, так и цитоплазматических [16].
Нобелевская премия по физиологии и медицине 2011 года
Концепция активации адаптивного иммунитета сигналами от иммунитета врождённого, созданная Ч. Джейнуэем и экспериментально подтверждённая Р. Меджитовым, является общепризнанной и входит в современные учебники по иммунологии. Несмотря на то, что их имена не упоминаются в официальном пресс-релизе Нобелевского комитета («Биомолекула» публиковала статью по материалам этого пресс-релиза: «Иммунологическая Нобелевская премия (2011)» [17]), по мнению многих известных иммунологов [18], [19], первооткрыватели толл-подобных рецепторов Чарльз Джейнуэй и Руслан Меджитов заслуживают признания Нобелевского комитета.
- Burnet M. The clonal selection theory of acquired Immunity. Cambridge, 1959;
- P. Bretscher, M. Cohn. (1970). A Theory of Self-Nonself Discrimination: Paralysis and induction involve the recognition of one and two determinants on an antigen, respectively. Science. 169, 1042-1049;
- C.A. Janeway. (1989). Approaching the Asymptote? Evolution and Revolution in Immunology. Cold Spring Harbor Symposia on Quantitative Biology. 54, 1-13;
- Charles A. Janeway. (2002). A TRIP THROUGH MY LIFE WITH AN IMMUNOLOGICAL THEME. Annu. Rev. Immunol.. 20, 1-28;
- Интервью с профессором Йельского университета Русланом Меджитовым;
- Ruslan Medzhitov. (2009). Approaching the Asymptote: 20 Years Later. Immunity. 30, 766-775;
- Carl Hashimoto, Kathy L. Hudson, Kathryn V. Anderson. (1988). The Toll gene of drosophila, required for dorsal-ventral embryonic polarity, appears to encode a transmembrane protein. Cell. 52, 269-279;
- Bruno Lemaitre, Emmanuelle Nicolas, Lydia Michaut, Jean-Marc Reichhart, Jules A Hoffmann. (1996). The Dorsoventral Regulatory Gene Cassette spätzle/Toll/cactus Controls the Potent Antifungal Response in Drosophila Adults. Cell. 86, 973-983;
- Ruslan Medzhitov, Paula Preston-Hurlburt, Charles A. Janeway. (1997). A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature. 388, 394-397;
- Ruslan Medzhitov, Charles A Janeway. (1997). Innate
