Влияние анестезии на иммунитет
Иммуносупрессирующее действие анестезии, несмотря на долгую и противоречивую историю, остается предметом дискуссий. Эту проблему впервые начали изучать еще в начале XX в., когда появились сообщения о повышении чувствительности экспериментальных животных к инфекции, об ускорении роста опухолей после применения эфира и хлороформа. В 1904 г. обнаружено, что у кроликов, подвергнутых воздействию алкоголя, эфира и хлороформа, снижается резистентность к стрептококковой, стафилококковой и пневмококковой инфекциям. А уже в 1916 г. в клинических условиях начали изучать фагоцитоз и его трансформацию под действием наркоза. Было обнаружено, что в зависимости от применения гедоналового, хлороформного или эфирно-хлороформного наркозов наблюдается снижение фагоцитарной и бактерицидной активности лейкоцитов.
Общая анестезия существенно влияет на иммунную систему, приводя к еще большему ее угнетению. Ряд препаратов (тиопентал, сукцинилхолин, изофлюран, дроперидол, фентанил, кетамин) вызывает угнетение системы комплемента, подавление фагоцитоза и антителозависимой цитотоксичности, снижая потенциал антибактериальной защиты. В результате воздействия этих анестетиков в крови больных увеличивается скорость синтеза ФНО-а, а- и |3-интерферонов, что вызывает гиперактивацию лимфоцитов, а значит — усиливает проявления воспаления.
Действие анестетиков на иммунную систему носит кратковременный и обратимый характер, однако не исключается, что такое влияние может приобрести клиническое значение, особенно у иммунокомпрометированных больных, а также после травматических и продолжительных операций. Следовательно, в отношении иммунной системы анестезия играет двоякую роль, при этом ее защитная составляющая обусловлена степенью обеспечения анестезиологической защиты при операциях для снижения стрессовой составляющей оперативного вмешательства. Можно выделить два возможных механизма развития иммуносупрессии, вызываемой анестезией:
- прямое цитотоксическое воздействие;
- опосредованное воздействие через изменения в других системах.
Наиболее прогностически значимым является уменьшение содержания NK-клеток — естественных киллеров, осуществляющих противоопухолевую и противовирусную защиту, поскольку именно они являются наиболее чувствительным звеном этого воздействия и считаются самыми информативными критериями реактивности организма после операции.
Оперативные вмешательства, выполненные под общей анестезией, могут приводить к нарушениям клеточного и гуморального иммунитета, снижению фагоцитарной активности и естественных киллеров, угнетению противоопухолевой защиты. Эпидуральная анестезия имеет несомненные преимущества перед общей анестезией в отношении неблагоприятного влияния на иммунитет пациента и, следовательно, качество послеоперационного периода. Важно отметить, что операции при доста-ISShom уровне эпидурального блока, по сравнению с разными методами общего обезболивания, сопровождаются менее значительными эндокринно-метаболическими сдвигами: в меньшей степени повышается уровень цАМФ, кортизола, соматотропно-го гормона, пролактина, глюкозы, жирных кислот и лактата в периферической крови.

Иммуносупрессирующее действие анестезии, несмотря на долгую и противоречивую его историю, остается спорным. Эту проблему впервые начали изучать еще в начале XX века, когда появились сообщения о повышении чувствительности экспериментальных животных к инфекции, об ускорении роста опухолей после применения эфира и хлороформа. В 1904 году обнаружено, что у кроликов, подвергнутых воздействию алкоголя, эфира и хлороформа, снижается резистентность к стрептококковой, стафилококковой и пневмококковой инфекциям. А уже в 1916 году в клинических условиях стали изучать фагоцитоз и его трансформацию под действием наркоза. Было обнаружено, что в зависимости от применения гедоналового, хлороформного или эфирно-хлороформного наркозов наблюдается снижение фагоцитарной и бактерицидной активности лейкоцитов.
Общая анестезия существенно влияет на иммунную систему, приводя к еще большему ее угнетению. Ряд препаратов (тиопентал, сукцинилхолин, изофлюран, дроперидол, фентанил, кетамин) вызывает угнетение системы комплемента, подавление фагоцитоза и антителзависимой цитотоксичности снижая потенциал антибактериальной защиты. В результате воздействия этих анестетиков в крови больных увеличивается скорость синтеза TNF-α, α- и β-интерферонов при стимуляции in vitro лимфоцитов с ФГА в реакции бласттрансформации (РБТЛ), то есть гиперактивирует лимфоциты а значит увеличивает проявления воспаления.
Действие анестетиков на иммунную систему носит кратковременный и обратимый характер, однако не исключается, что такое влияние может приобрести клиническое значение, особенно у «иммунокомпрометированных» больных, а также после травматических и продолжительных операций. Следовательно, в отношении иммунной системы анестезия играет двоякую роль, при этом ее защитнаясоставляющая обусловлена степенью обеспечения анестезиологической зашиты при операциях для снижения стрессовой составляющей оперативного вмешательства.
Наибольшим иммуносупрессивным действием обладает фторотан, что связывают c его цитостатическим (антимитотическим) эффектом из-за блокирования синтеза ДНК, РНК и деления клеток в течение 36-48 часов. Такие же изменения проявляются, в течение трех суток, после общей анестезии без оперативного вмешательства. Указанные эффекты фторотана объясняют его повышенной способностью растворяться в липидах мембран, что приводит к снижению метаболизма и функциональной активности иммунных клеток. Поэтому, существует точка зрения, что анестезия фторотаном относительно противопоказана иммунокомпрометированным больным со злокачественными новообразованиями или с острыми септическими состояниями.
Влияние анестезии на гуморальные иммунные реакции, в частности на содержание иммуноглобулинов в сыворотке крови, достаточно противоречивы. Еще в 1979 г. М. Gioffre сообщил о снижении уровня иммуноглобулинов IgА, IgМ и IgG в крови хирургических пациентов на следующий день после операции на фоне общей анестезии. Его коллега A.Duller в том же году не обнаруживали снижения уровней Ig после полостных операций средней тяжести, выполняемых под общим обезболиванием.
При сочетании операции с анестезией тиопенталом натрия снижение IgG длится от 3 до 6 дней, причем, содежание IgM наоборот увеличивается. После сходных операций под сбалансированной анестезией или фторотановым наркозом снижение IgG и IgМ в течение 24 часов было отмечено только у больных, оперированных под сбалансированной анестезией , что авторы объясняют симпатоадреналовой активацией в связи с использованием сульфентанила. Отмечено также значительное снижение уровней IgG, IgА, IgМ после операций, выполняемых и под эфирно-закисным наркозом.
Мало известно об изменении динамики иммуноглобулинов и возможной ее информативности при возникновении после операций инфекционно-воспалительных осложнений. Чаще всего выявлялись лишь низкие показатели IgG у больных с послеоперационными инфекционно-воспалительными осложнениями.
Известна способность закиси азота вызывать окисление соединений металлопорфиринов в клетке. Даже кратковременная (2 часа) экспозиция 80 % закиси азота с кислородом in vitro вызывает снижение миграции нейтрофилов, а ингаляция свыше 6 часов приводит к угнетению митоза клеток костного мозга, снижению в них синтеза ДНК, к лейкопении нарушению гемопоэза, снижению количества ретикулоцитов. Отмечено возникновение мегалобластического типа кроветворения, развитие агранулоцитоза и тромбоцитопении при ее ингаляции свыше 24 часов из-за инактивации закисью азота витамина В12 в результате оксидации кобальта в молекуле последнего.
Выявлено прямое иммуносупрессирующее действие барбитуратов короткого действия. Тиопентал натрия в концентрациях, соответствующих клиническим, in vitro снижает миграцию, хемотаксис и фагоцитоз лейкоцитов, цитотоксичность Т-лимфоцитов и моноцит-опосредованный цитолиз. Анестезирующие дозы барбитуратов через 3 мин. после введения — на пике концентрации препарата в крови — вызывают достоверное снижение РБТЛ, что сочетается с увеличением в течение 24 часов количества Т — лимфоцитов.
Примененные во время хирургической операции этомидат, профофол, тиопентал и опиаты могут непосредственно воздействовать на функцию
иммунокомпетентных клеток. Как показалиJ. М. Brand и соавторами в 1998году у пациентов происходит значительное снижение уровня циркулирующих NК-клеток, сопровождающееся увеличением числа В-лимфоцитов и CD8+-лимфoцитoв. Эти изменения сочетались с увеличением уровня α- и γ-интерферона, фактора некроза опухоли (α-ТНФ) и растворимого рецептора интерлейкина-2 после стимуляции митогенами и выраженными эндокринно-метаболическими сдвигами, в то время как уровень ИЛ-6 и ИЛ- l не изменялся . В отличие от фторотана, закиси азота или барбитуратов, прямое действие на иммунокомпетентную клетку кетамина считается незначительным. Взятый в концентрациях, соответствующих клиническим, он мало влияет in vitro на хемотаксис полиморфноядерных лейкоцитов доноров , их фагоцитарную активность, не изменяет митогенный ответ Т-лимфоцитов на ФГА.
Способность кетамина вызывать метаболическую иммуносупрессию, активировать супрессорные Т-лимфоциты может отразиться на течении иммунных реакций в послеоперационном периоде, а возможно и приобрести определенное клиническое значение для течения последнего. Однако, комплексное изучение состояния иммунного статуса под влиянием кетамина не проводилось, особенно мало известно о его влиянии на гуморальные факторы иммунного статуса. Недавно была изучена динамика сывороточных иммуноглобулинов в течение 3-х суток после кетамина, осуществленного для обеспечения бронхоскопии, и при этом не обнаружили существенных сдвигов, за исключением тенденции к снижению уровня IgA. Между тем, все больше накапливается данных о неблагоприятных эффектах кетамина — гипердинамии, усилении выброса «адаптивных» гормонов, нарушении психики в ближайшем послеоперационном периоде, которые могут опосредовать влияние кетамина на иммунную систему.
После кетаминового мононаркоза, без предварительного введения седуксена, у больных фибромиомой матки в течение недели после операции отмечал значительное угнетение Т- клеточного звена иммунитета, сопровождающееся снижением уровня сывороточных Ig, особенно IgG. К тому же, во время операции у этих больных имело место значительное повышение уровня кортизола на пике операционной травмы, прямо коррелирующее с выраженностью Т-лимфоцитарной недостаточности, что указывает на решающую роль адекватности анестезии в послеоперационной иммуносупрессии. Многих этих недостатков лишена даже длительная анестезия препаратом Ксенон.
Вышеизложенные факты позволяют выделить два возможных механизма развития иммуносупрессии, вызываемой анестезией:
1. Прямое цитотоксическое воздействие.
2. Опосредованное воздействие через изменения в других системах.
Наиболее прогностически значимым является уменьшение содержания NK-клеток — естественных киллеров, осуществляющих противоопухолевую и противовирусную защиту, поскольку именно они являются наиболее чувствительным звеном этого воздействия и считаются самыми информативными критериями реактивности организма после операции .
Важно отметить, что операции при достаточном уровне эпидурального блока, по сравнению с разными методами общего обезболивания, сопровождаются менее значительными эндокринно-метаболическими сдвигами: в меньшей степени повышается уровень цАМФ, кортизола, СТГ, пролактина, глюкозы, жирных кислот и лактата в периферической крови.
При сравнении эпидуральной анестезии (ЭА) с разными методами общего обезболивания регистрируются меньшие сдвиги отдельных показателей клеточного иммунитета: показана способность ЭА на 40 % редуцировать выраженность лимфопении и гранулоцитоза . После операций, выполняемых под ЭА, не меняется миграция лейкоцитов, митогенный ответ Т-лимфоцитов и продукция ими лимфокинов, стабильной остается цитотоксическая функция моноцитов, быстрее восстанавливается активность естественных клеток-киллеров. Большая эффективность и безопасность для иммунной системы отмечается при сочетании монометода эпидуральной анестезии (ЭА) с атарактиками, препаратами, снижающими активность гипоталамической области и скорость синтеза в ней биогенных аминов.
Таким образом, оперативные вмешательства, выполненные под общей анестезией, могут приводить к нарушениям клеточного и гуморального иммунитета, снижению фагоцитарной активности и угнетению противоопухолевой защиты и естественных киллеров. Эпидуральная анестезия имеет несомненные преимущества перед общей анестезией в отношении неблагоприятного влияния на иммунитет пациента и, следовательно, на качество послеоперационного периода.
.
Дата добавления: 2015-09-20; просмотров: 1157 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org — Контакты — Последнее добавление
Механическая травма вызывает выраженные патологические и компенсаторные изменения практически во всех органах и системах. Развивается травматическая болезнь, с этого момента появляются и непрерывно нарастают потоки болевой импульсации.
Травматическая болезнь — это синдромокомплекс компенсаторно-приспособительных и патологических реакций всех систем организма на травму различной этиологии, характеризующийся стабильностью и длительностью течения, определяющий прогноз для жизни и трудоспособности (Котельников Г.П., Чеснокова И.Г., 1996). Изменения в организме, вызванные травмой, операцией, обусловливают необходимость применения специальных методов лечения. Степень защиты организма от операционной травмы при помощи различных методов анестезии, равно как и критерии ее адекватности, в настоящее время продолжают оставаться предметом дискуссий.
Общеизвестен тот факт, что травма вызывает выраженную иммунодепрессию, поэтому важно проследить на фоне уже имеющихся иммунологических сдвигов при травме дополнительное влияние метода анестезии на иммунный статус. Исследования проводились в двух группах пострадавших: первую группу составили пациенты, оперированные под спинно-мозговой анестезией (СМА), вторую группу представляли больные, подвергшиеся оперативному лечению под общим обезболиванием. Исследовались клеточное звено иммунной системы (общее количество лимфоцитов о крови, СД3+, СД4+, СД8+, HLA-DR+ клеток) и гуморальное звено иммунной системы (СД20+ клетки, IgA, IgG, IgM крови). В обеих группах отмечена умеренная иммунодепрессия клеточного звена иммунитета. Это согласуется с данными литературы о подавлении иммунного ответа на травму. Выявлены статистически значимые различия по всем показателям иммунного статуса в обеих группах. При СМА максимальная иммунодепрессия отмечена во время оперативного вмешательства, но к 7-м суткам большинство исследуемых показателей лаже превосходило исходные значения. Этого не наблюдается в группе пациентов, перенесших оперативное вмешательство в условиях обшей анестезии. У данных больных тенденция к нормализации проявляется только в отношении Т-хелперов/ индукторов, а по остальным показателям иммунодепрессия еще более усугубляется.
Гуморальное звено иммунитета более устойчиво к действию травмы и анестезии. При этом снижение уровня иммуноглобулинов классов А и G наблюдается как при СМА, так и при общем обезболивании, однако на 7-е сутки после СМА отмечается повышение содержания IgА, а после общего обезболивания оно не зарегистрировано.
Наши данные свидетельствуют о том, что наибольшее повреждение иммунной системы при травматической болезни отмечается во время проведения оперативного вмешательства и анестезиологического пособия. Иммунодепрессия после СМА короче и менее выражена, чем после общего обезболивания. Стойкое угнетение клеточного иммунитета у больных после операции с применением общего обезболивания может служить прогностически неблагоприятным фактором в развитии инфекционных осложнений. В связи с этим, следует считать оправданным применение СМА у больных травматической болезнью.
Один из путей предупреждения послеоперационной заболеваемости в результате иммунодепрессии — совершенствование известных и разработка новых методов анестезии, премедикации с учетом тяжести травмы, исходного состояния и иммунной системы.
Пыщева Л.В., Лимарева Л.В.
ГОУВПО «Самарский государственный медицинский университет»
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Хиновкер В.В.
1, 2
Красавина Е.Ю.
1
Газенкампф А.А.
2
1 ФГБУЗ «Сибирский клинический центр» ФМБА России
2 ФГОУ ВО «КрасГМУ им. проф. В.Ф. Войно-Ясенецкого» Минздрава России
Представлены результаты исследования 60 пациентов пожилого возраста, перенесших тотальное эндопротезирование тазобедренного сустава. Пациенты были разделены на три группы по виду обезболивания (спинально-эпидуральная анестезия (СЭА), n = 20, продленная спинальная анестезия (ПСА), n = 20, и общая анестезия (ОА), n = 20). Исследовалось влияние перечисленных видов анестезии на клеточный и гуморальный иммунитет. Исследование иммунной системы включало в себя определение показателей клеточного и гуморального иммунитета. В ходе проведения работы была выявлена взаимосвязь изменений, происходящих в клеточном и гуморальном иммунитете, с методом проведения анестезии. Полученные данные позволяют судить о том, что методом выбора, с позиции влияния на клеточный и гуморальный иммунитет, является продленная спинально-эпидуральная анестезия.
анестезия
иммунитет
спинальная анестезия
1. Любошевский П.А., Овечкин А.М. Возможности оценки и коррекции хирургического стресс-ответа при операциях высокий травматичности // Регионарная анестезия и лечение острой боли. — 2014. — Т. 8. — № 4. — С. 5-21.
2. Okada R., Kondo T., Matsuki F. et al. Phenotypic classification of human CD4+ T cell subsets and their differentiation // Int. Immunol. – 2008. — 20 (9).
3. Карякина Е.В., Гладкова Е.В., Персова Е.А. и др. Мониторинг цитокинового профиля крови при тотальном эндопротезировании тазобедренного сустава у больных остеоартрозом с остеодефицитом различной степени // Кафедра травматологии и ортопедии. — 2016. — Спецвыпуск. — С. 80.
4. Батыгин Г.Г. Пациенты после тотального эндопротезирования тазобедренного сустава – часть социума // Народонаселение. — 2013. — № 4 (54). — С. 038-046.
5. Летов А.С., Зоткин В.В., Воскресенский О.Ю. и др. Тотальное эндопротезирование тазобедренного сустава при анкилозах тазобедренного сустава // Сборник научных трудов НИИТОН СГМУ. — Саратов, 2017. — С. 147-150.
6. Мамедов А.Д., Бельтюков П.П. Изменение функциональных характеристик системы комплемента при использовании сочетанной комбинированной спинально-эпидуральной анестезии: материалы VI Всерос. науч. конф. «Дни иммунологии 2002. Молекулярные основы иммунорегуляции, иммунодиагностики и иммунотерапии» // Мед. иммунология. — 2012. – Т. 4, N 2. — С. 348.
7. Юсупов К.С., Летов А.С., Зоткин В.В. и др. Основные факторы риска и причины развития хронического болевого синдрома после тотального эндопротезирования тазобедренного сустава // Сборник научных трудов НИИТОН СГМУ. — Саратов, 2017. — С. 259-262.
8. Бельтюков П.П., Мамедов А.Д. Оценка функциональной активности компонента СЗ системы комплемента при воздействии тиопентала in vitro // Ученые записки. — 2013. – Т. X. – N 3. — С. 29-31.
По оценке ведущих специалистов потребность в операции тотального эндопротезирования тазобедренного сустава (ТЭТС) в России составляет 10 операций на 100 000 жителей в год. Средний возраст пациентов, нуждающихся в операции, превышает 70 лет [1].
ТЭТС с точки зрения анестезиолога — это большая по объему операция, сопровождающаяся кровопотерей, нередко проводимая больному в пожилом возрасте с выраженной сопутствующей патологией и, как следствие, нередко сопровождающаяся осложнениями. Двигательная активность этих пациентов исходно существенно ограниченна, что маскирует снижение толерантности к физическим нагрузкам, обусловленное кардио-пульмональной патологией.
Современные средства и методы интраоперационной анестезиологической защиты должны обеспечивать нормальное функционирование всех систем жизнеобеспечения, иметь высокий уровень безопасности, быть удобными и доступными в применении, гарантировать высокое «качество жизни» пациенту в послеоперационном периоде, а также способствовать максимально быстрому восстановлению структурно-функциональной целостности органов и тканей [2].
До сих пор в литературе продолжается дискуссия о выборе оптимального метода анестезии при ТЭТС. Накоплено достаточное количество данных, свидетельствующих о преимуществе нейроаксиальной анестезии в сравнении с общей [3; 4].
Нам не встретились литературные данные проведенных исследований о влиянии различных методов анестезии на иммунитет у ортопедических больных. Кроме того, практически не исследованы изменения активности и ёмкости системы комплемента, ряда гуморальных иммунных систем как маркеров адекватности анестезиологического обеспечения.
Целью работы являлось сравнительное изучение влияния продленной спинальной анестезии, спинально-эпидуральной анестезии и общей анестезии на состояние клеточного и гуморального иммунитета у пациентов при ТЭТС.
Материалы и методы
В исследование были включены пациенты, оперированные в плановом порядке в условиях спинально-эпидуральной анестезии (СЭА, n = 20), продленной спинальной анестезии (ПСА, n = 20) и общей анестезии (ОА, n = 20). По гендерному признаку больные разделились следующим образом: 82,1% – женщины и 17,9% – мужчины (таблица).
Сравнительные характеристики пациентов в группах (М ± σ)
Параметры | Группа ПСА | Группа СЭА | Группа ОА |
Возраст (лет) | 65,81 ± 12,42 | 66,93 ± 10,99 | 66,76 ± 11,76 |
Исходный показатель лейкоцитов (х 109) | 5,8 (±0,5) | 5,5(±0,4) | 4,9(±0,5) |
СОЭ | 33,0(±1,5) | 38(±1,2) | 39(±1,5) |
Ig A | 2,9(±1,2) | 3,1(±1,3) | 2,8(±1,3) |
Ig G | 10(±1,2) | 8,0(±1,2) | 11(±1,2) |
Ig M | 1,5(±1,2) | 1,8(±1,2) | 1,6(±1,2) |
T-клетки | 77,6(±1,5) | 85(±1,5) | 78(±1,5) |
В-клетки | 8,85(±1,2) | 11,0(±1,1) | 8,7(±1,1) |
Т-хелперы | 55,8(±1,2) | 60(±1,2) | 51,4(±1,2) |
Т-супрессоры | 26,4(±1,3) | 25,8(±1,1) | 26(±1,1) |
По характеру сопутствующих заболеваний выделенные группы были однородны. Наиболее часто встречались следующие нозологии, характерные для лиц пожилого возраста: ИБС, артериальная гипертензия, ХОБЛ, сахарный диабет.
СЭА проводилась по общепринятой методике с применением специального набора «Эспокан». Методика выполнения СЭА была следующей: в положении пациента на боку на уровне L2-3 производилась пункция и идентификация эпидурального пространства методом потери сопротивления. Через иглу Туохи проводилась спинальная игла диаметром 18 G, интратекально вводился гипербарический раствор бупивакаина (marcain spinal heavy) в дозе 10–12 мг. После удаления спинальной иглы, через иглу Туохи на 2–4 см в краниальном направлении проводился эпидуральный катетер, который использовался для послеоперационного обезболивания. Экспозиция в положении пациента на боку в течение 15 минут.
Методика ПСА: в положении пациента на боку на уровне L2-3 прямой иглой с коротким срезом (short bevel) G18 пунктировалось эпидуральное пространство с идентификацией положения методом потери сопротивления. Через эпидуральную иглу субарахноидально на 3–4 см устанавливался интратекальный катетер на игле 24 калибра. Расположение катетера контролировалось аспирационной пробой. Для достижения анестезии вводилось 10–12 мг бупивакаина (marcain spinal heavy) (2,0-2,5 мл ) болюсно. Экспозиция в положении пациента на боку в течение 15 минут.
Наркотические анальгетики в группах СЭА и ПСА не применялись. В обеих группах в ходе операции проводилась инфузионная терапия и седация диазепамом (41,6–83,3 мкг/кг/мин) и пропофолом (25–60 мкг/кг/мин). У всех больных развивался выраженный моторный блок на стороне операции – 4 балла по шкале Bromage.
Общая анестезия проводилась сочетанием севофлюрана (севоран) 1–1,5 МАК с учетом возраста пациентов и фентанила в терапевтической дозе. На интубацию и для поддержания релаксации использовался атракриум.
У всех пациентов проводился рутинный неинвазивный контроль гемодинамики при помощи мониторов DASH 3000: ЭКГ, артериальное давление, частота сердечных сокращений, SpO2.
После операции больные переводились в палату отделения анестезиологии и реанимации, где в течение 2 последующих дней в спинальный либо эпидуральный катетер проводилась постоянная инфузия изобарического 0,2%-ного раствора ропивакаина (наропин) с применением перфузора со скоростью 0,3–0,5 мл/час при ПСА и 3–5 мл/час при СЭА. Послеоперационная анальгезия сопровождалась слабым моторным блоком от 1 до 2 баллов по шкале Bromage.
В группе ОА послеоперационное обезболивание проводилось тримеперидином по методике внутривенной контролируемой пациентом анальгезии (КПА) в средней дозе 60–80 мг/сутки. Обычные установленные параметры КПА на перфузоре: постоянная скорость 40-50 мкг/кг/час, болюс – 4 мг, локаут-интервал 30 мин.
Исследуемая и контрольная группы пациентов были сопоставимы по возрасту, объему и длительности оперативного вмешательства и основным иммунологическим показателям. Всем больным выполнялось цементное тотальное эндопротезирование тазобедренного сустава.
Исследование иммунной системы включало в себя определение показателей клеточного и гуморального иммунитета Образцы крови для исследования показателей иммунитета забирались дважды: за сутки до операции и через 72 часа после нее. Для определения IgA, IgG, IgM исследовалась сыворотка крови, методом иммунотурбидиметрии, на аппарате — биохимический анализатор Olympus AU 400, реактивы фирмы Beckmen coulter. Для определения иммунограммы и фагоцитоза исследовалась цельная кровь методом прямой иммунофлуоресценции с использованием моноклональных антител на аппарате — цитофлуориметр Navios, реактивы фирмы Beckmen coulter. За норму были приняты показатели здоровых добровольцев и данные литературы.
Результаты, полученные в ходе проведенного исследования, обрабатывались методами параметрической статистики с применением программы Statistica.
Полученные результаты
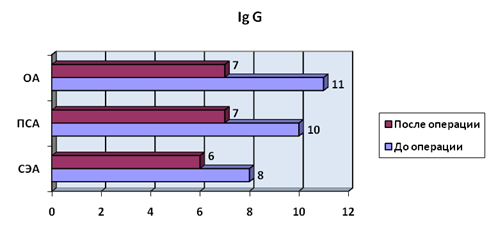
Уровень Ig G во всех исследуемых группах после операции снижался в приблизительно равной степени.
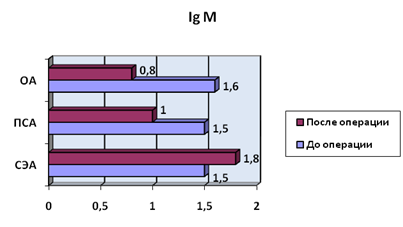
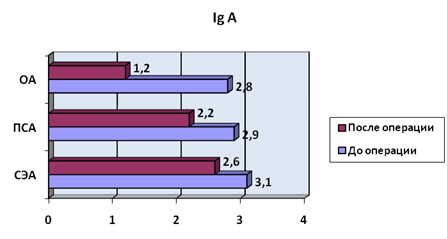
ОА характеризовалась значительным угнетением выработки Ig M, и Ig A.
Применение ПСА сопровождалось меньшим угнетением выработки иммуноглобулинов по сравнению с общей анестезией. Наиболее выраженным стресс-протективное действие оказалось у СЭА, в данной группе уровень IgA после операции снижался существенно меньше, а уровень IgM оказался даже несколько выше предоперационного (рисунки 1-3).
p < 0,05 ЗДЕСЬ И ДАЛЕЕ до и после операции.
Рис. 1. Уровень Ig G, г/л
 p < 0,05
p < 0,05
Рис. 2. Уровень Ig M, г/л
 p < 0,05
p < 0,05
Рис. 3. Уровень Ig A, г/л
Несколько иная картина была характерна для клеточного звена иммунитета. Ниже представлены диаграммы, которые иллюстрируют послеоперационные сдвиги клеточного иммунитета у разных групп пациентов.
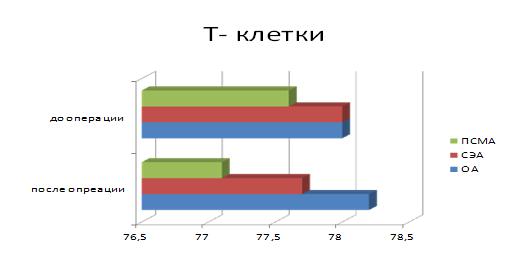
Рис. 4. Уровень Т–клеток, %, p < 0,05
Показатели динамики популяции Т-лимфоцитов свидетельствуют о том, что хотя в послеоперационном периоде общее количество Т-клеток во всех группах оставалось в пределах нормы, у больных, оперированных в условиях ОА, отмечено наибольшее угнетение Т–звена иммунитета.
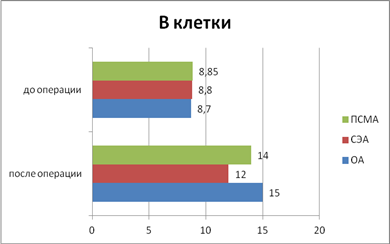
Рис. 5. Уровень В-клеток, %
Данные, отраженные на рис. 5, свидетельствуют о том, что в послеоперационном периоде происходит стимуляция количества В–клеток в разной степени при всех использованных видах обезболивания (ПСМА — 46%; СЭА – 30%; ОА – 49%), p < 0,05.

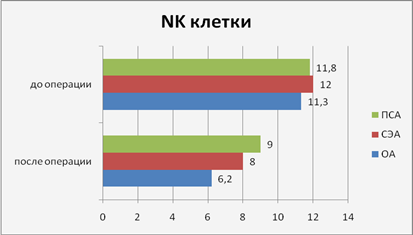
Рис. 6. Уровень NK–клеток, %
Количество NK-клеток в послеоперационном периоде значительно снижалось во всех группах, но наиболее выраженно – в группе ОА (ПСА – 17% ; СЭА – 33% ; ОА – 42%).
По данным, приведенным на рисунках 4-6, наблюдается активация клеточного иммунитета, что говорит о напряжении регуляторных систем и развитии неблагоприятных стратегий адаптации, преимущественно при ОА.
По данным ряда авторов, у больных общехирургического профиля, оперированных в условиях спинальной и эпидуральной анестезии, отмечается умеренная иммунодепрессия клеточного звена иммунитета (снижение общего количества лимфоцитов о крови, СД3+, СД4+, СД8+, HLA-DR+ клеток) [4; 5]. В то же время у пациентов с хирургической патологией брюшной полости, оперированных в условиях ОА, выявляются статистически значимые различия по всем показателям иммунного статуса [1]. При спинальной анестезии максимальная иммунодепрессия отмечается во время оперативного вмешательства, но к 7-м суткам большинство исследуемых показателей даже превосходит исходные значения. Этого не наблюдается у пациентов, перенесших оперативное вмешательство в условиях общей анестезии. У данных больных тенденция к нормализации проявляется только в отношении Т-хелперов/индукторов, а по остальным показателям иммунодепрессия в послеоперационный период еще более усугубляется [2; 6-8].
Гуморальное звено иммунитета (IgA, IgG, IgM крови) более устойчиво к действию операционной травмы и анестезии. При этом снижение уровня иммуноглобулинов классов А и G наблюдается как при спинальной, так и при общем обезболивании, однако на 7-е сутки после СМА отмечается повышение содержания IgА, а после общего обезболивания оно не зарегистрировано [4].
Полученные нами результаты у пациентов ортопедического профиля (ТЭТС) во многом согласуются с результатами данных работ.
Как видно из представленных диаграмм, ОА характеризуется слабым иммунопротективным действием, что проявляется угнетением выработки Ig M, G, A. Применение ПСА сопровождается меньшим напряжением регуляторных систем, что способствует сбережению защитных ресурсов организма и развитию благоприятной стратегии адаптации. СЭА обладает наиболее выраженным стресс-протективным действием. Аналогичная картина наблюдается при исследовании клеточного звена: угнетение Т-лимфоцитов при ОА, незначительное снижение при ПСА и СЭА. При этом наблюдается незначительная стимуляция В-клеток.
Новым в исследовании было определение места ПСА. На наш взгляд, этот хорошо управляемый, эффективный метод интра- и послеоперационного обезболивания показал достаточно значимое, в сравнении с ОА, иммунопротективное действие.
Выводы
1. Применение общей анестезии при операциях тотального эндопротезирования тазобедренного сустава сопровождается преимущественно угнетением всех звеньев клеточного и гуморального иммунитета.
2. Применение продленной спинальной анестезии сопровождается меньшим напряжением регуляторных систем, что способствует сбережению защитных ресурсов организма и развитию благоприятной стратегии адаптации.
3. Комбинированная спинально-эпидуральная анестезия не угнетает гуморальный иммунитет, оказывая лишь умеренное депрессивное действие в отношении функциональной активности нейтрофильных фагоцитов.
4. С позиции влияния на клеточный и гуморальный иммунитет, методом выбора при тотальном эндопротезировании тазобедренного сустава является продленная спинально-эпидуральная анестезия.
Библиографическая ссылка
Хиновкер В.В., Красавина Е.Ю., Газенкампф А.А. ВЛИЯНИЕ РАЗЛИЧНЫХ МЕТОДОВ ОБЕЗБОЛИВАНИЯ ТОТАЛЬНОГО ЭНДОПРОТЕЗИРОВАНИЯ ТАЗОБЕДРЕННОГО СУСТАВА НА ИММУННУЮ СИСТЕМУ ПАЦИЕНТА // Современные проблемы науки и образования. – 2017. – № 5.;
URL: https://science-education.ru/ru/article/view?id=26941 (дата обращения: 27.06.2020).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
