Врожденный иммунитет и преждевременные роды
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Салахова Л.М.
1
Сарыева О.П.
1
Малышкина А.И.
1
Кулида Л.В.
1
1 ФГБУ «Ив НИИ М и Д им. В.Н. Городкова» Минздрава России
Проблема преждевременных родов остается одной из основных проблем современного акушерства. В статье представлены клинические аспекты и патоморфологические особенности плацент при невынашивании беременности поздних сроков. Исход беременности прослежен у 124 женщин. Проведено комплексное морфологическое исследование 37 последов, включающее органометрию, макроскопическое, гистологическое и иммуногистохимические исследования. Для уточнения роли врожденного иммунитета в развитии преждевременных родов изучены особенности экспрессии комплемент-ингибирующей молекулы – протектина CD59 – в структурных компонентах плаценты. Установлено статистически значимое снижение экспрессии при преждевременных родах как в клетках базальной пластинки, так и в ворсинчатом хорионе. Полученные данные позволяют уточнить роль врожденного иммунитета в развитии преждевременных родов.
преждевременные роды
врожденный иммунитет
плацента
иммуногистохимия
1. Зубжицкая, Л. Б. Иммуноморфологическое состояние плаценты при акушерской патологии / Л. Б. Зубжицкая, Н. Г. Кошелева, В. В. Семенов, под ред. Э.К. Айламазяна. – СПб.: Нордмедиздат, 2005. – 304 с.
2. Невынашивание беременности, инфекция, врожденный иммунитет / О. В. Макаров [и др.] – М.: ГЭОТАР-Медиа, 2007. – 176 с.
3. Одинцов, Ю. Н. Биологические функции комплемента / Ю. Н. Одинцов, В. М. Перельмутер // Бюллетень сибирской медицины. – 2007. – № 2. – С. 72–82.
4. Посисеева, Л. В., Сотникова Н.Ю. Иммунология беременности. Акушерство и гинекология 2007, № 5, С. 42-45.
5. Руководство по иммуногистохимической диагностике опухолей человека. / Под ред. Петрова С.В., Райхлина Н. Т. – Казань, 2004. – 456 с.
6. Сидельникова, В. М. Преждевременные роды. Недоношенный ребенок / В. М. Сидельникова, А. Г. Антонов. – М.: ГЭОТАР-Медиа, 2006. – 448 с.
7. Abrahams, V. M. Toll-like Receptors and their Role in the Trophoblast / V. M. Abrahams, G. Mor // Placenta. – 2005. – Vol. 26. – P. 540–547.
8. Caucheteux, S. M. At the innate frontiers between mother and fetus: linking abortion with complement activation / S. M. Caucheteux, C. Kanellopoulos-Langevin, D. M. Ojcius // Immunity. – 2003. – Vol. 18. – P. 169–172.
9. Early recognition of pregnancy by the maternal immune system / K. Kelemen [et al.] // Am. J. Reprod. Immunol. 1998. – Vol. 39. – P. 351–355.
10. Romero, R. Novel aspects of neutrophil biology in human pregnancy / R. Romero // Am. J. Reprod. Immunol. – 2005. – Vol. 53. – P. 275.
Одной из важнейших проблем современного акушерства остается проблема преждевременных родов [6]. В последнее время среди причин невынашивания беременности на первый план выступают иммунные нарушения в организме женщины и инфекции, передаваемые половым путем [1]. Очевидным становится тот факт, что нормальное осуществление репродуктивной функции возможно благодаря наличию уникальных иммунологических механизмов и гармоничному их функционированию [2, 7, 10]. В связи с этим, осложнения беременности необходимо рассматривать с точки зрения нарушения регулирующей роли иммунитета на разных этапах развития системы мать-плацента-плод. Зона контакта мать-плод строго контролируется иммунной системой, особенно системой врожденного иммунитета [4, 7]. Одним из основных факторов врожденного иммунитета является система комплемента, представляющая биохимический каскад реакций. Конечным продуктом последнего является цитолитический комплекс мембранной атаки (МАК). Центральный компонент этого протеолитического каскада – С3. Известно, что, урогенитальные инфекции влияют в первую очередь на общее состояние иммунной системы, а именно, способствуют возрастанию содержания циркулирующих иммунных комплексов (ЦИК) и уровня С3-компонента комплемента [9].
В настоящее время известны 3 пути активации комплемента: классический, альтернативный и лектиновый, которые регулируются мембранными и плазменными белками. Клетки плаценты на своей поверхности экспрессируют три комплемент-ингибирующие молекулы: мембранный кофакторный белок (МКБ, или MCP – membrane-assotiated cofactor of proteolysis, CD46), фактор, ускоряющий диссоциацию (ФУД, или DAF – decay accelerating factor, CD55) и протектин (CD59), которые блокируют формирование и функцию терминального МАК [3]. Дефицит этих белков приводит к отложению С3-компонента комплемента, притоку нейтрофилов и воспалению в плаценте. Поэтому для процессов репродукции большое значение имеют механизмы регуляции системы комплемента, поскольку неконтролируемая активация комплемента вызывает некроз клеток плаценты и потерю плода [8].
Цель исследования: изучение клинических аспектов и патоморфологии плацент, в том числе особенностей экспрессии CD59, при невынашивании беременности поздних сроков.
Материал и методы. Исход беременности прослежен у 124 беременных женщин. Основную группу (1 группа) составили 86 беременных женщин с клиническими признаками угрозы невынашивания беременности в сроке 22-33 недели, которые были поделены на 2 подгруппы: 1 составили женщины, беременность которых завершилась своевременными родами (n=52), 2 – преждевременными (n=34). В группу контроля (2 группа) вошли 38 практически здоровых беременных женщин без клинических признаков угрозы невынашивания, беременность которых завершилась своевременными родами. Морфологическими методами исследовано 37 плацент (25 в 1 и 12 во 2 группе). Комплексное морфологическое исследование включало визуальный осмотр, органометрию, обзорную гистологию. Экспрессию CD59 в плацентарной ткани определяли иммуногистохимическим методом. Иммуногистохимическая реакция проводилась по стандартной методике на парафиновых срезах [5]. В качестве первичных антител использовали кроличьи поликлональные антитела к CD59 класса IgG в рабочем разведении 1:200 («Santa Cruz Biotechnology»). Для проведения негативного контроля первичные антитела замещали 1% раствором бычьего сывороточного альбумина с исключением вторичных антител. Результаты иммуногистохимической реакции оценивали в 10 полях зрения микроскопа, содержащих не менее 100 клеток, при увеличении х400. Индекс экспрессии (ИЭ) высчитывался по формуле: ИЭ = Σ Р(i) · i/100,
где i – интенсивность окрашивания в баллах (от 0 до 3-х);
Р(i) – процент клеток, окрашенных с разной интенсивностью.
Статистическая обработка полученных результатов проводилась с использованием программ Microsoft Excel 2007, Statistica 6.0. Проверка рядов данных на нормальность распределения осуществлялась с помощью критериев Колмогорова и Манна-Уитни. Достоверность различий между показателями независимых выборок оценивалась по критерию Манна-Уитни. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты исследования и их обсуждение
Средний возраст женщин в сравниваемых группах не имел достоверных отличий и составил 26,47±0,71 года в контрольной группе и 27,13±0,62 в основной (р>0,05). Обращал на себя внимание отягощенный гинекологический анамнез у женщин основной группы. Воспалительные процессы гениталий (кольпит, аднексит, эндометрит) отмечены практически у каждой второй пациентки основной группы (44,2%), тогда как в контрольной группе были выявлены у 15,8% (p<0,001). У беременных основной группы в анамнезе достоверно чаще встречалось первичное бесплодие – 4,65%, тогда как у пациенток контрольной группы данной патологии выявлено не было (p=0,04). При оценке репродуктивной функции выявлено, что повторнобеременными первородящими в основной группе явились 12 (14%) пациенток, что достоверно выше, чем в группе контроля (2,6%; р=0,01). В основной группе своевременные роды в анамнезе были у 37 (43%) женщин, преждевременные роды – у 16 (18,6%), что достоверно выше, чем в группе контроля (2,6%; р=0,001). Самопроизвольные выкидыши в анамнезе отмечены только у женщин основной группы (15,1%, р=0,001). Медицинские аборты у женщин 1 группы также отмечены достоверно чаще, чем в контрольной (37,2% против 10,5%; р=0,001); при этом 2 и более аборта имели 18 (21%) женщин основной группы. Пациентки основной группы достоверно чаще имели в анамнезе заболевания ЛОР-органов (24,4% против 7,9%; р=0,01), хронический бронхит (16,3% против 2,6%; р=0,01) и хронический пиелонефрит (23,3% против 7,9%; р=0,02) по сравнению с контролем. Обращала на себя внимание высокая частота ОРЗ в первом триместре у женщин основной группы по сравнению с контрольной (26,7% против 10,5%; р=0,02). Беременность у женщин с угрозой прерывания протекала чаще на фоне анемии (22,1% против 7,9%; р=0,03).
Женщины в сравниваемых группах были обследованы на наличие урогенитальной инфекции методом ИФА. Установлено, что пациентки с угрозой прерывания беременности имели более высокий уровень инфицированности с преобладанием бактериального инфицирования (59,3% против 36,8%; р=0,02) по сравнению с группой контроля. Частота выявления активной инфекции Chlamidia trachomatis и Ureaplasma urealiticum у женщин основной группы была достоверно выше по сравнению с контрольной группой (29,1% против 13,6%; р=0,03 и 27,9% против 13,6%; р=0,05 соответственно). При исследовании инфекционных маркеров достоверных отличий между двумя подгруппами выявлено не было. Остается неясным, почему одни те же инфекционные агенты в одних случаях привели к прерыванию беременности, а в других – нет.
Последы, полученные от женщин основной группы имели ряд морфологических отличий от группы контроля. Плаценты аномальной формы достоверно чаще встречались в основной группе: (53% против 8%; р=0,02). Только в 1 группе встретились последы треугольной (13%), каплевидной форм (13%) и двудолевая плацента (7%). Более половины плацент основной группы имели аномалию формообразования последа в виде ободка или валика (53%). Достоверно большее количество последов основной группы имело эксцентричное прикрепление пупочного канатика (53% против 16%; р=0,04). Пуповинный остаток большинства плацент 1 группы умеренно извит (80%), у части – с отеком вартонова студня (47%), ложными узлами и извитым ходом сосудов в них (47%). Средние органометрические параметры плацент, такие как масса и площадь материнской поверхности не имели достоверных отличий от группы контроля, хотя и имели тенденцию к снижению (масса 292,2[200,0–389,0] г и 482,8[426,5-537,5]; площадь 195,9[156,0–246,0] и 285,9[220-337] см2 в 1 и 2 группах соответственно). Последнее вероятно связано с меньшим сроком гестации, при котором были получены плаценты.
На плодовой поверхности плацент, так же как и в контрольной группе, преобладали рассыпной и промежуточный типы ветвления сосудов (40% и 27% соответственно). Однако в трети плацент имел место магистральный тип ветвления сосудов (33%). Магистральный тип кровоснабжения плаценты отличается не только неравномерным, асимметричным распределением сосудов, но и отсутствием анастомозов между ними. Для таких плацент типична гиповаскуляризация краевых зон. Более трети плацент (40%) имели на плодовой поверхности патологические очаги (субамнимальные гематомы, белесоватые плотные очаги), однако достоверных отличий от группы контроля не выявлено (р=0,42). На материнской поверхности плацент в отличие от группы контроля достоверно чаще отмечены сгустки крови размерами от 4х1 см до 7х3 см (р=0,003). При этом в части плацент (21%) сгустки были плотно спаяны с подлежащим ворсинчатым хорионом, что свидетельствует о наличии преждевременной отслойки плаценты.
При гистологическом исследовании более половины плацент, также как и в контрольной группе, структура ворсинчатого хориона соответствовала сроку гестации. Однако в 7 плацентах (47%) диагностированы различные нарушения созревания ворсинчатого хориона (увеличение количества промежуточных незрелых ворсин, варианты промежуточных дифференцированных ворсин и диссоциированного развития ворсин в котиледонах, а также нарушение дифференцировки магистральных сосудов стволовых ворсин), что достоверно чаще чем в группе сравнения (р=0,02).
Воспаление вирусной или вирусно-бактериальной этиологии диагностировано в большинстве последов (80%), что в 5 раз чаще, чем в контрольной группе. При этом распространение инфекции осуществлялось преимущественно гематогенным путем. Достоверно чаще в плацентах данной подгруппы диагностирован базальный (p=0,0003) и париетальный децидуит (p=0,0004). Клеточный состав воспалительного инфильтрата представлен в большинстве случаев (80%) мононуклеарными элементами (лимфоциты, гистиоциты, плазмоциты), в остальных случаях – смесью мононуклеарных элементов с нейтрофильными лейкоцитами. В половине плацент отмечена картина пролиферативного виллузита с преобладанием пролиферации клеточных элементов и инфильтрацией стромы лимфоцитами и макрофагами (p=0,001). Во всех случаях виллузит завершился вторичным склерозом стромы ворсин с исходом во вторичную гиповаскуляризацию ворсинчатого хориона (p=0,01). Признаки восходящего бактериального инфицирования на фоне гематогенного обнаружены у 6 женщин (40%). В их последах выявлен диффузный экссудативный внеплацентарный амниохориодецидуит, плацентарный амниохорионит, субхориальный интервиллезит, сосудисто-стромальный фуникулит (p=0,05).
В плацентах данной подгруппы достоверно чаще диагностированы острые нарушения маточно-плацентарного кровообращения в виде расслаивающих кровоизлияний в базальную децидуальную оболочку и острой отслойки плаценты (p=0,02). В зоне отслойки базальная пластинка либо отсутствует, либо разобщена и фрагментирована. Отслойка плаценты сочеталась с незавершенной гестационной перестройкой спиральных артерий. Стенки сосудов неравномерной толщины с прерывистым слоем фибриноида и сохранившимися фрагментами мышечно-эластических структур. Кроме перечисленных нарушений кровообращения в межворсинчатом пространстве центральных и субхориальных отделов в трети случаев встречался распространенный стаз-тромбоз.
Хронические расстройства кровообращения в виде ишемических инфарктов и хронических геморрагических инфарктов не имели достоверных отличий от группы контроля (p=0,12 и p=0,23 соответственно). Однако количество и площадь афункциональных зон в плацентах данной подгруппы достоверно выше контрольной группы (p=0,01).
Адаптивно-компенсаторные процессы, в отличие от группы контроля, были менее выражены и носили очаговый характер; представлены в основной массе плацент гиперплазией синцитиальных почек и гиперемией промежуточных и терминальных ворсин (по 40%), а также гиперплазией терминальных ворсин (33%). Только в 2 плацентах отмечена гиперплазия капилляров терминальных ворсин, что достоверно реже, чем в контрольной группе (p=0,05).
В структуре плацентарной недостаточности, в отличие от контрольной группы, преобладала хроническая субкомпенсированная плацентарная недостаточность (80%; p=0,0004). Морфологическим субстратом последней явились воспаление и расстройства кровообращения на фоне менее выраженных очаговых адаптивно-компенсаторных процессов. Кроме этого, достоверно чаще констатирована острая плацентарная недостаточность (6 случаев, 40%), обусловленная преждевременной отслойкой нормально расположенной плаценты (p=0,05).
При иммуногистохимическом исследовании в плацентах позитивная реакция с CD59 выявлена в цитотрофобласте, децидуальных клетках базальной децидуальной оболочки и синцитиотрофобласте ворсин. Индекс экспрессии в группе контроля составил 2,02 [1,8-2,2] условные единицы (у.е.) в клетках цитотрофобласта, 1,97 [1,8-2,2] у.е. в децидуальных клетках базальной пластинки и 2,37 [2,2-2,6] у.е. в синцитиотрофобласте ворсин.
Экспрессия CD59 в плацентах при преждевременных родах отличалась от таковой группы контроля меньшей интенсивностью иммуногистохимического окрашивания цитоплазмы децидуальных клеток, цитотрофобласта и синцитиотрофобласта ворсин. Индекс экспрессии CD59 достоверно уменьшился по сравнению с аналогичными показателями контрольной группы во всех вышеуказанных структурах (1,113[1,0-1,2] у.е. в цитотрофобласте; 1,058[0,9-1,2] у.е. в децидуальных клетках; 0,993[0,9-1,0] у.е. в синцитиотрофобласте ворсин).
Заключение. Таким образом, у женщин с невынашиванием беременности в сроке 22-33 недели достоверно чаще отягощен акушерско-гинекологический анамнез; значимо чаще отмечены заболевания ЛОР-органов и хронический пиелонефрит; выявлено повышение частоты встречаемости маркеров урогенитальных инфекций. Установлено достоверное снижение экспрессии комплемент-ингибирующей молекулы CD59 в базальной пластинке и ворсинчатом хорионе плацент. При этом, у женщин основной подгруппы, беременность которых завершилась преждевременно, уровень CD59 был достоверно ниже, чем у женщин основной подгруппы, родивших в срок. Вероятно, снижение экспрессии комплемент-ингибирующих молекул при угрозе невынашивания беременности поздних сроков приводит к дополнительной активации иммунного ответа материнского организма и служит возможным предиктором развития преждевременных родов.
Рецензенты:
Панова И.А., д.м.н., зав. отдела акушерства и гинекологии ФГБУ «Ивановский научно-исследовательский институт материнства и детства имени В.Н. Городкова» Министерства здравоохранения Российской Федерации, г.Иваново.
Перетятко Л.П., д.м.н., профессор, зав. лабораторией патоморфологии и электронной микроскопии ФГБУ «Ивановский научно-исследовательский институт материнства и детства имени В.Н. Городкова» Министерства здравоохранения Российской Федерации, г.Иваново.
Библиографическая ссылка
Салахова Л.М., Сарыева О.П., Малышкина А.И., Кулида Л.В. РОЛЬ ВРОЖДЕННОГО ИММУНИТЕТА В РАЗВИТИИ ПРЕЖДЕВРЕМЕННЫХ РОДОВ – КЛИНИЧЕСКИЕ И ПАТОМОРФОЛОГИЧЕСКИЕ АСПЕКТЫ // Современные проблемы науки и образования. – 2014. – № 6.;
URL: https://science-education.ru/ru/article/view?id=16452 (дата обращения: 07.08.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Цель исследования. Разработка тест-системы прогноза реализации преждевременных родов (ПР), основанной на профиле экспрессии генов в клетках соскоба из цервикального канала у беременных с угрожающими ПР.
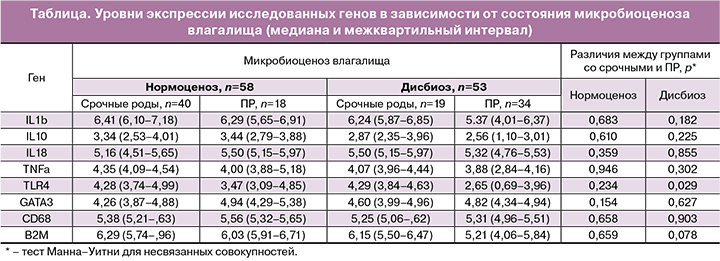
Материал и методы. Обследованы 125 женщин в возрасте от 19 до 40 лет с угрожающими ПР до развития регулярной родовой деятельности. Группу 1 составили 46 беременных, родивших в сроках от 22 до 36 недель в течение 7 дней после проведения обследования. Группу 2 – 79 случаев угрожающих ПР с последующим родоразрешением в доношенном сроке беременности. У всех пациенток проанализирована структура микробиоценоза влагалища методом фемофлор и определение соотношений уровней мРНК генов TLR4, CD68, TNF, GATA3, IL1b, IL10, IL18, TNFa, TLR4, B2M в цервикальном канале методом ПЦР в режиме реального режиме времени с обратной транскрипцией. Полученные результаты были проанализированы с применением бинарной логистической регрессии.
Результаты. Выявлено достоверное снижение уровня экспрессии мРНК гена TLR4 (p
Проблема преждевременных родов (ПР) в современном акушерстве продолжает оставаться актуальной и нерешенной [1–3]. Это обусловлено тем, что ПР остаются ведущей причиной неблагоприятных перинатальных исходов [4]. Несмотря на многочисленные научные и практические исследования в этой области, частота ПР не снижается, а в некоторых странах даже растет [5]. По современным представлениям одной из причин развития ПР инфекционного генеза являются ограниченные возможности иммунной системы беременной к своевременному распознаванию и уничтожению этиологического агента инфекции. Проникновение инфекционных факторов может стать пусковым механизмом развития системного воспалительного ответа (ССВО), при котором локальное повреждение тканей в зоне инокуляции инфекционных патогенных факторов вызывает совокупность системных реакций, одной из которых является дисфункция врожденного и приобретенного иммунного ответа [6, 7]. ССВО определяют как неспецифический системный ответ организма на инфекционные агенты и иммунодефициты. Признаком системного иммунного ответа является изменение соотношения цитокинов в периферической крови. Система цитокинов играет важную роль в течение всей беременности, регулируя процессы инвазии трофобласта, межклеточные взаимоотношения в эндометрии, воспалительные реакции [8]. Нарушение соотношения про и противовоспалительных цитокинов является главной особенностью патогенеза ССВО [9, 10]. Вместе с тем немаловажным в развитии воспалительного ответа имеет взаимосвязь микробиоценоза влагалища, локального и врожденного иммунитета, изучение которых поможет уточнить молекулярно-биологические аспекты патогенеза ПР, и позволит прогнозировать развитие патологических процессов с разработкой системы профилактических мероприятий для улучшения перинатальных исходов.
Цель исследования: разработка тест-системы для прогноза реализации ПР, основанной на профиле экспрессии генов в клетках соскоба из цервикального канала у беременных с угрожающими ПР.
Материал и методы исследования
Обследованы 125 женщин в возрасте от 18 до 40 лет с угрожающими ПР до развития регулярной родовой деятельности.
Критериями включения послужили: одноплодная беременность, угрожающие ПР на сроке гестации с 22 до 36 недель 6 дней, отсутствие регулярной родовой деятельности.
Критериями исключения были: тяжелая экстрагенитальная патология, истмико-цервикальная недостаточность, преждевременное излитие околоплодных вод, многоплодная беременность, пороки развития плода.
Группу 1 составили 46 беременных, родившие в сроках от 22 до 36 недель в течение 7 дней после проведения неинвазивного прогностического теста. Группу 2 – 79 случаев угрожающих ПР с последующим родоразрешением в доношенном сроке беременности.
Взятие биоматериала осуществлялось цитощеткой раздельно из цервикального канала и влагалища. Во избежание деградации мРНК материал помещают в пластиковую пробирку, содержащую 500 мкл среды для стабилизации РНК (лизирующий раствор из комплекта реагентов для выделения ПРОБА-НК (ООО «НПО ДНК-Технология», Россия)).

Всем пациенткам было проведено исследование структуры микробиоценоза влага…
1. Кулаков В.И., Серов В.Н., Сидельникова В.М. Преждевременные роды – тактика ведения с учетом срока гестации. Журнал акушерства и женских болезней. 2002; 51(2): 13-7.
2. Савельева Г.М., Шалина Р.И., Курцер М.А., Клименко П.А., Сичинава Л.Г., Панина О.Б., Плеханова Е.Р., Выхристюк Ю.В., Лебедев Е.В. Преждевременные роды как важнейшая проблема современного акушерства. Акушерство и гинекология. 2012; 8-2: 4-10.
3. Серов В.Н., Сухорукова О.И. Эффективность профилактики преждевременных родов. Акушерство и гинекология. 2013; 3: 48-53.
4. Goldenberg R.L., Culhane J.F., Iams J.D., Romero R. Epidemiology and causes of preterm birth. Lancet. 2008; 371(9606): 75-84.
5. Макаров О.В., Бахарева И.А., Ганковская Л.В., Романовская В.В. Молекулярные механизмы инфекционного невынашивания беременности. Российский медицинский журнал. 2009; 2: 24-8.
6. Romero R., Miranda J., Chaemsaithong P., Chaiworapongsa T., Kusanovic J.P., Dong Z. et al. Sterile and microbial-associated intra-amniotic inflammation in preterm prelabor rupture of membranes. J. Matern. Fetal Neonatal Med. 2015; 28(12): 1394-409.
7. Maayan-Metzger A., Barzilai A., Keller N., Kuint J. Are the «good old» antibiotics still appropriate for early-onset neonatal sepsis? A 10 year survey. J. Isr. Med. Assoc. 2009; 11(3): 138-42.
8. Romero R., Miranda J., Chaiworapongsa T., Korzeniewski S.J., Chaemsaithong P., Gotsch F. et al. Prevalence and clinical significance of sterile intra-amniotic inflammation in patients with preterm labor and intact membranes. J. Reprod. Immunol. 2014; 72(5): 458-74.
9. Murtha A.P., Edwards J.M. The role of Mycoplasma and Ureaplasma in adverse pregnancy outcomes. J. Obstet. Gynecol. Clin. North Am. 2014; 41(4): 615-27.
10. Yılmaz Y., Verdi H., Taneri A., Yazıcı A.C., Ecevit A.N., Karakaş N.M. et al. Maternal-fetal proinflammatory cytokine gene polymorphism and preterm birth. DNA Cell Biol. 2012; 31(1): 92-7.
11. Wu W., Clark E.A., Stoddard G.J., Watkins W.S., Esplin M.S., Manuck T.A. et al. Effect of interleukin-6 polymorphism on risk of preterm birth within population strata: a meta-analysis. BMC Genet. 2013; 14: 30.
12. Cohen A., Skornick-Rapaport A., Cohen Y., Mandel D., Rimon E. The influence of prolonged preterm premature rupture of the membranes on neonatal outcome of the presenting and non-presenting twin. J. Obstet. Gynecol. Reprod. Biol. 2014; 181: 28-31.
13. Pawelczyk E., Nowicki B.J., Izban M.G., Pratap S., Sashti N.A., Sanderson M., Nowicki S. Spontaneous preterm labor is associated with an increase in the proinflammatory signal transducer TLR4 receptor on maternal blood monocytes. BMC Pregnancy Childbirth. 2010; 10: 66.
Поступила 17.03.2016
Принята в печать 25.03.2016
Тютюнник Виктор Леонидович, д.м.н., зав. акушерским физиологическим отделением ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-09-88. E-mail: tioutiounnik@mail.ru
Курчакова Татьяна Александровна, аспирант ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-09-88. E-mail: t_Kurchakova@oparina4.ru
Кан Наталья Енкыновна, д.м.н., заве. акушерским обсервационным отделением ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (926) 220-86-55. E-mail: kan-med@mail.ru
Непша Оксана Сергеевна, научный сотрудник лаборатории молекулярно-генетических методов ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-22-92. E-mail: o_nepsha@oparina4.ru
Донников Андрей Евгеньевич, к.м.н., в.н.с. лаборатории молекулярно-генетических методов ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-09-88. E-mail: a_donnikov@oparina4.ru
Меджидова Маржанат Капуровна, к.м.н., докторант ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Адрес: 117997, Россия, Москва, ул. Академика Опарина, д. 4. Телефон: 8 (495) 438-09-88. E-mail: marzana-m@yandex.ru
Кокоева Диана Николаевна, аспирант ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России. Адрес: 119991, Россия, Москва, ул. Трубецкая, д. 8, стр. 2. Телефон: 8 (495) 438-09-88. E-mail: dikokoeva@mail.ru
Для цитирования: Тютюнник В.Л., Курчакова Т.А., Кан Н.Е., Непша О.С., Донников А.Е., Меджидова М.К., Кокоева Д.Н. Локальные факторы врожденного иммунитета в прогнозировании преждевременных родов. Акушерство и гинекология. 2016; 10: 59-63.
https://dx.doi.org/10.18565/aig.2016.10.59-63
Источник
