Cd95 в иммунитете что это
Изучение перфоринзависимого пути в осуществлении цитотоксичности (наряду с бесспорным доказательством его очень важной роли в лизисе мишеней) привело к накоплению фактов, из которых следовало, что лизис может осуществляться и в отсутствие перфорина.
Основные из них следующие:
1. Аллогенные лимфоциты перитонеального экссудата содержат цитотоксические гранулы, имеют очень низкий или неопределяемый уровень гранулярных компонентов, но способны проявлять высокий уровень цитотоксичности, который превышает таковой цитотоксических лимфоцитов (ЦТЛ) с выраженным содержанием гранул.
2. Получено много доказательств того, что лизис мишеней перфориндефицитными лимфоцитами также возможен.
3. ЦТЛ способны эффективно лизировать мишени и в тех случаях, когда они не содержат ни перфорина, ни гранзимов.
В итоге уже к началу 1990-х годов были получены неоспоримые доказательства существования альтернативного пути клеточной цитотоксичности и, в частности, наличия системы Fas/FasL — CD95L/CD95, с участием которой происходит запрограммированная клеточная смерть — апоптоз. Сегодня хорошо известно, что эта система наряду с перфорин-гранзимзависимой является основной в индукции клеточной смерти.
Система Fas/FasL
Fas-рецептор (молекулярная масса 36 кД) относится к семейству рецепторов TNF (мембранный белок I типа), куда входят и многие другие известные рецепторы (TNFR1, TNFR2, рецептор лимфотоксина, CD27, DR4, DR5, DR6 и др.), состоит из 319 аминокислотных остатков и экспрессируется клетками многих типов. Экспрессия Fas-рецептора злокачественно трансформированными клетками во всех случаях является обязательным условием Fas/FasL-обусловленного апоптоза.
FasL — мономер с молекулярной массой 46 кД; в мембране содержится в форме ди- и трехмеров (соответственно 45 и 105 кД), по сравнению с Fas экспрессируется на более ограниченном количестве клеток, преимущественно активированных ЦТЛ и ЕК, и может находиться в двух формах: нерастворимой — мембранно-связанной (mFasL) и растворимой (sFasL).
В отличие от FasL Fas-рецептор экспрессируется постоянно с колебаниями уровня его экспрессии на различных, в частности гемопоэтических клетках; в качестве стимулов, усиливающих экспрессию Fas, могут быть: стресс, различные инфекции, злокачественно трансформированные клетки, а также многие экзогенные и эндогенные воздействия.
Система Fas/FasL играет ключевую роль в физиологических и многих патологических состояниях, и эта роль проявляется в широком диапазоне — от поддержания нормального гомеостаза до участия в ускользании опухоли из-под иммунологического контроля.
Активированные цитотоксические лимфоциты отличаются от СD4+Т-лимфоцитов по чувствительности к Fas-зависимому апоптозу — ЦТЛ проявляют меньшую чувствительность, поскольку экспрессия FasL на них выражена слабее, так же, как и экспрессия TNFR1.
На злокачественно трансформированных клетках FasL впервые выявлен при лимфопролиферативных заболеваниях. Однако к настоящему времени имеется много доказательств того, что FasL экспрессируют и клетки различных солидных опухолей: карциномы молочной железы, толстого кишечника, легкого, яичника, меланомы, астроцитомы, базилиомы кожи и др.
В результате взаимодействия Fas/FasL происходит тримеризация Fas-рецептора и образование особого комплекса — DISC (death inducing signaling complex). Олигомеризация Fas обеспечивается наличием в его структуре так называемого домена смерти. Аналогичный домен находится и во внутриклеточном адапторном белке — FADD (Fas-associated death domen), который активирует зимогенную форму каспазы.
Обязательным компонентом комплекса DISC является каспаза-8 или каспаза-10 (индукторы), которые активируются вслед за активацией Fas-рецептора; субстратом для их индукции служат эффекторные каспазы — 3, 6, 7.
Ключевым молекулярным механизмом запрограммированной клеточной смерти с участием системы Fas/FasL является фрагментация ДНК — процесс, который происходит на уровне ядра с образованием мелких и крупных фрагментов. Фрагментации ДНК предшествуют появление мембранных пузырьков, конденсация ядра клетки и образование апоптотических телец; фрагментация хроматина, сопровождающая фрагментацию ДНК, делает этот процесс необратимым.
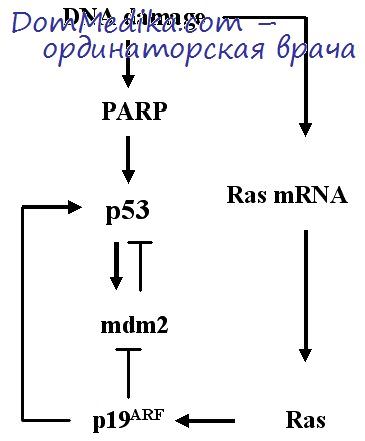
Из приведенных данных следует, что в механизме клеточной смерти с участием системы Fas/FasL центральная роль принадлежит активации каспаз, что способствует разрушению многих клеточных белков, ответственных за регуляцию клеточного цикла (RB, MDM2), повреждению ДНК (DNK-RK, р53, DARP), нарушению регуляции клеточной структуры (актин и ламинины).
Все эти функциональные и структурные изменения приводят к апоптозу, и дифференцированная оценка значимости отдельных его участников требует разработки соответствующих моделей. Последнее будет способствовать более полному пониманию патогенеза рака и обоснованию новых подходов его лечения.
Схема Fas/FasL-зависимого апоптоза с участием ЦТЛ и общие молекулярные механизмы апоптоза представлены на рис. 17, 18.

Рис. 17. Схема Fas/FasL-индуцированного апоптоза, осуществляемого цитотоксическими лимфоцитами

Рис. 18. Молекулярные механизмы Fas/FasL-зависимого апоптоза
Давая общую оценку роли систем Fas/FaL и перфорин-гранзим, следует акцентировать внимание на том, что именно взаимодействие между ними играет важную роль при подходах к иммунотерапевтическим воздействиям.
В настоящее время это четко показано на моделях с аутоиммунными заболеваниями, трансплантацией и различными инфекциями. Нарушение баланса между упомянутыми системами может быть причиной увеличения чувствительности к вирусным инфекциям и/или снижения уровня лизиса опухолевых клеток.
Несмотря на то что системе Fas/FasL принадлежит очень важная роль как в лизисе опухолевых клеток, так и в поддержании иммунологического гомеостаза, эта система может быть и причиной ухода опухоли из-под иммунологического контроля (детально этот вопрос рассмотрен ниже).
Как уже отмечалось, экспрессия Fas-антигена опухолевыми клетками и его взаимодействие с FasL на ЦТЛ являются классическим вариантом механизма лизиса опухолевых клеток. Однако представляется важным, что опухолевые клетки могут экспрессировать не только Fas, но и FasL, а ЦТЛ — не только FasL, но и Fas-антиген.
Деструкция цитотоксических лимфоцитов
При таких условиях возможна гибель цитотоксических лимфоцитов по различным причинам. Сказанное иллюстрируют опыты с использованием ЦТЛ перитонеальной полости, которые in vivo премировались сингенными или аллогенными опухолевыми клетками, а затем изучались в различных модельных системах (преинкубация Fas— и Fas+-опухолевых клеток с ЦТЛ, совместное культивирование указанных клеток в различных сочетаниях).
В результате в одних условиях опыта наблюдалась деструкция цитотоксических лимфоцитов, а в других — ослабление их цитотоксичности. В итоге авторы получили доказательства возможности ускользания опухоли из-под иммунологического контроля вследствие прямой контратаки ЦТЛ опухолевыми клетками и FasL-обусловленной смерти ЦТЛ при их возможном взаимодействии с цитотоксическими лимфоцитами, экспрессирующими Fas; авторы предполагают, что этот механизм может иметь место in vivo.
Яркой иллюстрацией того, что экспрессия FasL опухолевыми клетками может служить серьезной причиной для иммунологической привилегии опухоли, является взаимодействие опухолевых клеток и лимфоцитов, инфильтрирующих меланому. Показано, что большое число опухолевых клеток меланомы больных экспрессировали FasL и обладали способностью уничтожать ЦТЛ, инфильтрирующих меланому, которые в большинстве случаев располагались вблизи FasL+-клеток меланомы; инъекция FasL+-клеток меланомы мышам приводила к быстрому появлению и развитию опухоли.
Очень убедительно предположение авторов о том, что экспрессия FasL опухолевыми клетками может быть особенностью, способствующей их ускользанию из-под иммунологического контроля. Нельзя не отметить, что такой взгляд на экспрессию FasL клетками меланомы сталкивается с определенными возражениями в работе, авторы которой не обнаружили экспрессию мРНК FasL-клетками различных линий меланомы.
Причина смерти ЦТЛ может быть связана и с другими обстоятельствами. Например, активация покоящихся Т-клеток антигеном, как известно, способствует их дифференцировке. Однако чрезмерная плотность антигена приводит к TCR-индуцированному истощению эффекторных клеток — процессу, названному антигениндуцированной клеточной смертью (AglCD — antigen induced cell death).
Стало известно, что такую смерть могут индуцировать два основные механизма: экзоцитоз гранул с выделением перфорина и гранзимов и Fas/FasL-обусловленный апоптоз. В опытах на мышах, имеющих мутации или дефекты в генах, контролирующих какой-либо компонент обоих путей указанной клеточной смерти, установлено следующее. TCR-индуцированный апоптоз в отсутствие Fas и/или FasL (но не перфоринов или гранзимов) только снижается; блокада антителами FasL приводила к ингибиции ранней Т-клеточной смерти, а ингибиция Fas, FasL и TNFa была необходимой для предотвращения поздней клеточной смерти.
Поскольку антитела к IFNy во всех случаях ингибировали клеточную смерть, было сделано заключение, что независимо от механизма клеточной смерти ее контроль регулируется IFNy.
Уже с первых доказательств существования альтернативного Fas/FasL пути клеточной смерти и по настоящее время не прекращаются дискуссии, касающиеся оценки степени значимости выявленных двух основных путей лизиса опухолевых клеток: одни исследователи определяют перфоринзависимый путь как основной, другие — основным считают Fas/FasL-опосредованный механизм.
Обосновывая свою точку зрения, D. Kagi и соавт. полагают, что основная функция системы Fas/FasL состоит в регуляции иммунологического ответа, в частности во влиянии на пролиферацию и дифференцировку лимфоцитов, дифференцировку ДК и снижение уровня некоторых эффекторных механизмов защиты.
Существенным аргументом в пользу ведущей роли перфорин-гранзимного пути цитотоксичности является получение первых доказательств того, что с возрастом снижается уровень перфорина и гранзимов в лимфоцитах человека параллельно с известным фактом возрастного снижения цитотоксичности цитотоксических лимфоцитов.
Определенное сближение различных взглядов на ведущий механизм цитотоксичности становится возможным благодаря данным, согласно которым существуют определенные различия в степени участия отдельных цитотоксических механизмов на ранних и поздних этапах опухолевого процесса.
Такой взгляд на роль цитотоксических механизмов позволяет предполагать участие каждого из них. При этом большое значение имеют особенности моделей опухолевого процесса (вирусиндуцированные, канцерогениндуцированные и др.).
Подтверждением могут служить опыты с внутрибрюшинным введением Fas— и Fas+-oпухолевых клеток, которые показали, что уже в течение первых 4ч происходит лизис Fas+-опухолевых клеток. Однако, по мнению авторов, при таком быстром лизисе разрушаются не все опухолевые клетки.
Весьма сходные факты, а также их трактовку, дают и другие авторы. В частности, при исследовании перфориндефицитных мышей с карциномой легкого Lewis (3LL) были получены активно- и слабометастазируюшие клоны опухолевых клеток.
Клетки обоих клонов экспрессировали мембранно-связанный CD95 in vitro, однако экспрессия in vivo была выше. По мере роста опухоли отмечалось постепенное ослабление экспрессии CD95 опухолевыми клетками, что авторы рассматривали как условие ускользания их от иммунологического надзора.
Обобщив многочисленные факты, полученные в настоящей работе, авторы пришли к важному выводу: роль Fas/FasL-зависимого механизма в повреждении опухоли очень существенна на ранних этапах ее развития, а данные, полученные в системе in vivo и in vitro, не имеют полной аналогии.
Понимание значения роли перфоринзависимого и Fas/FasL-обусловленного лизиса клеток дополняют и результаты изучения характера цитотоксичности наивных и премированных интерстициальных внутриэпителиальных ЦТЛ. Показано, что наивные СD8+Т-лимфоциты используют Fas/FasL-зависимый механизм, в то время как премированные — перфоринзависимый.
Изучение условий реализации различных механизмов лизиса, осуществляемого ЦТЛ, позволяет выявлять и факты, которые ему препятствуют. Так, следует отметить следующий интересный факт. Известно, что экспрессия Вс1-2 защищает клетки от апоптоза, однако в опытах с мастоцитомой Р815 получены несколько неожиданные факты.
Выяснилось, что при лизисе, осуществляемом цитотоксическими лимфоцитами, экспрессия Вс1-2 защищает клетки от Fas-опосредованного, но не перфоринзависимого лизиса. В настоящее время известны соединения, которые дифференцированно ингибируют различные пути киллинга ЦТЛ, что существенно для изучения роли того или иного механизма лизиса ЦТЛ. Так, получен ингибитор Fas-зависимого пути в цитотоксических лимфоцитах цитотоксичности.
Очевидно, что определенная ясность в вопрос о значимости того или иного пути клеточной смерти может быть внесена при дальнейшем усовершенствовании методов исследования. Например, в последнее время на основе метода проточной цитометрии разработан новый метод — flow cytometric cytotoxicity, который позволит дать дифференцированную оценку степени каждого механизма цитолиза.
Бережная Н.М., Чехун В.Ф.
Опубликовал Константин Моканов
Подобно TNF-лиганду, СD95-лиганд может освобождаться с клеточной поверхностью и быть физиологически активным в растворенной форме.
Антиген CD95 экспрессирован у человека на кортикальных тимоцитах, активированных Т- и В-клетках, покоящихся лимфоцитах, моноцитах и нейтрофилах. Антиген CD95 экспрессирован как на CD4+, так и на CD8+ субпопуляциях лимфоцитов человека. На нормальных лимфоцитах взрослых людей экспрессия CD95-aнтигена регулируется ИЛ-2, у-интерфероном или суперантигенами. Экспрессия антигена повышается при активации Т-клегок моноклональными антителами (МКА) против СD3-антигена.
СD95-ангиген обнаружен также на клетках лимфатических узлов. Клетки зародышевых центров лимфатических узлов сильно экспрессируют его. Эти клетки высокочувствительны к CD95-опосредованиому апоптозу. В-клетки мантийной зоны, напротив,слабо экспрессируют СD95-антиген, устойчивы к С095-опосредованному апоптозу. СD95-антиген сильно экспрессирован на Т-лимфоцитах, выделенных из смывов легких здоровых людей и больных саркоидозом. Такие Т-клетки более чувствительны к апоптозу, чем Т-лимфоциты периферической крови.
Нейтрофилы экспрессируют относительно низкий уровень СD95-антигена по сравнению с другими клетками.
Вне иммунной системы CD95 определен в нормальных человеческих клетках различных типов, включая диплоидные фибробласты, гепатоциты, кератиноциты, эпителий и мезенхиальные клетки некоторых типов.
Уровень СD95-антигена на лимфоцитах периферической крови зависит от возраста. У новорожденных он экспрессирован очень слабо. У старших детей и здоровых взрослых людей продемонстрировано повышение экспрессии антигена, которое затем прогрессивно увеличивается с возрастом. Аналогичным образом с возрастом изменяется восприимчивость клеток к CD95-опосредованному апоптозу.
В клетках различных типов происходит спонтанный апоптоз. Он особенно выражен при кратковременном культивировании клеток периферической крови in vitro без добавления в культу ральную среду каких-либо гуморальных факторов. Лимфоциты периферической крови не подвергаются спонтанному апоптозу при культивировании в течение 24 ч. Все нейтрофилы входят в апоптоз, который регистрируется различными методами. Среди моноцитов погибает путем апоптоза только малая часть клеток.
Способность клеток подвергаться апоптозу под действием МКА против CD95(Fas/APO-l) называется СD95-опосредованным апоптозом. МКА против СD95-антигена индуцируют апоптоз только в CD95+ клетках. Молекула CD95 сама по себе не убивает клетку, а лишь участвует в передаче сигнала смерти.’Механизм передачи, регуляция сигнала и пути его реализации интенсивно изучаются в последнее время. CD95-опосредованный апоптоз — это чрезвычайно быстрый процесс, который обнаруживается уже через 1 ч после начала инкубации клеток с МКА против СD95-антигена. Апоптоз, индуцированный МКА против СD95-антигена, не чувствителен к ингибиции циклоспорином А, циклогексемидом и актиномицином D. CD95-aнтиген экспрессирован как на покоящихся, так н на активированных лимфоцитах. Однако апоптоз можно индуцировать только в лимфоцитах, активированных в течение 4 дней и более. Часть СD95+-активированных Т-клеток является резистеной к СD95-опосредованному апоптозу после активации. Присутствие CD95-антигена на поверхности клетки является обязательным условием индукции апоптоза МКА против CD95-антигена в опухолевых клетках. Однако следует подчеркнуть, что МКА не всегда индуцируют программированную клеточную смерть. При одинаковом количестве СD95-антигена на злокачественных клетках МКА могут или индуцировать апоптоз, или вызвать стимуляцию пролиферации опухолевых клеток или же не оказать никакого воздействия.
Добавление к клеткам различных ингибиторов синтеза белка может изменять спектр биологических ответов, инициируемых МКА против С095-антигена. Комбинация МКА анти-СD95 с циклогексимидом приводит в 90 % случаев к ингибиции пролиферации СD95-положительных опухолей. F(ab)2-фрагменты МКА против CD95-рецептора не индуцируют апоптоз, так как для индукции необходимо перекрестное связывание рецептора. Кроме того, на способность МКА индуцировать апоптоз влияет изотип Ig. Так, МКА IgM изотипа, например СН11, индуцируют апоптоз, а МКА IgGl изотипа, например UB2, не индуцируют, поскольку не реагируют с доменом смерти CD95-рецептора. МКА против С095-антигена различают по способности индуцировать апоптоз в жидкой и твердой фазах: одни МКА индуцируют апоптоз в жидкой, другие — только в твердой фазе.
— Читать «Регуляция апоптоза. Онкогены и протоонкогены участвующие в апоптозе»
Оглавление темы «Онкогены и антионкогены»:
1. Виды антионкогенов. Гены-супрессоры — ген p53
2. Мутации гена р53. Гены RB и его функции
3. Свойства гена RB. Ингибиторы циклинозависимых киназ
4. Семейство CDK INK4. Функция генов р15, р18 и р19
5. Ген WT1. Функции гена WT1
6. Ген NF1. Гены р73 и p53
7. Клеточная смерть. Апоптоз
8. Антиген CD95. Участие CD95 в апоптозе
9. Регуляция апоптоза. Онкогены и протоонкогены участвующие в апоптозе
10. Функция белка BCL-2. Участие белка BCL-2 в апоптозе
| « | ВИЧ-инфекция — это поезд, который везёт человека от начальной станции — момента инфицирования до конечной станции — стадии СПИДа. Иммунный статус — это оставшееся расстояние до конечной станции. Вирусная нагрузка — скорость поезда. Терапия — стоп кран, который останавливает поезд и включает обратный ход. Но если дёрнуть за стоп-кран слишком поздно и на большой скорости, то инерция поезда уже не позволит эффективно его затормозить и включить задний ход. | » |
| — | ||
Иммунный статус — это:
- Общее состояние иммунной системы (напр., «низкий И.С.», «высокий И.С.»)
- Специальный анализ крови для оценки состояния иммунной системы (напр., «сдать кровь на И.С.»).
Иммунодефицит — это сниженный иммунный статус.
Для чего определяют иммунный статус?

CD4-клетка
Анализ на иммунный статус определяет количество различных клеток иммунной системы. Для людей с ВИЧ имеет значение количество клеток CD4 (или Т4-лимфоцитов).
CD4 или Т4-лимфоциты — белые клетки крови, которые отвечают за «опознание» различных болезнетворных бактерий, вирусов и грибков, уничтожать которые должна иммунная система.
Информация о количестве CD4 клеток позволяет врачу оценить уровень здоровья иммунной системы, ухудшается оно или улучшается. Слово «статус» — означает состояние.
Соответственно, чем их количество больше, тем лучше.
Как измеряется иммунный статус?

Иммунный статус измеряется с помощью специального анализатора и выражается абсолютным числом клеток CD4 в одном микролитре крови (то есть не во всем организме). Обычно его записывают как «клеток/мкл» или «мкл-1».
Кроме того, врач может оценить процент, который CD4 составляют от общего количества белых клеток. Это процентное (относительное) количество клеток CD4. Его нормальное значение — 30-60%.
Почему иммунный статус может изменяться с течением времени?
ВИЧ может инфицировать CD4 и производить в них свои копии, в результате чего эти клетки погибают. Хотя клетки гибнут из-за ВИЧ каждый день, миллионы CD4 воспроизводятся им на замену. Тем не менее, с течением длительного времени (годы) количество CD4 может уменьшаться и даже снижаться до опасного уровня. У большинства людей с ВИЧ количество CD4 обычно снижается через какое-то количество лет.
Что значит то или иное количество CD4 клеток?
- от 500 до 1200 клеток/мкл — норма.
- от 350 до 500 клеток/мкл говорит о сниженной работе иммунной системы (умеренном иммунодефиците).
- от 200 до 350 клеток/мкл или начинает быстро снижаться (выраженный иммунодефицит) — это повод поговорить со своим врачом о назначении антиретровирусной терапии.
- менее 200 клеток/мкл (глубокий иммунодефицит) — рекомендуется начало терапии, так как при таком иммунном статусе возникает риск СПИД-ассоциированных заболеваний.
От чего зависит количество СD4-клеток?
Количество клеток CD4 может то подниматься, то снова падать в результате инфекций, стресса, курения, физических упражнений, менструального цикла, приема контрацептивных таблеток, времени суток и даже времени года.
Более того, различные тест-системы могут давать разные результаты по количеству CD4.
Именно поэтому очень важно регулярно сдавать анализ на иммунный статус и смотреть на изменения в результатах. Нельзя оценить состояние здоровья ВИЧ-положительного человека по одному-единственному анализу.
Также лучше измерять количество CD4 в одной и той же клинике, примерно в одно и то же время суток. Если у вас инфекция, например, простуда или герпес, лучше отложить сдачу анализа до того момента, когда симптомы исчезнут и здоровье восстановится.
См. также
- CD4
- Вирусная нагрузка
- Терапия
Ссылки
- Низкий иммунный статус на терапии — повод для беспокойства[1]
Примечания и сноски
- ↑ Engsig FN, Zangerle R, Katsarou O. и др.«Long-term Mortality in HIV-Positive
Individuals Virally Suppressed for >3 Years With Incomplete CD4 Recovery» Clin Infect Dis. 2014 Mar 17. [Epub ahead of print]
