Форменные элементы и иммунитет
Состав крови
Кровеносная, она же сердечно-сосудистая система обеспечивает циркуляцию крови и лимфы в организме человека. Среди всех органов тела только поверхность глаз может получать кислород непосредственно из воздуха. Все остальные органы и ткани, даже кожа, получают кислород с током крови.
Кровь относится к соединительной ткани, клетки в ней занимают гораздо меньший объем, чем межклеточное вещество. Кровь состоит из жидкости с растворенными веществами (плазмы) и форменных элементов: лейкоцитов, эритроцитов и тромбоцитов. Плазма крови образует внутреннюю среду организма: жидкость из крови «выдавливается» в ткани и становится тканевой жидкостью, избыток тканевой жидкости попадает в лимфатические сосуды, становясь лимфой. Лимфа в итоге попадает в кровоток, возвращая жидкость в кровь.
Плазма крови содержит 0,9% хлорида натрия (поваренная соль), поэтому для внутривенных вливаний используют водный 0,9% раствор NaCl («физиологический», или изотонический раствор). Другие соли и органические вещества в сумме занимают около 9% массы плазмы. Большую роль играют белки плазмы, особенно альбумины.
Для поддержания постоянной кислотности в плазме присутствуют буферные системы. Водородный показатель крови человека (pH) в среднем равен 7,4. При его смещении в кислотную или основную сторону происходят химические реакции в буферных системах, которые уравновешивают изменения кислотности.
Поддерживать постоянство внутренней среды (гемостаз) необходимо для нормальной жизни клеток. Клеточная мембрана проницаема для молекул воды, поэтому если снаружи концентрация раствора повышается (гипертонический раствор), вода стремится выйти из клетки по закону осморегуляции. Клетка при этом скукоживается, становится неправильной формы, многие ее органеллы перестают правильно работать.
Если же концентрация соли в окружающем растворе слишком мала (гипотонический раствор), вода стремится внутри клетки, чтобы «разбавить» ее содержимое. В этом случае клетки разбухают, мембрана может не выдержать и лопнуть. Таким образом, изменение солености крови может привести к необратимым изменениям в организме.
Клетки составляют около 45% объема крови. Выделяют «белую» кровь – лейкоциты и «красную» кровь – эритроциты. Эритроциты имеют небольшой размер и двояковогнутую дисковидную форму. Такая форма дает большую площадь поверхности при минимальном объеме, что повышает эффективность газообмена. Эритроциты человека не имеют ядра, они теряют его в процессе созревания.
Эритроциты
В 1 мл крови содержится 4-6 млн эритроцитов. Их главная функция – перенос кислорода, за это отвечает крупный белок – гемоглобин. Одна молекула гемоглобина состоит из четырех полипептидных цепей (глобина) и железосодержащих групп (гема). Каждая молекула гемоглобина может перенести четыре молекулы кислорода, причем способность связывать и отдавать кислород зависит от условий среды: в более щелочной среде (легких) гемоглобин лучше связывает кислород, в то время как в более кислой среде (тканях), он лучше отдает его.
Механизм действия гемоглобина
Помимо кислорода с гемоглобином могут связываться другие газы, самым опасным из которых является угарный (СО). Он образуется при неполном сгорании органики в условиях нехватки кислорода и не имеет цвета и запаха. Сродство гемоглобина к угарному газу гораздо выше, чем к кислороду, поэтому, однажды связавшись с гемоглобином, угарный газ будет еще долго циркулировать в крови. При этом свободных сайтов связывания кислорода станет меньше и ткани начнут страдать от его нехватки. Тяжелое отравление угарным газом требует немедленной специализированной помощи.
Клетки крови
Лейкоциты
Лейкоциты являются основой клеточного иммунитета, это сферические клетки с достаточно крупным ядром. 1 мл крови содержит 4-11 тысяч лейкоцитов. Из всех клеток организма они наиболее уязвимы к действию радиации.
В зависимости от свойств лейкоциты делятся на несколько типов: содержащие гранулы, или гранулоциты (эозинофилы, нейтрофилы, базофилы) и не содержащие – агранулоциты.
Тромбоциты
Также кровь содержит тромбоциты, которые представляют собой отшнуровавшиеся куски гигантской клетки. Сами тромбоциты клетками не являются, они выглядят как мелкие пластинки неправильной формы и содержат только цитоплазму с гранулами. В гранулах находятся ферменты свертывающей системы, которые активируются при повреждении сосуда: образуется сгусток крови (тромб), который закупоривает поврежденный участок. 1 мл крови содержит 200-500 тысяч тромбоцитов.
Начало всем форменным элементам крови дают стволовые клетки красного костного мозга. Клетки крови постоянно обновляются, но у разных типов клеток обновление происходит с разной периодичностью. Эритроциты могут циркулировать 120-130 суток, в то время как лейкоциты и тромбоциты обычно живут не дольше 5-7 суток.
Иммунитет
Иммунная система защищает организм от воздействия бактерий, вирусов, грибов и паразитов, вредных веществ. В случае сбоя в работе иммунитета могут возникать аутоиммунные заболевания, в организме человека есть несколько механизмов, чтобы их предотвратить.
Органы, участвующие в формировании иммунитета
Основными органами иммунной системы являются селезенка, тимус (вилочковая железа) и костный мозг, где появляются и начинают созревать иммунные клетки. Клетки иммунитета циркулируют с кровью, располагаются в лимфоузлах и тканях, особенно много их в местах контакта с внешней средой (кожа, ЖКТ, дыхательные пути). Некоторые органы защищены от иммунного ответа барьерами, они называются иммунологически привилегированными органами. Это мозг, камеры глаза, семенники, плацента и плод и т.д. При травмах иммунологически привилегированных органов, когда нарушается целостность барьера, могут возникнуть аутоиммунные реакции.
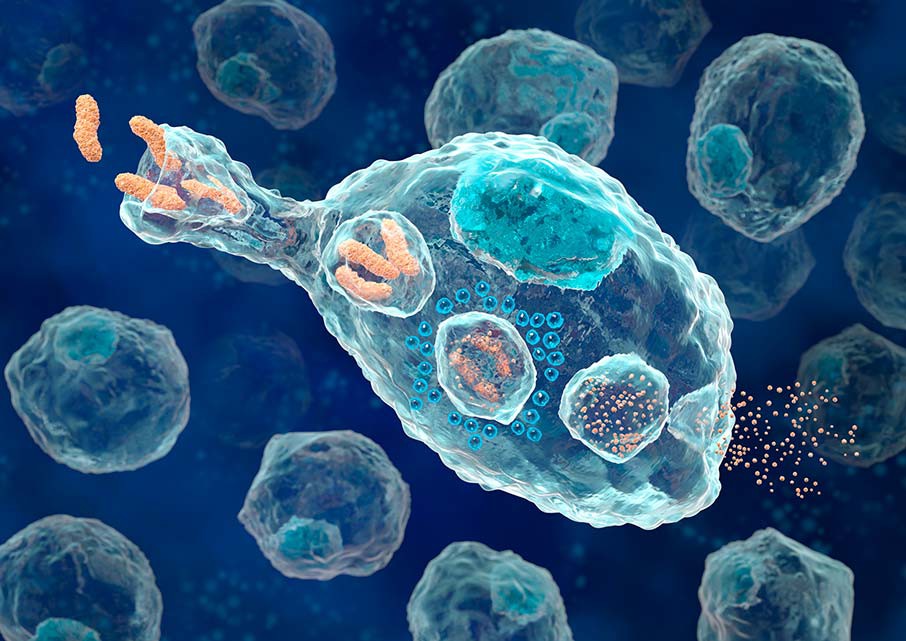
Макрофаги
Другие клетки неспецифического иммунитета, которые первыми отвечают на воздействие, – макрофаги. Это крупные клетки, которые способны к активному передвижению и фагоцитозу, они пожирают бактерии и инородные тела. Самостоятельно распознавать чужеродные белки макрофаги не способны, их действие не избирательно. «Ориентируют» макрофагов на уничтожение конкретных клеток антитела.
Макрофаг, фагоцитирующий бактерии.
Другими клетками иммунитета являются нейтрофилы и эозинофилы. Они, как и макрофаги, являются фагоцитами (то есть способны к фагоцитозу). Кроме того, в их цитоплазме есть гранулы с едкими веществами, которые высвобождаются при активации клетки. Запускается каскад химических реакций, в ходе которых образуются активные формы кислорода, это называется кислородным взрывом. Нейтрофилы и эозинофилы, а также окружающие здоровые клетки тоже погибают в результате кислородного взрыва, их остатки фагоцитируют макрофаги. Эозинофилы играют основную роль в развитии аллергий.
Нейтрофил, эозинофил, базофил
Фагоциты способны к направленному движению (хемотаксису), их можно обнаружить во многих тканях и органах, даже на поверхности кожи. Благодаря их постоянной активности большая часть атакующих агентов не вызывает инфекции, то есть системного ответа организма. Инфекция возникает в том случае, если иммунитет ослаблен (переутомление, переохлаждение, голодание и т.д.) или если инфекционный агент не был вовремя распознан фагоцитами.
Различают два вида иммунитета: клеточный и гуморальный. Гуморальный иммунитет – это система комплемента и циркулирующие с плазмой крупные молекулы – антитела. Белки системы комплемента «помечают» чужеродные агенты, вызывая направленное движение клеток иммунитета. Также система комплемента может формировать поры в мембране бактерий, что будет вести к их разрушению.
Антитела
Каждое антитело имеет на конце вариабельные домены (участки), комплементарные к чужеродному белку и специфические для конкретного возбудителя. Они прикрепляются к комплементарным участкам белков, «помечая» их для других клеток иммунного ответа, например, для фагоцитов. Также антитела могут слипаться между собой, что вызывает агглютинацию возбудителя. Особенно эффективны антитела против бактерий.
На рисунке изображены молекулы антител. Каждая состоит из двух пар цепей, синим цветом нарисованы тяжелые цепи, коричневым – легкие.
Клеточный иммунитет состоит из Т и В-лимофцитов. Т-лимофоциты могут быть двух видов: Т-хелперы и Т-киллеры. Т-киллеры клетки-убийцы, они запускают процессы апоптоза, то есть запрограммированной гибели клеток, их самоуничтожения. Это необходимо, если клетки организма заражены вирусами или бактериями или если при делении в геноме появились мутации (то есть Т-киллеры борются также с раковыми клетками).
В-лимфоциты синтезируют антитела и таким образом управляют гуморальным иммунитетом. При миграции В-клеток из крови в ткань они дифференцируются в плазматические клетки.
Лимфоциты действуют избирательно, они «настроены» на уничтожение возбудителя с конкретными антигенами. Чтобы правильно «настроить» лимфоциты, нужны антиген-презентирующие клетки (АПК). АПК фагоцитируют чужеродных агентов и выставляют на своей поверхности участки их молекул в комплексе с МНС II (главный комплекс гистосовместимости II). Т-хелперы способны распознавать чужие молекулы на поверхности АПК и активировать иммунный ответ.
Специфический иммунитет очень эффективен, но требует времени на развертывание. От попадания возбудителя в кровь до выработки антител может пройти несколько дней.
К неспецифическому иммунитету относят в основном фагоциты, которые пытаются поглотить или разрушить любое инородное тело или подозрительную клетку, которую встречают.
Немаловажную роль в иммунной защите организма играет воспаление. Это сложный стадийный процесс, который имеет следующие признаки: отек, местное повышение температуры, покраснение, боль и утрата функции органа. Благодаря отеку затрудняется распространение возбудителей по организму, место проникновения ограничивается. При повышении температуры повышается активность некоторых белков гуморального иммунитета, в то время как активность бактерий и скорость их размножения снижаются. Воспалительный процесс особенно эффективен против паразитов.
N-киллеры (натуральные киллеры), как и Т-киллеры могут запускать процессы клеточной гибели. Однако они, в отличии от Т-клеток, не требуют специальной подготовки – презентации антигена и активации. N-киллеры хорошо борются с опухолями.
Интерфероны – белки крови, которые составляют основу противовирусного гуморального иммунитета. Вирусы проникают в клетки организма, после чего здоровые клетки перестают синтезировать необходимые белки и начинают воспроизводить белки и генетическую информацию вирусов. Чтобы остановить распространение вирусных частиц и выиграть время на формирование специфического иммунитета, интерфероны замедляют или даже останавливают синтез белка в зараженных клетках.
Неспецифический иммунитет не требует времени на развертывание, его действие начинается уже в первые минуты после воздействия. Однако и точность неспецифического иммунитета низкая, при развитии иммунного ответа могут страдать здоровые клетки.
Синтез клеток специфического иммунитета (лимфоцитов) включает в себя элемент случайности, только так можно достигнуть неимоверного разнообразия иммунных клеток. Чтобы в кровоток не выходили клетки, которые способны атаковать собственный организм, они проходят строгий отбор в органах иммунной системы, где происходит созревание лимфоцитов (тимус, лимфоузлы). Если в результате отбора оказывается, что юный лимфоцит распознает клетки своего организма в качестве «врагов», в нем запускается процесс апоптоза, самоуничтожения.
Группы крови. Гемотрансфузия.
На поверхности эритроцитов могут находиться белки-агглютиногены А и В. В зависимости от того, какие агглютиногены есть в организме, выделяют: I группу крови (без агглютиногенов), II (только А), III (только В) и IV (оба агглютиногена).
При гемотрансфузии (переливании крови) необходимо учитывать группу, чтобы избежать возникновения иммунного конфликта. Если человеку с I группой крови перелить любую другую, клетки его иммунитета распознают чужеродные белки-агглютиногены и выработают антитела. В результате все чужие эритроциты «слипнутся» (агглютинируют), что может быть очень опасно для организма хозяина. Поэтому людям с I группой крови можно переливать только кровь такой же группы.
Если же перелить кому-нибудь эритроциты I группы крови, не имеющие белков-агглютиногенов, реакции иммунитета не последует. Можно сказать, что обладатели I группы самые «щедрые», потому что могут поделиться своей кровью со всеми. Также их называют универсальными донорами.
Обратная ситуация с IV группой: в крови таких людей нет антител ни к агглютиногену А, ни к агглютиногену В, поэтому им можно перелить кровь любой группы. Однако при попадании эритроцита группы IV в организм с другой группой произойдет агглютинация, поэтому обладателей IV группы крови можно назвать самыми «жадными» или универсальными реципиентами. Соответственно, II группу крови нельзя перелить обладателю III и наоборот.
Помимо агглютиногенов А и В существует много других белков, которые могут привести к возникновению иммунного конфликта. Международное общество трансфузиологов в настоящее время признает всего 36 систем деления крови на группы. Наиболее часто применяют систему АВО, в которой также учитывают резус-фактор. Впервые этот белок был описан у макак-резусов, за что и получил свое название.
Большая часть людей резус-положительна (Rh+), то есть имеет на эритроцитах белок-резус. Им можно переливать кровь с любым резусом. Людям же с резус-отрицательной кровью (Rh-) можно переливать только резус-отрицательную кровь.
Резус-фактор может стать причиной резус-конфликта между матерью и плодом. Если у резус-отрицательной матери будет резус-положительный ребенок, то при попадании крови плода в кровоток матери сформируются антитела к Rh+ белку. Чаще всего смешение крови происходит при родах и не несет опасности для ребенка. Если же антитела каким-то образом появились до родов, они могут проникнуть через плаценту и вызвать агглютинацию эритроцитов плода, что приведет к его гибели. Такая опасность часто возникает при повторной беременности резус-отрицательных женщин.
Распространенность групп крови варьирует в разных популяциях. На картинке приведена частота встречаемость разных групп по системе АВО в мире.
Распространенность групп крови
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 мая 2020;
проверки требуют 8 правок.
Иммуните́т (лат. immunitas — освобождение) человека и животных — способность организма поддерживать свою целостность и биологическую индивидуальность путём распознавания и удаления чужеродных веществ и клеток[1] (в том числе болезнетворных бактерий и вирусов). Характеризуется изменением функциональной активности преимущественно иммуноцитов с целью поддержания гомеостаза внутренней среды.
Назначение[править | править код]
Простейшие защитные механизмы, имеющие своей целью распознавание и обезвреживание патогенов, существуют даже у прокариот: например, ряд бактерий обладает ферментными системами, которые препятствуют заражению бактерии вирусом[2]. Одноклеточные эукариотные организмы применяют токсичные пептиды, чтобы предотвратить проникновение бактерий и вирусов в свои клетки[3].
По мере эволюции сложно организованных многоклеточных организмов у них формируется многоуровневая иммунная система, важнейшим звеном которой становятся специализированные клетки, противостоящие вторжению генетически чужеродных объектов[4].
У таких организмов иммунный ответ происходит при столкновении данного организма с самым различным чужеродным в антигенном отношении материалом, включая вирусы, бактерии и другие микроорганизмы, обладающие иммуногенными свойствами молекулы (прежде всего белки, а также полисахариды и даже некоторые простые вещества, если последние образуют комплексы с белками-носителями — гаптены[5]), трансплантаты или мутационно изменённые собственные клетки организма. Как отмечает В. Г. Галактионов, «иммунитет есть способ защиты организма от всех антигенно чужеродных веществ как экзогенной, так и эндогенной природы; биологический смысл подобной защиты — обеспечение генетической целостности особей вида в течение их индивидуальной жизни»[6]. Биологическим смыслом такой защиты является обеспечение генетической целостности особей вида на протяжении их индивидуальной жизни, так что иммунитет выступает как фактор стабильности онтогенеза[7].
Характерные признаки иммунной системы[8]:
- способность отличать «своё» от «чужого»;
- формирование памяти после первичного контакта с чужеродным антигенным материалом;
- клональная организация иммунокомпетентных клеток, при которой отдельный клеточный клон способен, как правило, реагировать лишь на одну из множества антигенных детерминант.
Классификации[править | править код]
Иммунная система исторически описывается состоящей из двух частей — системы гуморального иммунитета и системы клеточного иммунитета. В случае гуморального иммунитета защитные функции выполняют молекулы, находящиеся в плазме крови, а не клеточные элементы. В то время как в случае клеточного иммунитета защитная функция связана именно с клетками иммунной системы.
Иммунитет также классифицируют на врождённый и адаптивный.
Врождённый (неспецифический, наследственный[9]) иммунитет обусловлен способностью идентифицировать и обезвреживать разнообразные патогены по наиболее консервативным, общим для них признакам, дальности эволюционного родства, до первой встречи с ними. В 2011 году была вручена Нобелевская премия в области медицины и физиологии за изучение новых механизмов работы врождённого иммунитета (Ральф Стайнман, Жюль Хоффман и Брюс Бётлер)[10].
Осуществляется большей частью клетками миелоидного ряда, не имеет строгой специфичности к антигенам, не имеет клонального ответа, не обладает памятью о первичном контакте с чужеродным агентом.
Адаптивный (устар. приобретённый, специфический) иммунитет имеет способность распознавать и реагировать на индивидуальные антигены, характеризуется клональным ответом, в реакцию вовлекаются лимфоидные клетки, имеется иммунологическая память, возможна аутоагрессия.
Классифицируют на активный и пассивный.
- Приобретённый активный иммунитет возникает после перенесённого заболевания или после введения вакцины.
- Приобретённый пассивный иммунитет развивается при введении в организм готовых антител в виде сыворотки или передаче их новорождённому с молозивом матери или внутриутробным способом.
Другая классификация разделяет иммунитет на естественный и искусственный.
- Естественный иммунитет включает врождённый иммунитет и приобретённый активный (после перенесённого заболевания), а также пассивный иммунитет при передаче антител ребёнку от матери.
- Искусственный иммунитет включает приобретённый активный после прививки (введение вакцины) и приобретённый пассивный (введение сыворотки).
Органы иммунной системы[править | править код]
Выделяют центральные и периферические органы иммунной системы. К центральным органам относят красный костный мозг и тимус, а к периферическим — селезёнку, лимфатические узлы, а также местноассоциированную лимфоидную ткань: бронхассоциированную (БАЛТ), кожноассоциированную (КАЛТ), кишечноассоциированную (КиЛТ, пейеровы бляшки).
Красный костный мозг — центральный орган кроветворения и иммуногенеза. Содержит самоподдерживающуюся популяцию стволовых клеток. Красный костный мозг находится в ячейках губчатого вещества плоских костей и в эпифизах трубчатых костей. Здесь происходит дифференцировка В-лимфоцитов из предшественников. Содержит также Т-лимфоциты.
Тимус — центральный орган иммунной системы. В нём происходит дифференцировка Т-лимфоцитов из предшественников, поступающих из красного костного мозга.
Лимфатические узлы — периферические органы иммунной системы. Они располагаются по ходу лимфатических сосудов. В каждом узле выделяют корковое и мозговое вещество. В корковом веществе есть В-зависимые зоны и Т-зависимые зоны. В мозговом есть только Т-зависимые зоны.
Селезёнка — паренхиматозный зональный орган. Является самым крупным органом иммунной системы, кроме того, выполняет депонирующую функцию по отношению к крови. Селезёнка покрыта капсулой из плотной соединительной ткани, которая содержит гладкомышечные клетки, позволяющие ей при необходимости сокращаться. Паренхима представлена двумя функционально различными зонами: белой и красной пульпой. Белая пульпа составляет 20 %, представлена лимфоидной тканью. Здесь имеются В-зависимые и Т-зависимые зоны. И также здесь есть макрофаги. Красная пульпа составляет 80 %. Она выполняет следующие функции:
- Депонирование зрелых форменных элементов крови.
- Контроль состояния и разрушения старых и повреждённых эритроцитов и тромбоцитов.
- Фагоцитоз инородных частиц.
- Обеспечение дозревания лимфоидных клеток и превращение моноцитов в макрофаги.
Иммунокомпетентные клетки[править | править код]
К иммунокомпетентным клеткам относят макрофаги и лимфоциты. Эти клетки совместно участвуют в инициации и развитии всех звеньев адаптивного иммунного ответа (система трёхклеточной кооперации).
Клетки, участвующие в иммунном ответе[править | править код]
T-Лимфоциты[править | править код]
Субпопуляция лимфоцитов, отвечающая главным образом за клеточный иммунный ответ. Включает в себя субпопуляции Т-хелперов (дополнительно разделяются на Th1, Th2, а также выделяют Treg, Th9, Th17, Th22,), цитотоксических Т-лимфоцитов,NKT. Включает в себя эффектор, регуляторы и долгоживущие клетки-памяти. Функции разнообразны: как регуляторы и администраторы иммунного ответа (Т-хелперы), так и киллеры (цитотоксические Т-лимфоциты).
B-Лимфоциты[править | править код]
Субпопуляция лимфоцитов, синтезирующая антитела и отвечающая за гуморальный иммунный ответ.
Натуральные киллеры[править | править код]
Натуральные киллеры (NK-клетки) — субпопуляция лимфоцитов, обладающая цитотоксичной активностью, то есть они способны: контактировать с клетками-мишенями, секретировать токсичные для них белки, убивать их или отправлять в апоптоз. Натуральные киллеры распознают клетки, поражённые вирусами и опухолевые клетки.
Нейтрофилы[править | править код]
Нейтрофилы — это неделящиеся и короткоживущие клетки. Они составляют 65-70 % от гранулоцитов. Нейтрофилы содержат огромное количество антибиотических белков, которые содержатся в различных гранулах. К этим белкам относятся лизоцим (мурамидаза), липопероксидаза и другие антибиотические белки. Нейтрофилы способны самостоятельно мигрировать к месту нахождения антигена, так как у них есть рецепторы хемотаксиса (двигательная реакция на химическое вещество). Нейтрофилы способны «прилипать» к эндотелию сосудов и далее мигрировать через стенку к месту нахождения антигенов. Далее проходит фагический цикл, и нейтрофилы постепенно заполняются продуктами обмена. Далее они погибают и превращаются в клетки гноя.
Эозинофилы[править | править код]
Эозинофилы составляют 2—5 % от гранулоцитов. Способны фагоцитировать микробы и уничтожать их. Но это не является их главной функцией. Главным объектом эозинофилов являются гельминты. Эозинофилы узнают гельминтов и экзоцитируют в зону контакта вещества — перфорины. Эти белки встраиваются в билипидный слой клеток гельминта. В них образуются поры, внутрь клеток устремляется вода, и гельминт погибает от осмотического шока.
Базофилы[править | править код]
Базофилы составляют 0,5-1 % от гранулоцитов. Существуют две формы базофилов: собственно базофилы, циркулирующие в крови, и тучные клетки, находящиеся в ткани. Тучные клетки располагаются в различных тканях, лёгких, слизистых и вдоль сосудов. Они способны вырабатывать вещества, стимулирующие анафилаксию (расширение сосудов, сокращение гладких мышц, сужение бронхов). При этом происходит взаимодействие с иммуноглобулином Е (IgE). Таким образом они участвуют в аллергических реакциях. В частности, в реакциях немедленного типа.
Моноциты[править | править код]
Моноциты превращаются в макрофаги при переходе из кровеносной системы в ткани, существуют несколько видов макрофагов в зависимости от типа ткани, в которой они находятся, в том числе:
- Некоторые антигенпредставляющие клетки, в первую очередь дендритные клетки, роль которых — поглощение микробов и «представление» их Т-лимфоцитам.
- Клетки Купфера — специализированные макрофаги печени, являющиеся частью ретикулоэндотелиальной системы.
- Альвеолярные макрофаги — специализированные макрофаги лёгких.
- Остеокласты — костные макрофаги, гигантские многоядерные клетки позвоночных животных, удаляющие костную ткань посредством растворения минеральной составляющей и разрушения коллагена.
- Микроглия — специализированный класс глиальных клеток центральной нервной системы, которые являются фагоцитами, уничтожающими инфекционные агенты и разрушающими нервные клетки.
- Кишечные макрофаги и т. д.
Функции их разнообразны и включают в себя фагоцитоз, взаимодействие с адаптивной иммунной системой и инициацию и поддержание иммунного ответа, поддержание и регулирование процесса воспаления, взаимодействие с нейтрофилами и привлечение их в очаг воспаления, выделение цитокинов, регуляция репарации, регуляция процессов свертывания крови и проницаемости капилляров в очаге воспаления, синтез компонентов системы комплемента.
Макрофаги, нейтрофилы, эозинофилы, базофилы и натуральные киллеры обеспечивают прохождение врождённого иммунного ответа, который является неспецифичным (в патологии неспецифичный ответ на альтерацию называют воспалением, воспаление является неспецифической фазой последующих специфических иммунных).
Иммунно привилегированные области[править | править код]
В некоторых частях организма млекопитающих и человека появление чужеродных антигенов не вызывает иммунного ответа. К таким областям относятся мозг и глаза, семенники, эмбрион и плацента. Нарушение иммунных привилегий может становиться причиной аутоиммунных заболеваний.
Иммунные заболевания[править | править код]
Аутоиммунные заболевания[править | править код]
При нарушении иммунной толерантности или повреждении тканевых барьеров возможно развитие иммунных реакций на собственные клетки организма. Например, патологическая выработка антител к ацетилхолиновым рецепторам собственных мышечных клеток вызывает развитие миастении[11].
Иммунодефицит[править | править код]
См. также[править | править код]
- Иммунная система
- Врождённый иммунитет
- Приобретенный иммунитет
- Иммунотерапия рака
- Иммунитет растений
- Химера (биология)
Примечания[править | править код]
- ↑ ИММУНИТЕТ • Большая российская энциклопедия — электронная версия. bigenc.ru. Дата обращения 8 апреля 2020.
- ↑ Bickle T. A., Krüger D. H. Biology of DNA restriction // Microbiological Reviews. — 1993. — Vol. 57, no. 7. — P. 434—450. — PMID 8336674.
- ↑ Черешнев В.А. Черешнева М.В. Иммунологические механизмы локального воспаления. Медицинская иммунология 2011 т.13 №6 стр.557-568 РО РААКИ. cyberleninka.ru. Дата обращения 16 мая 2020.
- ↑ Travis J. On the Origin of the Immune System // Science. — 2009. — Vol. 324, no. 5927. — P. 580—582. — doi:10.1126/science.324_580. — PMID 19407173.
- ↑ Genetics of the Immune Response / Ed. by E. Möller and G. Möller. — New York: Plenum Press, 2013. — viii + 316 p. — (Nobel Foundation Symposia, vol. 55). — ISBN 978-1-4684-4469-8. — P. 262.
- ↑ Галактионов В.Г. Проблемы эволюционной иммунологии. cyberleninka.ru. Медицинская иммунология 2004 т.6 №3-5 РО РААКИ. Дата обращения 16 мая 2020.
- ↑ Галактионов, 2005, с. 8.
- ↑ Галактионов, 2005, с. 8, 12.
- ↑ Иммунитет // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. II. — ISBN 9965-9746-3-2.
- ↑ Нобелевская премия по физиологии и медицине 2011 (англ.). www.nobelprize.org.
- ↑ Галактионов, 2005, с. 392.
Литература[править | править код]
- Галактионов В. Г. . Эволюционная иммунология. — М.: Академкнига, 2005. — 408 с. — ISBN 5-94628-103-8.
- Хаитов Р. М. . Иммунология. — М.: ГЕОТАР, 2006. — 320 с. — ISBN 978-5-9704-1288-6.
- Ярилин А. А. . Иммунология. — М.: ГЕОТАР, 2010. — 737 с. — ISBN 978-5-9704-1319-7.
