Эффекторные реакции врожденного и адаптивного иммунитета
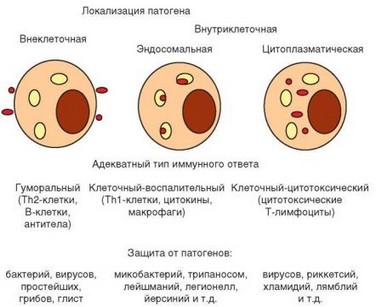
Особенности развития иммунного ответа определяются природой и локализацией патогенов. Существует 3 главные стратегии адаптивного иммунитета в отношении внутриклеточных и внеклеточных патогенов (рис. 1.7). Наиболее разнообразные эффекторные механизмы задействованы в защите от внеклеточных патогенов, при которой преобладает гуморальный иммунный ответ. Основные эффекторные молекулы при этом — антитела, секретируемые плазматическими клетками, дифференцирующимися из В-лимфоцитов при участии Th2-клеток.
Антитела способны связываться с антигенами, представленными как на клеточной мембране, так и в свободной растворимой форме. Прямое защитное действие антител в отношении свободных антигенов проявляется в нейтрализации их биологической активности (наиболее характерный пример — нейтрализация токсинов). В отношении антигенов, связанных с мембраной патогена, нейтрализующее действие антител проявляется в изменении биологической активности микроорганизма, например, в подавлении его подвижности или способности к адгезии на клетках хозяина, в предотвращении инфицирования вирусом клетки и т.д.
Более универсальны защитные механизмы, реализуемые антителами с участием других факторов или клеток. Главный из них — опсонизация — покрытие клеток молекулами иммуноглобулинов, облегчающими их распознавание и поглощение фагоцитами, которые имеют на мембране рецепторы для «хвостовой» части антител (Fc-рецепторы). Опсонизация значительно ускоряет фагоцитоз патогенов. Другой механизм защитного действия антител состоит в активации комплемента по классическому пути. Комплекс «антиген—антитело» связывает сывороточный фактор C1q, что вызывает каскадную активацию других компонентов комплемента. Этот процесс имеет

Рис. 1.7. Стратегия иммунной защиты зависит от локализации патогена
2 основных эффекта. Первый и главный из них — опсонизация клеток, но не антителами, а продуктами расщепления С3-компонента — C3b. Фагоциты имеют рецепторы к фрагментам С3 компонента и легко распознают опсони- зированный патоген. Второй результат, опосредующий защитный эффект комплемента, — цитолиз клетки за счет формирования мембраноатакующего комплекса. Кроме того, имеющие Fc-рецепторы естественные киллеры распознают опсонизированную антителами клетку и вызывают ее лизис по контактному механизму. Наконец, антитела облегчают распознавание патогенов макрофагами, имеющими высокоаффинные Fc-рецепторы, что резко усиливает защитные свойства этих клеток.
Защита от другой разновидности внеклеточных патогенов — макропаразитов (гельминтов) также осуществляется по ^2-зависимому механизму. Однако в этом случае наибольшую роль играют эозинофилы, привлекаемые цитокинами, которые секретируют ^2-лимфоциты и тучные клетки. Эозинофилы располагаются по поверхности паразита и выделяют содержащиеся в их эозинофильных гранулах высокоактивные белки, убивающие паразитов.
Антитела не способны проникнуть внутрь клеток и фактически бессильны против патогенов, имеющих внутриклеточную локализацию. Для защиты от внутриклеточных патогенов иммунная система имеет 2 стратегии. Как уже упоминалось, TM-клетки активируют макрофаги. При взаимодействии этих клеток ТЫ-лимфоцит получает дополнительный стимул через TCR, а макрофаг — через действие IFNy и костимулирующую молекулу CD40. Этот
«диалог» приводит к дополнительной активации макрофагов, в частности, к повышению бактерицидной активности этих клеток и формированию нового фактора — оксида азота и его производных (благодаря экспрессии макрофагами индуцибельной NO-синтазы). Это стимулирует разрушенние внутриклеточных патогенов, резистентных к действию факторов врожденного иммунитета до подключения Т-хелперов.
Таким образом, в данном случае истинными эффекторами становятся клетки врожденного иммунитета — макрофаги, завершающие элиминацию патогенов, поглощеных ими путем фагоцитоза. Только стимулирующие сигналы, поставляемые ТЫ-клетками, позволяют реализовать этот способ защиты от внутриклеточных (поглощенных, но не разрушенных) патогенов. В процессе иммунного ответа возникает еще одна разновидность индуцируемых Т-хелперов — Th17 (названы по доминирующему продукту — IL-17). Они привлекают нейтрофилы и реализуют свои эффекты, активируя эти клетки. В то же время их действие часто переходит в область патологии, выражающийся в развитии аутоиммунных процессов.
Другая стратегия борьбы с внутриклеточными патогенами направлена на элиминацию локализующихся в цитозоле патогенов (микоплазмы, лямблии и т.д.) или вирусов, геном которых интегрируется в геном клетки. Если в основе предыдущего механизма лежит усиление активности эффекторных клеток врожденного иммунитета, позволяющее им «излечиться» от патогена, то в данном случае иммунная система выбирает более радикальный путь — убивает инфицированную клетку вместе с патогеном (убитая клетка затем фагоцитируется). Функцию киллеров выполняют цитотоксические СD8+ Т-лимфоциты, отличающиеся от естественных киллеров не столько механизмом цитолиза, сколько специфичностью: прежде чем убить клетку, цитотоксический Т-лимфоцит должен распознать антигенный пептид патогена, выносимый на поверхность клетки-мишени в составе молекул MHC-I. Такой же механизм иммунная система использует при борьбе с опухолевыми клетками и при отторжении чужеродного трансплантата. Он же может участвовать в развитии аутоиммунной патологии (сахарный диабет I типа и др.).
Сопоставляя эффекторные механизмы врожденного (реализуемые на первой линии защиты) и адаптивного иммунитета (формируются в ходе иммунного ответа), следует отметить их сходство; при адаптивном ответе они незначительно модифицируются. Действительно, и во врожденном, и в адаптивном иммунитете используется киллинг патогенов или инфицированных клеток, регулируемый цитокинами или антителами. Таким образом, под влиянием факторов адаптивного иммунитета фагоцитоз интенсифицируется и становится более целенаправленным. Т-киллеры действуют подобно натуральным киллерам, но спектр их мишеней ограничен специфичностью их рецепторов, т.е. Т-киллеры действуют более избирательно. Внеклеточный цитолиз, осуществляемый эозинофилами, при адаптивном ответе проявляется локально благодаря выработке цитокинов, привлекающих эозинофилы к гельминтам. Наконец, реакции комплемента, активируемого через альтернативный и классический пути, приводят к одинаковым результатам, но включаются по антигенспецифическому механизму только во втором случае. Иными словами, адаптивный иммунитет использует

Рис. 1.8. Взаимосвязь врожденного и адаптивного иммунитета. Врожденный иммунитет обеспечивает презентацию антигена и костимуляцию, необходимые для запуска адаптивного иммунитета. В свою очередь, адаптивный иммунитет благодаря выработке антител и цитокинов придает реакциям врожденного иммунитета избирательность действия и повышает их эффективность
эффекторные механизмы врожденного иммунитета, придавая им специфичность и усиливая их путем контактных межклеточных взаимодействий и стимулирующего действия цитокинов (рис. 1.8).
Источник
I. МОТИВАЦИЯ ЦЕЛИ:Важной функцией иммунной системы является ее способность распознавать и уничтожать чужеродные клетки. Ведущую роль в этом процессе играют эффекторные клетки (ЦТЛ, макрофаги, NК-клетки и др.), обеспечивающие эффекторные реакции иммунитета. Знание механизмов этих реакций играет важную роль для понимания патогенеза многих заболеваний (аутоиммунных, аллергических, онкологических и др.)
II. ЦЕЛЬ САМОПОДГОТОВКИ: после самостоятельного изучения темы, студент должен знать: характеристику антителозависимых и антителонезависимых эффекторных механизмов иммунитета; механизмы цитотоксического действия эффекторных клеток врожденного и адаптивного иммунитета.
III. БАЗИСНЫЕ РАЗДЕЛЫ ДЛЯ ПОВТОРЕНИЯ: к практическому занятию студент должен повторить:
· Сапин М.Р., Билич Г.Л. Анатомия человека: учебник: в 3 т. – изд. 3-е испр., доп. – М.: ГОЭТАР-Медиа, 2009. – Т. 2. – 496 с.: ил. Органы кроветворения и иммунной системы, с. 246-308.
· Биология: учебник: в 2 т. / под ред. В.Н. Ярыгина. – М.: ГОЭТАР-Медиа, 2011. – Т. 2. – 560 с.: ил. Радел V, глава 14.7. Защита и поддержание целостности организма, постоянства его внутренней среды, оптимальных условий для процессов жизнедеятельности. Эволюция иммунной системы. с. 238-244.
· Гистология, эмбриология, цитология: учебник / под ред. Ю.И. Афанасьева, Н.А. Юриной. – 6-е изд., перераб.и доп. – М.: ГОЭТАР-Медиа, 2012. – 800 с.: ил. Глава 7. Кровь и лимфа. Кроветворения. с. 159-179. Глава 14. Система кроветворения и иммунной защиты. с. 423-450
· Микробиология, вирусология и иммунология: учеб. для студентов мед. вузов / под ред. В.Н. Царева. – М.: Практическая медицина, 2010. – 581 с.: ил. Радел 7.7. Иммунная система организма.
IV. ПЛАН ИЗУЧЕНИЯ ТЕМЫ:
1. Виды эффекторных механизмов врожденного и адаптивного иммунитета.
2. Классификация и характеристика эффекторных механизмов: антителозависимых и антителонезависимых.
3. Механизмы цитотоксической активeности ЦТЛ, NK, МФ, ЭФ, НФ.
V. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА:
Основная:
1. Хаитов, Р.М. Иммунология: учеб. для студентов мед. ВУЗов. Р.М. Хаитов. — М.: ГЭОТАР — Медиа, 2009. – 320 с.: ил. Гриф УМО. CD-ROM прилагается. Глава 8. Эффекторные механизмы иммунитета. с. 107-114.
2. Хаитов, Р.М. Иммунология. Норма и патология: Учебник. / Р.М.Хаитов, Г.А. Игнатьева, И.Г. Сидоpович. – 3-е изд., перераб. и доп. – М.: Медицина, 2010. – 752 с.: ил. (Учеб. лит. для студ. медвузов). Глава 8. Эффекторные механизмы иммунитета. С. 400-428.
3. Лекция.
Дополнительная:
Электронная библиотека медицинского вуза «Консультант студента» www.studmedlib.ru
1. Клиническая иммунология и аллергология с основами общей иммунологии: учебник / Л. В. Ковальчук, Л. В. Ганковская, Р. Я. Мешкова. — М. : ГЭОТАР-Медиа, 2011. — 640 с. : ил.
2. Иммунология : учебник / А. А. Ярилин. — М. : ГЭОТАР-Медиа, 2010. — 752 с. : ил.
VI. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. Назовите типы эффекторных механизмов врожденного и адаптивного иммунитета.
2. Перечислите антителозависимые эффекторные механизмы защиты.
3. Охарактеризуйте нейтрализацию, как один из начальных этапов освобождения организма от антигенов.
4. Охарактеризуйте механизмы собственной (реликтовой) активности антител.
5. Назовите основные компоненты АЗКЦ, условия ее реализации, механизмы.
6. Перечислите Т-лимфоцитзависимые эффекторные механизмы иммунитета.
7. Назовите основные этапы реализации ГНТ.
8. Объясните механизм цитотоксического действия ЦТЛ, NK.
VII. ОБЯЗАТЕЛЬНЫЕ ДЛЯ ВЫПОЛНЕНИЯ ЗАДАНИЯ:
1. Нарисуйте схемы:
· антителозависимых эффекторных механизмов (нейтрализация, опсонизация, связывание комплемента).
· гиперчувствительности немедленного типа.
· гиперчувствительности замедленного типа.
· АЗКЦ с участием эозинофилов.
ТЕМА: КОНТРОЛЬНОЕ ЗАНЯТИЕ
I. МОТИВАЦИЯ ЦЕЛИ:Успехи иммунологии широко используются в лечебной практике, иммунология становится ключевой дисциплиной современной медицины, поэтому будущему врачу необходимы глубокие знания об особенностях строения и функционирования иммунной системы, как в условиях нормы, так и при различных патологический состояниях.
II. ЦЕЛЬ САМОПОДГОТОВКИ: после самостоятельного изучения темы, студент должен знать:понятие об иммунологии как предмете, строение иммунной системы, особенности ее функционирования, отличительные особенности и характеристику клеток врожденного и адаптивного иммунитета, свойства цитокинов и их роль в регуляции иммунного ответа, виды иммунного ответа, этапы его развития, особенности клеточного и гуморального иммунного ответа, механизмы регуляции иммунного ответа, характеристику антителозависимых и антителонезависимых эффекторных механизмов иммунитета.
В результате изучения раздела «Основы иммунологии» студенты должны овладеть профессиональными компетенциями: ПК-1, ПК-31.
III. БАЗИСНЫЕ РАЗДЕЛЫ ДЛЯ ПОВТОРЕНИЯ: к практическому занятию студент должен повторить:
· Сапин М.Р., Билич Г.Л. Анатомия человека: учебник: в 3 т. – изд. 3-е испр., доп. – М.: ГОЭТАР-Медиа, 2009. – Т. 2. – 496 с.: ил. Органы кроветворения и иммунной системы, с. 246-308.
· Биология: учебник: в 2 т. / под ред. В.Н. Ярыгина. – М.: ГОЭТАР-Медиа, 2011. – Т. 2. – 560 с.: ил. Радел V, глава 14.7. Защита и поддержание целостности организма, постоянства его внутренней среды, оптимальных условий для процессов жизнедеятельности. Эволюция иммунной системы. с. 238-244.
· Гистология, эмбриология, цитология: учебник / под ред. Ю.И. Афанасьева, Н.А. Юриной. – 6-е изд., перераб.и доп. – М.: ГОЭТАР-Медиа, 2012. – 800 с.: ил. Глава 7. Кровь и лимфа. Кроветворения. с. 159-179. Глава 14. Система кроветворения и иммунной защиты. с. 423-450
· Микробиология, вирусология и иммунология: учеб. для студентов мед. вузов / под ред. В.Н. Царева. – М.: Практическая медицина, 2010. – 581 с.: ил. Радел 7.7. Иммунная система организма.
IV. ПЛАН ИЗУЧЕНИЯ ТЕМЫ:
1. Проведение компьютерного тестирования.
2. Собеседование по изученным темам.
V. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА ПО ТЕМЕ ЗАНЯТИЯ.
Основная литература:
1. Хаитов, Р.М. Иммунология: учеб. Для студентов мед. ВУЗов. Р.М. Хаитов. – М.: ГЭОТАР – Медиа, 2006, 2009, 2011.-311 с.: ил. Гриф УМО. CD-ROM прилагается.
2. Хаитов, Р.М. Иммунология. Норма и патология : учеб. Для студентов мед. ВУЗов и ун-тов/ Р.М.Хаитов, Г.А. Игнатьева, И.Г.Сидоpович.-3-е изд., перераб. И доп.- М. : Медицина, 2010. – 750 с. : ил. – (Учеб. Лит. Для студентов мед. Вузов и ун-тов).
3. Лекции.
Дополнительная литература:
Электронная библиотека медицинского вуза «Консультант студента» www.studmedlib.ru:
1. Клиническая иммунология и аллергология с основами общей иммунологии: учебник / Л. В. Ковальчук, Л. В. Ганковская, Р. Я. Мешкова. — М. : ГЭОТАР-Медиа, 2011. — 640 с. : ил.
2. Иммунология : практикум : учеб. пособие / [Ковальчук Л. В. и др.]; под ред. Л. В. Ковальчука, Г. А. Игнатьевой, Л. В. Ганковской. — М. : ГЭОТАР-Медиа, 2010. — 176 с. : ил.
3. Иммунология: учебник / А. А. Ярилин. — М. : ГЭОТАР-Медиа, 2010. — 752 с. : ил.
VI. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Определение понятия «иммунология». Основные этапы развития.
2. Иммунная система: определение, особенности, основные феномены, определяющие ее свойства (специфичность, чувствительность, иммунологическая индивидуальность, клональный принцип организации, иммунологическая память, толерантность, способность к регенерации, способность клеток к рециркуляции, феномен «двойного распознавания», регуляторное действие на другие системы организма).
3. Понятие об иммунитете: виды, особенности врожденного и приобретенного иммунитета.
4. Современные лабораторные иммунологические методы исследования (проточная цитометрия, ПЦР, ИФА, ХЛ).
- Особенности иммунной системы и ее функции.
- Особенности центральных и периферических органов иммунной системы, их функции.
- Лимфоидная ткань: строение, функции.
- Характеристика гемопоэтической стволовой клетки.
- Лимфоцит – как основная структурная единица иммунной системы.
- Особенности врожденного и приобретенного иммунитета, их взаимосвязь.
- Врожденный иммунитет: определение, основные отличительные признаки системы врожденного иммунитета, компоненты и функции врожденного иммунитета.
- Миелопоэз.
- Клетки врожденного иммунитета: миелоидные клетки – основа врожденного иммунитета; нейтрофилы; эозинофилы; тучные клетки и базофилы; моноциты и макрофаги; дендритные клетки; эпителиоциты, эндотелиоциты; NK клетки; NKT-клетки; АПК (антигенпрезентирующие клетки).
- Рецепторы врожденного иммунитета.
- Молекулы адгезии.
- Хемотаксические факторы и хемокины.
- Фагоцитоз, стадии фагоцитоза.
- Бактерицидность (кислородзависимая, кислороднезависимая).
- Гуморальные факторы врожденного иммунитета.
- Основные компоненты системы цитокинов, классификация по биологической активности, свойства цитокинов.
- Характеристика свойств наиболее важных цитокинов, роль в регуляции иммунных реакций в норме и при патологии.
22. Этапы дифференцировки Т- и В-лимфоцитов. Строение TCR- и BCR-рецепторов, особенности распознавания антигенов.
23. Строение и свойства антител. Получение моноклональных антител, их применение в клинике с диагностической и лечебной целью.
- Строение и функции HLA системы.
- Характеристика генов и антигенов HLA I, II и III классов.
- Роль HLA-системы в реакциях иммунитета.
- Механизмы связи HLA с болезнями человека.
- Методы типирования HLA- антигенов.
- Иммунный ответ: определение, стадии развития, связь с факторами врожденного иммунитета.
- Гуморальный иммунный ответ на тимусзависимые и тимуснезависимые антигены.
- Иммунный ответ клеточного типа.
- Механизмы взаимодействия клеток в иммунном ответе.
- Иммунологическая память.
- Динамика продукции антител при первичном и вторичном иммунном ответе
- Регуляция иммунного ответа ( антитела, регуляторные Т-лимфоциты).
- Виды эффекторных механизмов врожденного и адаптивного иммунитета.
- Классификация и характеристика эффекторных механизмов: антителозависимых и антителонезависимых.
- Механизмы цитотоксической активности ЦТЛ, NK, МФ, ЭФ, НФ.
Источник
Глава 1. ОСНОВНЫЕ ПОЛОЖЕНИЯ
Иммунитет — особое биологическое свойство многоклеточных организмов, направленное на защиту от генетически чужеродных факторов: микроорганизмов (бактерий, вирусов, простейших, грибов), инородных молекул и др. Иммунитет также обеспечивает невосприимчивость организма к инфекции при повторной встрече с патогеном. В медицинском смысле этот термин употребляли ещё до нашей эры в значениях: неприкосновенный, чистый, не затронутый заболеванием, невредимый, находящийся под хорошей защитой, устойчивый к заразной болезни.
Совокупность органных, тканевых, клеточных и молекулярных компонентов, функцией которых является осуществление иммунной защиты, называется иммунной системой. Иммунология — наука о строении и функциях иммунной системы как в норме, так и при различных патологических состояниях, в том числе и при нарушениях самой иммунной системы — иммунопатологиях.
Иммунную защиту обеспечивают два механизма: врождённый и адаптивный.
Врождённый иммунитет является присущей каждому организму с рождения, генетически закреплённой способностью противостоять инфекции. Это передовая линия обороны организма против патогенов, пытающихся проникнуть или уже проникших в покровные ткани или внутреннюю среду. Врождённый иммунитет срабатывает мгновенно или в течение первых нескольких часов после контакта с патогеном (возбудители, выделяемые ими токсины и другие чужеродные молекулы). Он включает четыре основных уровня защиты: анатомический, физиологический, фагоцитарный и воспалительный — покровные ткани, фагоциты, микробоцидные гуморальные вещества (протеазы, сильные окислители и свободные радикалы, продуцируемые фагоцитами, эндогенные противомикробные пептиды и др.), сосудистые реакции. Первичные рецепторы врождённого иммунитета — это молекулы многоклеточных, позволяющие «считывать» эволюционную память — информацию о том, чем отличаются микроорганизмы от собственных клеток.
Эти рецепторы способны распознавать консервативные молекулярные структуры — РАМР (Pathogen-Associated Molecular Patterns), характерные для групп сходных микроорганизмов. В настоящее время постоянно открывают новые патогенраспознающие рецепторы врождённого иммунитета. К ним относят мембраносвязанные паттернраспознающие рецепторы (Pattern Recognition Receptors, PRR), а также растворимые рецепторы — ряд белков сыворотки крови: C-реактивный белок (СРБ), маннозосвязывающий лектин (MBL — Mannose-Binding Lectin), компоненты комплемента.
Собственные возможности клеток врождённого иммунитета санировать организм от проникшего патогена часто недостаточны. Множество патогенов приспособилось выживать в присутствии факторов врождённой резистентности к инфекциям. Именно поэтому в процессе эволюции, начиная с челюстных рыб, к врождённому иммунитету добавился адаптивный иммунитет — специфический. Материальные носители адаптивного иммунитета — лимфоциты. Уникальное и отличительное свойство лимфоцитов как множества клеток — способность распознавать почти неограниченное (1018) разнообразие молекулярных объектов — антигенов. Лимфоциты характеризуются экспрессией Т-клеточных (TCR) или В-клеточных (BCR) рецепторов, распознающих только одну антигенную детерминанту либо небольшое число структурно очень близких детерминант, и поэтому, в отличие от PRR, обладающих высокой специфичностью (рис. 1-1).
Адаптивный (приобретённый) иммунитет формируется в течение жизни индивидуума. Активно приобретённый иммунитет — состояние невосприимчивости к инфекции после перенесённого инфекционного заболевания или после вакцинации (сам организм вырабатывает соответствующие антитела). Пассивно приобретённый иммунитет — состояние невосприимчивости к инфекции в результате поступления в организм уже готовых антител от матери или в результате инъекции (сам организм эти антитела не вырабатывает).
ИММУННЫЙ ОТВЕТ
Врождённая и адаптивная системы защиты организма включают клеточный и гуморальный компоненты и активно взаимодействуют друг с другом в процессе иммунного ответа. Иммунный ответ — многоэтапный процесс, заключающийся в распознавании и деструкции патогена и повреждённых им тканей. В его основе лежит уникальное свойство иммун-

Рис. 1-1. Сравнение врождённого и адаптивного иммунитета
ной системы отличать «свое» («sef») от «чужого» («nonself») и применять по отношению к «чужому» механизмы нейтрализации и уничтожения, а именно — иммунные реакции. Распознавание множества чужеродных антигенов происходит благодаря наличию в организме огромного разнообразия образующихся в тимусе клонов T-лимфоцитов (отбор клонов) и при помощи комплекса генов главного комплекса гистосовместимости (MHC) классов I и II. Нейтрализацию «чужого» осуществляют цирку-
лирующие в жидкостях организма антитела (гуморальный иммунитет) и цитотоксические лимфоциты (клеточный иммунитет).
Таким образом, основными характеристиками адаптивного иммунного ответа являются умение различать собственные антигены от чужеродных, специфичность и иммунная память.
• Различение «своего» и «чужого» выражается в дифференциации компонентов собственных тканей организма и чужеродных молекул. Специфическую неотвечаемость организма на собственные антигены обозначают как иммунную толерантность. Если же организм воспринимает собственные компоненты как чужеродные, развивается аутоиммунный ответ.
• Специфичность иммунного ответа проявляется в том, что иммунитет, сформировавшийся в результате контакта с определённым антигеном, будет обеспечивать защиту только против этого антигена.
• Иммунная память формируется в результате адаптивного иммунного ответа против конкретного возбудителя и сохраняется, как правило, в течение всей последующей жизни организма, защищая его от повторной инфекции, вызываемой этим же возбудителем. Такой механизм обеспечивается способностью иммунной системы к «запоминанию» антигенных детерминант патогена за счёт образования клеток иммунной памяти. Наличие иммунной памяти обусловливает развитие ускоренного и усиленного ответа (вторичный иммунный ответ) при повторном контакте с антигеном. Формирование иммунной памяти является основной целью вакцинации, т.е. процесса естественного или искусственного формирования иммунной защиты против определённой инфекции.
Схема развития иммунного ответа представлена на рис. 1-2. Содержание отдельных этапов иммунного ответа раскрыто ниже.
• Воспаление: участвуют клетки, поглощающие антигены (фагоциты, антигенпрезентирующие клетки) — в частности, дендритные клетки (ДК), макрофаги, эндотелиальные и другие клетки. Выделяются провоспалительные цитокины и хемокины.
• Переработка антигена (процессинг). После поглощения антигена антигенпрезентирующей клеткой (АПК) происходит его процессинг (расщепление и встраивание в молекулы MHC) и презентация на поверхности клетки. Это необходимо для распознавания антигена Т-лимфоцитами.
• Распознавание антигена происходит в периферических лимфоидных органах. Начало специфического иммунного ответа — про-

Рис. 1-2. Основные этапы иммунного ответа
лиферация и дифференцировка эффекторных и регуляторных лимфоцитов.
• Деструкция антигена и повреждённых патогеном тканей. При этом одни лимфоциты (помощники — хелперы) «нанимают» для выполнения эффекторных функций другие лимфоциты (эффекторные) и/или воспалительные лейкоциты (нейтрофилы, моноциты, базофилы, эозинофилы), тучные клетки, а также гуморальные литические системы типа комплемента.
• Выведение продуктов распада происходит с участием известных систем выделения.
КЛЕТКИ ИММУННОЙ СИСТЕМЫ
Клетки иммунной системы условно подразделяют на клетки врождённого и адаптивного иммунитета (рис. 1-3). Главным их различием является специфичность распознавания: низкая у первых и высокая у вторых. Существует и третья группа клеток — промежуточная, несущая черты обеих групп. Наличие этой группы показывает единство происхождения и способов защиты организма от чужеродных веществ антигенной природы.

Рис. 1-3. Клетки иммунной системы
В выполнении эффекторных иммунных функций очень важную роль играют АПК, T- и B-лимфоциты и NK-клетки (от англ. Natural Killer — естественный киллер, натуральный киллер).
• Антигенпрезентирующие клетки (АПК). К АПК относят макрофаги, дендритные клетки (включая клетки Лангерганса эпидермиса, М-клетки лимфатических фолликулов пищеварительного тракта и других слизистых оболочек, дендритные эпителиальные клетки тимуса), а также B-лимфоциты. АПК захватывают антиген, обрабатывают его (процессируют) и презентируют антигенные фрагменты на своей поверхности T-лимфоцитам (рис. 1-4).
• T-лимфоциты обусловливают клеточный иммунный ответ, а также помогают отвечать на антиген B-лимфоцитам при гуморальном иммунном ответе. Каждый T-лимфоцит несет на своей поверхности рецептор T-лимфоцитов (TCR — T-Cell Receptor) (см. рис. 5-1, в и рис. 6-1) строго одной специфичности, т.е. взаимодействующий с одним антигеном. T-клетки по экспрессии маркёрных антигенов CD (Cluster Differentiation) подразделяют на CD4+ и CD8+.
— CD4+ Т-лимфоциты (хелперы). Среди T-клеток, экспрессирующих мембранные маркёры CD4, выделяют Т-лимфоциты с эффекторными функциями (Th1, Th2, Th17) и Т-регуляторные клетки (естественные — Treg и индуцированные — Th3, или Tr1).

Рис. 1-4. Взаимодействие клеток в ходе гуморального иммунного ответа. Рецептор T-хелпера (TCR) распознаёт антигенную детерминанту (эпитоп), экспрессированную на поверхности антигенпрезентирующей клетки вместе с молекулой главного комплекса гистосовместимости класса II (MHC-II). Во взаимодействии участвует маркёрная молекула T-хелпера — CD4. В результате подобного взаимодействия антигенпрезентирующая клетка секретирует интерлейкин-1 (ИЛ-1), стимулирующий в T-хелпере синтез и секрецию цитокинов, включая ИЛ-2, а также синтез и перенос на плазматическую мембрану T-хелпера рецепторов для ИЛ-2 (ИЛ-2 также стимулирует пролиферацию T-хелперов). Отбор B-лимфоцитов происходит при взаимодействии антигена с вариабельными участками антител (иммуноглобулинов) на поверхности этих клеток (правая часть рисунка). Эпитоп этого антигена в комплексе с молекулой MHC-II распознаёт рецептор T-хелпера, после чего T-лимфоцит секретирует цитокины, стимулирующие пролиферацию B-лимфоцитов и их дифференцировку в плазматические клетки, синтезирующие антитела к данному антигену. Также показаны некоторые мембранные белки (CD40/CD40L и CD28/B7), участвующие в проведении костимуляторных сигналов, необходимых для полноценной активации взаимодействующих клеток (они описаны подробнее в главе 7)
◊ T-хелперы при взаимодействии с АПК специфически распознают антигены и начинают вырабатывать определённый набор цитокинов соответственно типу инфекционного агента: Th2 при взаимодействии с B-клетками индуцируют гуморальный иммунный ответ (см. рис. 1-4), а Th1 — при взаимодействии с макрофагами и цитотоксическими Т-лимфоцитами (ЦТЛ) — клеточный иммунный ответ. Th17 продуцируют ИЛ17 — мощный индуктор тканевого воспаления, привлекающий и активирующий гранулоциты и макрофаги.
◊ Регуляторные T-клетки (Т-регуляторы) контролируют интенсивность иммунного ответа, подавляя активность других субпопуляций Т-лимфоцитов.
— CD8+ Т-лимфоциты. Субпопуляция T-клеток, экспрессирующих мембранные молекулы CD8. Эти клетки выступают в роли ЦТЛ. Они лизируют клетки-мишени, несущие чужеродные или видоизменённые собственные антигены — аутоантигены: например, клетки опухоли, трансплантата, инфицированные вирусом клетки, несущие поверхностные вирусные антигены. Эффекторные функции ЦТЛ реализуются через индукцию образования в клетках-мишенях пор (под действием особых белков — перфоринов) и секрецию в поры специализированных сериновых протеаз — гранзимов. Вызванное этим нарушение осмотического баланса с внеклеточной средой приводит к гибели клетки (рис. 1-5). Под влиянием гранзимов индуцируются процессы запрограммированной гибели клетки — апоптоза.
• Т-клетки памяти — долгоживущие рециркулирующие малые лимфоциты, формируемые при первичном иммунном ответе. Они «запоминают» особенности детерминант антигенов и при повторном распознавании того же антигена развивают быстрый и усиленный ответ. Т-клетки памяти отличаются от наивных и эффекторных Т-лимфоцитов высоким уровнем экспрессии мембранных маркёров активации, меньшей потребностью в провоспалительных медиаторах и корецепторных сигналах для развития вторичного иммунного ответа.
• B-лимфоциты отвечают за гуморальный иммунный ответ. На мембране B-лимфоцитов присутствует рецептор для антигена — мономер IgM. Продолжительность жизни большинства B-лимфоцитов (если они не активируются антигеном!) не превышает 10 сут.

Рис. 1-5. Уничтожение клетки-мишени цитотоксическим T-лимфоцитом (Т-киллером). При сближении цитотоксического T-лимфоцита с клеткоймишенью после специфичного взаимодействия мембранных молекул клетокпартнёров T-лимфоцит убивает клетку-мишень
— Эффекторные B-лимфоциты. Активированные B-лимфоциты размножаются и дифференцируются в плазматические клетки (см. рис. 5-9), вырабатывающие антитела (иммуноглобулины, специфичные к конкретному антигену). При этом плазматические клетки теряют экспрессию специфических рецепторов для антигена.
— B-лимфоциты иммунной памяти — долгоживущие рециркулирующие малые лимфоциты. Они не превращаются в плазматические клетки, но сохраняют иммунную «память» об антигене, с которым когда-то контактировали, за счёт продолжающейся экспрессии рецептора для антигена. Клетки памяти активируются
при повторном распознавании того же антигена. В этом случае B-лимфоциты памяти, при обязательном участии T-хелперов и ряда других факторов, превращаются в плазматические клетки, обеспечивая быстрый синтез большого количества специфичных антител, взаимодействующих с чужеродным антигеном, и развитие эффективного иммунного ответа. • NK-клетки (от англ. Natural Killer — естественный киллер) — лимфоциты, лишённые характерных для T- и B-клеток поверхностных CD-маркёров, а также антигенраспознающих рецепторов — TCR (T Cell Receptor) или BCR (B Cell Receptor). Эти клетки играют важную роль в механизмах врождённого иммунитета (см. главу 3), уничтожают трансформированные, инфицированные вирусами и чужеродные клетки.
Источник
