Эндоцитозные рецепторы врожденного иммунитета

Цитокины —
группа растворимых клеточных
пептидных медиаторов, продуцирующихся
разными клетками организма и играющих
важную роль в обеспечении физиологических
процессов в норме и при патологии.
Свойства
цитокинов:
полипептиды
средней ММ (< 30 кД)регулируют
силу и продолжительность реакций
иммунитета и воспалениясекретируются
локальнодействуют
как паракринные и аутокринные факторысвойство
избыточности (одни и те же цитокины
вырабатываются разными клетками)взаимодействуют
с высокоаффинными рецепторами к
цитокинам на мембранах клетокплейотропность
(одни и теже цитокины действуют на
различные клетки-мишени)каскадность
(«цитокиновая сеть»)синергизм,
антагонизм
Классификация
цитокинов:
Интерлейкины
(ИЛ1-ИЛ18) – секреторные регуляторные
белки иммунной системы, обеспечивающие
медиаторные взаимодействия в иммунной
системе и связь ее с другими системами
организма.Интерфероны
(ИФНα,β,γ) – противовирусные агенты с
выраженным иммунорегуляторным действием.Факторы
некроза опухолей (ФНОα,ФНОβ) – цитокины
с цитотоксическим и регуляторным
действием.Факторы
роста (ФРФ, ФРЭ, ТФР β) – регуляторы
роста, дифференцировки и функциональной
активности клеток.Колониестимулирующие
факторы (ГМ-КСФ, Г-КСФ, М-КСФ) –
стимуляторы роста и дифференцировки
гемопоэтических клеток.Хемокины
(RANTES, MCP-1, MIP-1a) – хемоаттрактанты для
лейкоцитов.
Классификация
цитокинов по биологической активности:
Цитокины
– регуляторы воспалительных реакций:
провоспалительные
цитокины (ИЛ-1,
ИЛ-6, ИЛ-8, ФНОα, ИФНγ, МИФ)противовоспалительные (ТРФβ,
ИЛ-10, ИЛ-4, ИЛ-13).
Цитокины
– регуляторы клеточного антигенспецифического
иммунного ответа (ИЛ-1,
ИЛ-2, ИЛ-12, ИЛ-10, ИФНγ, ТРФβ).Цитокины
– регуляторы гуморального
антигенспецифического иммунного
ответа(ИЛ-4,
ИЛ-5, ИЛ-6, ИЛ-10, ИЛ-13, ИФНγ, ТРФβ).
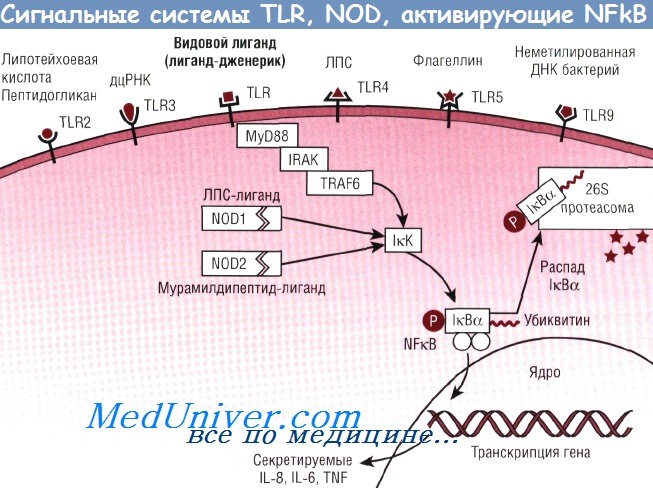
7. Эндоцитозные, сигнальные и растворимые рецепторы врожденного иммунитета.
Особую
роль в реакциях врожденного иммунитета
играют паттернраспознающие рецепторы
(PRR, особенно Toll-подобные рецепторы —
TLR), распознающие компоненты микроорганизмов
и эндогенные сигналы опасности, которые
возникают в организме. В результате
действия высокоэффективных механизмов
врожденная иммунная система определяет
потенциальные патогены, распознавая
ЛПС, пептидогликаны, липопептиды,
флагеллин и многие другие консервативные
и неизменяющиеся структурные молекулы.
В
этом отношении врожденную иммунную
систему рассматривают как первую линию
защиты против патогенных микроорганизмов
у млекопитающих. Одна из целей врожденного
иммунитета сводится к раннему установлению
различий между патогенами и непатогенами,
что особенно важно в пограничных тканях
(слизистые оболочки пищеварительного
тракта и дыхательных путей, кожа и т.д
Рецепторы
опознавания паттерна классифицируют
по специфичности к лиганду, функции,
локализации и по происхождению в
эволюции. По функции они делятся на два
класса: сигнальные и эндоцитозные.
Сигнальные
рецепторы опознавания паттерна включают,
например, толл-подобные
рецепторы.
Эндоцитозные
рецепторы опознавания паттерна,
например, маннозные рецепторы макрофагов,
необходимы для прикрепления, поглощения
и процессирования
микроорганизмов фагоцитами независимо
от внутриклеточной передачи регуляторного
сигнала. Кроме патогенов они опознают
также апоптозные клетки.
Мембранные
рецепторы опознавания паттерна
Рецепторы-киназы
Впервые
рецепторы опознавания паттерна были
открыты у растений[1].
Позже множество гомологичных рецепторов
было обнаружено при анализе геномов растений
(у риса 370, у Arabidopsis — 47). В отличие от
рецепторов опознавания паттерна у
животных, которые связывают внутриклеточные
протеинкиназы с помощью адапторных
белков, растительные рецепторы
представляют собой один белок, состоящий
из нескольких доменов, внеклеточного,
опознающего патоген, внутриклеточного,
обладающего киназной активностью, и
трансмембранного, связывающего первые
два.
Толл-подобные
рецепторы
Этот
класс рецепторов опознает патогены вне
клеток или в эндосомах[2].
Они были впервые обнаружены у дрозофилы и
индуцируют синтез и секрецию цитокинов,
необходимых для активации иммунного
ответа. В
настоящее время толл-подобные рецепторы
обнаружены у многих видов. У животных
их насчитывают 11 (TLR1-TLR11). Взаимодействие
толл-подобных рецепторов с лигандами
приводит к индукции сигнальных
путей NF-kB и
МАР-киназы, которые, в свою очередь,
индуцируют синтез и секрецию цитокинов и
молекул, стимулирующих презентацию
антигена[3].
Цитоплазматические
рецепторы опознавания паттерна
Nod-подобные
рецепторы
Nod-подобные
рецепторы — это цитоплазматические
белки с различными функциями. У
млекопитающих их найдено около 20, и
большинство из них подразделяют на два
главных подсемейства: NOD и NALP. Кроме
того, к этому семейству рецепторов
относят трансактиватор главного
комплекса гистосовместимости класса
II и некоторые другие молекулы. Опознавая
патоген внутри клетки, рецепторы
олигомеризуются и образуют инфламмасому,
активирующую ферменты протеолитической
активации цитокинов,
например, интерлейкина
1 бета. Рецепторы
активируют также сигнальный путь NF-kB и
синтез цитокинов[4][5].
NODS
Известны
два главных представителя: NOD1 и NOD2.
Связывают два разных бактериальных
пептидогликана[6].
NALPS
Известно
14 белков (NALP1 — NALP14), которые активируются
бактериальными пептидогликанами, ДНК,
двухцепочечной РНК, парамиксовирусом и мочевой
кислотой.
Мутации некоторых из NALPS являются
причиной наследственных аутоиммунных
заболеваний.
Другие
Nod-подобные рецепторы
Такие
молекулы, как IPAF и NAIP5/Birc1e также индуцируют
протеолитическую активацию цитокинов
в ответ на появление сальмонеллы и
легионеллы.
РНК
хеликазы
Индуцируют
антивирусный иммунный ответ после
активации вирусной РНК. У млекопитающих
это три молекулы: RIG-I, MDA5 и LGP2.
Секретируемые
рецепторы опознавания паттерна
Многие
рецепторы опознавания паттерна,
например, рецепторы
комплемента,
коллектины и пентраксины, к которым, в
частности, относится C-реактивный
белок, не
остаются в синтезирующей их клетке и
попадают в сыворотку крови[7].
Одним из важнейших коллектинов
является лектин,
связывающий маннозу;
он опознает широкий спектр патогенов,
в состав клеточной стенки которых
входит манноза,
и индуцирует лектиновый
путь активации системы комплемента[8].
Соседние файлы в предмете Иммунология
- #
- #
Варианты образраспознающих рецепторов PRRs. Toll-подобные рецепторыСекретируемые PRRs — это белки жидких сред организма. Для «хвостов» этих молекул есть специальные рецепторы на мембранах фагоцитов, что обеспечивает передачу информации из раствора в клетки врожденного иммунитета. Сериновые протеазы 1 и 2, ассоциированные с маннансвязывающим лектином (Maspl и Masp2), подобно протеазам классического пути активации комплемента С1r и C1s. Однако, протеазы маннансвязывающего пектина активируются при связывании с микробным лигандом. Эндоцитозные PRRs локализуются на поверхности фагоцитов. После распознавания PAMPs микробов PRRs опосредуют поглощение патогена и его доставку к лизосомам для расщепления. Процессированные пептиды представляются молекулами МНС на поверхности макрофага Т-лимфоцитам. К эндоцитозным PRRs принадлежит маннозный рецептор макрофага, распознающий терминальную маннозу и остатки фукозы на клеточных стенках микробов, и опосредует их фагоцитоз. Другой эндоцитозный PRR — макрофагальный рецептор-мусорщик, распознающий полианионные лиганды (двунитчатые ДНК, ЛПС, липотейхоевые кислоты), при связывании с бактериальной стенкой способствует клиренсу бактерий из кровообращения. PRRs усиливают фагоцитарные функции эффекторов врожденного иммунитета и обеспечивают удаление всех разрушенных фрагментов клеток. Сигнальные PRRs распознают PAMPs и активируют пути передачи сигнала для экспрессии разнообразных генов иммунного ответа, включая провоспалительные цитокины Данный класс рецепторов включает эволюционно законсервированные, так называемые Toll-подобные рецепторы (TLR), «звонящие» на мембране клетки, «оповещающие о приходе чужого». Toll-подобные рецепторы (TLR). Первый рецептор Toll-семейства, реагирующий с паттернами микроорганизмов, был идентифицирован у дрозофил. У них обнаружен ген, ответственный за формирование дорсо-вентральной полярности в эмбриогенезе, а также, обеспечивающий врожденный иммунитет против грибков. Цитоплазматические домены рецептора IL-1 млекопитающих и Toll у дрозофил, названные TIR доменом (Toll/IL-1 гомологичный домен), обладают гомологичным строением и индуцируют пути передачи сигнала, активирующего транскрипцию ядерных факторов-кВ (NF-kB).
Гомологи Toll дрозофилы у млекопитающих получили название Toll-подобные рецепторы. У человека одним из первых был идентифицирован TLR4. TLR стимулируют активацию сигнального пути NF-kB с экспрессией различных цитокинов и костимулирующих молекул, что является решающим фактором для формирования адаптивного иммунного ответа. В связи с этим сделано предположение о функционировании TLR в качестве рецепторов врожденной иммунной системы. Сейчас в семействе Toll-подобных рецепторов у человека известно около 23 членов (TLR-TLR23), однако не все они являются достаточно хорошо охарактеризованными. У мыши не выявлен TLR10, но обнаружен TLR11. Мыши, дефектные по TLR11 гену чувствительны к уропатогенным инфекциям. Трансмембранные Toll-подобные рецепторы характеризуются внеклеточным NH-концом и внутриклеточным СООН-концом. TIR домен (Toll/IL-1 гомологичный домен) TLR, состоящий из 200 аминокислот и содержащий три высококонсервативных участка, опосредует взаимодействие между Toll-подобными рецепторами и молекулами, осуществляющими трансдукцию сигнала. Toll-подобные рецепторы экспрессируются на клетках, осуществляющих первую линию защиты — нейтрофилах, макрофагах, ДК, эндоте-лиальных и эпителиальных клетках слизистых тканей. Недавно выявлено, что NK-клетки человека экспонируют следующие рецепторы: TLR3, TLR7, и TLR8. TLR1, TLR2, TLR4, TLR5, TLR6 и TLR11 располагаются на поверхности клетки. TLR7, TLR8 и TLR9, распознающие структуры, подобные нуклеиновым кислотам, локализуются внутриклеточно. TLR1 (ген локализован на 4р14 хромосоме) высоко экспрессирован на клетках селезенки и клетках периферической крови. Предполагается, что TLR1-рецепторы функционируют в качестве корецепторов, однако прямые лиганды рецептора не выявлены и точная функция остается до конца неясной. Показано, что в комплексе с TLR2 рецепторами они участвуют в ответе на триацилированные липопротеины. TLR2 (4q 31/3-32) играют ключевую роль в реагировании на продукты грамположительных бактерий, микобактерий, дрожжей. Широкий спектр распознаваемых паттернов TLR2 (пептидогликанов, липопротеинов и липотейхоевых кислот клеточной стенки) связан с возможностью образования данными рецепторами гетеродимеров с другими TLR. TLR2 образуют димеры с TLR6 и участвуют в распознавании пептидогликанов и диацилированных липопептидов грамположительных бактерий и микоплазм. Димеризуясь с TLR1, рецептор распознает триацилированные липопротеины, такие как Borrelia burgdorferi OspA. TLR3 (4q35) распознают двухцепочечную РНК, молекулярные структуры вирусов, но не проводят сигнал от одноцепочечной РНК или двухцепочечной ДНК. У мышей, дефицитных по TLR3, наблюдается снижение ответа на полиинозин-полицитидин (синтетический аналог двухцепочечной РНК), в то время как чувствительность клеток, экспрессирующих TLR3, на него сохраняется. Среди всех TLR наиболее изучен TLR4 (9q32-33). Он экспрессируется в организме на поверхности макрофагов, нейтрофилов, ДК, Т-, В-лимфоцитов и других. Напротив, у мышей, нокаутированных по TLR2 гену, ответ на ЛПС сохраняется. В TLR-опосредованном распознавании участвует еще белок MD2, а распознавание ЛПС осуществляется комплексом, состоящим из нескольких компонентов: CD14, TLR4, MD2. TLR4 и MD2 находятся в связанном состоянии, a CD14 вовлекается в комплекс после связывания ЛПС. — Также рекомендуем «Варианты Toll-подобных рецепторов. NOD-белки» Оглавление темы «Врожденный иммунитет»:
|
Рецепторы врожденного иммунитета содержатся на так называемых профессиональных аитигенпредставляющих клетках, к которым относятся дендритные клетки, макрофаги и В-лимфоциты. При этом экспрессия таких рецепторов не является клональной. Это означает, что все рецепторные молекулы одного типа имеют идентичные свойства. Каждый клон иммунокомпетентных клеток несет антигенраспознающий рецептор уникальной структуры. Как только шаблонраспознающие рецепторы идентифицируют патогенсвязанный молекулярный шаблон, сразу же запускаются эффекторные механизмы, что объясняет высокую кинетику механизмов врожденной резистентности. Высокая скорость реагирования обусловлена совмещением распознающей клеткой функций клетки-эффектора (т.е, той клетки, которая непосредственно повреждает патоген). Например, макрофаг распознает патогенсвязанный молекулярный шаблон, благодаря чему активируется и мгновенно производит фагоцитоз распознанного патогена.
Функционально рецепторы шаблонного распознавания разделены на три класса: секреторные, клеточные и сигнальные.
Опсонины
Секреторные шаблонраспознающие рецепторы функционируют в качестве опсонинов, связываясь с микробными шаблонами и помечая их для последующего распознавания системой комплемента или фагоцитами. Следует отметить, что опсонинами называют своеобразные биологические «метки», которые, фиксируясь на различных объектах, облегчают их распознавание факторами врожденной резистентности. Наиболее известный секреторный рецептор шаблонного распознавания — маннозосвязывающий лектин (лектин — это белок, способный связывать углеводы), который синтезируется в печени и циркулирует в плазме крови в поиске патогенов. Этот белок относится к кальцийзависимому семейству лектинов и функционирует как компонент так называемой острофазовой реакции.
Рецепторы фагоцитов
Клеточные шаблонраспознающие рецепторы находятся на поверхности фагоцитов. Если такие рецепторы распознают патогенсвязанный молекулярный шаблон на микробной клетке, то они инициируют захват фагоцитом носителя такой шаблонной молекулы с формированием специфической эндоцитарной вакуоли — фагосомы. В последующем фагосома сливается с лизосомой с образованием фаголизосомы, где и происходит деструкция патогена. В результате расщепления захваченного объекта пептиды патогена представляются в составе молекулы главного комплекса гистосовместимости (HLA) II класса на поверхности макрофага (либо другой антигенпредставляющей клетки) для распознавания специфическими рецепторами иммунокомпетентных клеток.
Маннозосвязывающий лектин макрофага является его клеточным шаблонраспознающим рецептором. Этот белок распознает углеводы с высоким содержанием манноз, что характерно для поверхностных структур микроорганизмов, и обеспечивает их фагоцитоз макрофагами. Другой клеточный шаблонраспознающий рецептор макрофагов — фагоцитарный рецептор к липополисахаридам (рЛПС) — связывается со стенками бактериальных клеток, обильно содержащих липополисахаридные субстанции. В частности, этот рецептор используется селезеночными и печеночными макрофагами для удаления микробных клеток из кровотока.
Toll-like-рецепторы (TLR)
Сигнальные шаблонраспознающие рецепторы при взаимодействии с шаблонами активируют внутриклеточные молекулярные каскады, стимулирующие экспрессию многих генов иммунного ответа, кодирующих структуру провоспалительных субстанций. К этой группе относятся Toll-like-рецепторы (TLR). Расшифрован сигнальным путь, запускающийся такими рецепторами при распознавании микробных липополисахаридов (рис. 1). Сегодня известно 14 разновидностей TLR антигенпрезентирующих клеток, способных распознавать шаблонные структуры микроорганизмов (бактерий, вирусов, грибков), простейших, растений и даже собственного организма (табл. 1).
Цитоплазматический каскад, включаемый активированным TLR, может разворачиваться как по MyD88-зависимому (см. рис. 1), так и по MyD88-независимому пути. MyD88 является белком, адаптирующим различные TLR к идентичному цитоплазматическому молекулярному каскаду, в связи с чем получил название белка-адаптера. В первом случае (TLR1, TLR2, TLR4, TLR5, TLR6, TLR7, TLR9) конечным результатом реализации каскада является высвобождение мощного провоспалительного посредника — нуклеарного фактора кВ, который обеспечивает синтез до иммунных цитокинов (ФНО-α, ИЛ-1β, ИЛ-6, ИЛ-12), стресс-белков, костимулируютцих молекул (CD80, CD86, CD40), хемокинов (в частности, ИЛ-8), антиапоптотических белков. При реализации MyD88-зависимого пути (TLR3 и TLR4) конечным результатом является синтез α / β -ИФН и костимулирующих молекул.
Таким образом, уже на уровне системы врожденной резистентности имеет место дифференциальный подход к типу ответа при разных формах патогенов. Так, при внеклеточных патогенах (бактерии) реализуется MyD88-зависимый путь активации клетки, а при внутриклеточной инфекции (вирусы) — MyD88- независимый.
Рецептор | Молекулярный шаблон | Носитель шаблона |
TLR1 | Триацил, липопептиды, растворимые факторы | Бактерии, в частности микобактерии и Neisseria meningitidis |
TLR2 | Липопротеины — липопептиды | Разнообразные патогены |
Пептидогликаны, липотейхоевые кислоты | Гр+бактерии | |
Липоарабиноманнан, фенолрастворимый модулин | Микобактерии, Staphylococcus epidermidis | |
Гликоинозитолфосфолипиды Порины | Trypanosoma cruzi Neisseria | |
Атипичные липополисахариды Зимозан | Leptospira interrogans, Porphyromonas gingivalis Грибки | |
Белки теплового шока 70 кД | Макроорганизм | |
TLR3 | Двухспиральная РНК | Вирусы |
TLR4 | Липополисахариды Таксол | Гр-бактерии Растения |
Fusion-белок Envelope-протеин Белок теплового шока 60 кД | Респираторно-синцитиальный вирус Вирус опухоли молочной железы Chlamydia pneumonia | |
Белок теплового шока 70 кД Фибронектин тип III Гиалуроновая кислота | Макроорганизм Материал с сайта https://wiki-med.com | |
Гепаран сульфат Фибриноген | Макроорганизм | |
TLR5 | Флагеллин | Бактерии |
TLR6 | Диациллипопептиды Липотейхоевые кислоты Зимозан | Микоплазмы Гр+бактерии Грибки |
TLR7 | Односпиральная РНК | Вирусы |
TLR8 | Односпиральная РНК | Вирусы |
TLR9 | CpG (цитозин — гуанозин фосфат), содержащие ДНК | Бактерии и вирусы |
TLR10 | Не установлены | Не установлены |
TLR11 | Не установлены | Уро патогенные бактерии |
 На этой странице материал по темам:
На этой странице материал по темам:
таблица по tlr рецепторам
rid рецепторы
рецепторы иммунитета
распознающие рецепторы врожденного иммунитета
рецепторы к рамр