Нобелевская премия за иммунитет
Иммунная система позволяет нам существовать в мире, полном патогенных микроорганизмов — вирусов, бактерий, грибов. Нобелевская премия по физиологии и медицине 2011 года вручена за открытия в области активации врожденного иммунитета (половину премии разделили Брюс Бётлер и Жюль Хоффман) и за изучение роли дендритных клеток в приобретенном иммунитете (вторая половина премии присуждена Ральфу Стайнману, к сожалению, скончавшемуся 30 сентября). Эти достижения не только дали понимание того, как слаженная работа врожденного и адаптивного иммунитета защищает организм, но и открыли новые перспективы в лечении инфекций, рака и воспалительных заболеваний.
Две линии иммунной обороны
Мы обитаем в мире, буквально кишащем патогенными микроорганизмами (бактериями, грибами, вирусами и паразитами), однако наши организмы оснащены совершенной системой защиты, позволяющей (в норме) не замечать опасного соседства. «Первая линия» иммунной обороны — врожденный иммунитет — уничтожает вторгшиеся в организм патогены на основе технологии «свой—чужой», распознавая черты, всегда присутствующие у «захватчиков», но отсутствующие в собственном организме. Если же инфекции удается прорваться, вступает в работу «вторая линия» — приобретенный, или адаптивный, иммунитет. Основанный на согласованной работе B- и T-лимфоцитов, он действует посредством специфических к конкретной инфекции антител и клеток-«убийц», уничтожающих зараженные клетки и саму инфекцию. В отличие от врожденного иммунитета, способность к распознаванию патогенов которого закодирована генетически, приобретенный иммунитет обучается распознавать новые «образы» врага и сохраняет память о нем, мгновенно «вспоминая», встретившись вновь.
Однако, обеспечивая необходимую защиту, иммунные механизмы скрывают и опасность: если «активационный барьер» слишком низок, иммунитет может активироваться собственными молекулами, что приводит к развитию аутоиммунных и воспалительных заболеваний.
Организация иммунной системы изучалась в течение XX века постепенно; в частности, нобелевскими премиями отмечены изучение строения антител и определение механизма распознавания Т-клетками инородных веществ. Однако только с работами Бётлера, Хоффмана и Стайнмана стали понятны механизмы, активирующие врожденный иммунитет и связывающие его с иммунитетом приобретенным.
Открытие сенсоров врожденного иммунитета
Пионерское открытие Жюля Хоффмана было сделано в 1996 году, когда он с коллегами исследовал, как дрозофила сопротивляется инфекциям [1]. Они работали на линиях мух, мутантных по нескольким генам, включая ген Toll, участвующий в эмбриональном развитии (за открытие роли этого гена также вручена Нобелевская премия в 1995 году). Хоффман с коллегами открыли, что мухи с мутантным геном Toll погибали при заражении бактериями или грибами, в то время как «дикий тип» чувствовал себя вполне сносно. В результате их работ был сделан вывод, что продукт этого гена — Toll-рецептор — «чувствует» патогенные микроорганизмы и запускает механизмы врожденного иммунитета.
Брюс Бётлер с коллегами, со своей стороны, искали рецепторы, которые могли бы активироваться элементом клеточной стенки бактерий липополисахаридом (ЛПС), который при попадании в кровь вызывает септический шок (чрезмерная активация иммунной системы, грозящая смертью). В 1998 году они обнаружили, что мыши, не реагирующие на введение ЛПС, имели мутации в гене, гомологичном Toll у дрозофил. Продукт этого гена — Toll-подобный рецептор — и оказался искомым сенсором липополисахарида [2]. Связывание ЛПС (обозначающее присутствие бактерий) активирует иммунитет и запускает воспаление, а чрезмерная концентрация ЛПС приводит к септическому шоку. Это открытие показало, что и членистоногие, и млекопитающие используют схожие стратегии противостояния бактериальным инвазиям.
Открытия Хоффмана и Бётлера фактически положили начало новой «горячей» области биологии: впоследствии было открыто более 10 Toll-подобных рецепторов, каждый распознающий свой «образ», характерный для разных групп микроорганизмов. Мутации в генах этих рецепторов увеличивают вероятность инфекционных заболеваний, а также хронических воспалительных болезней.
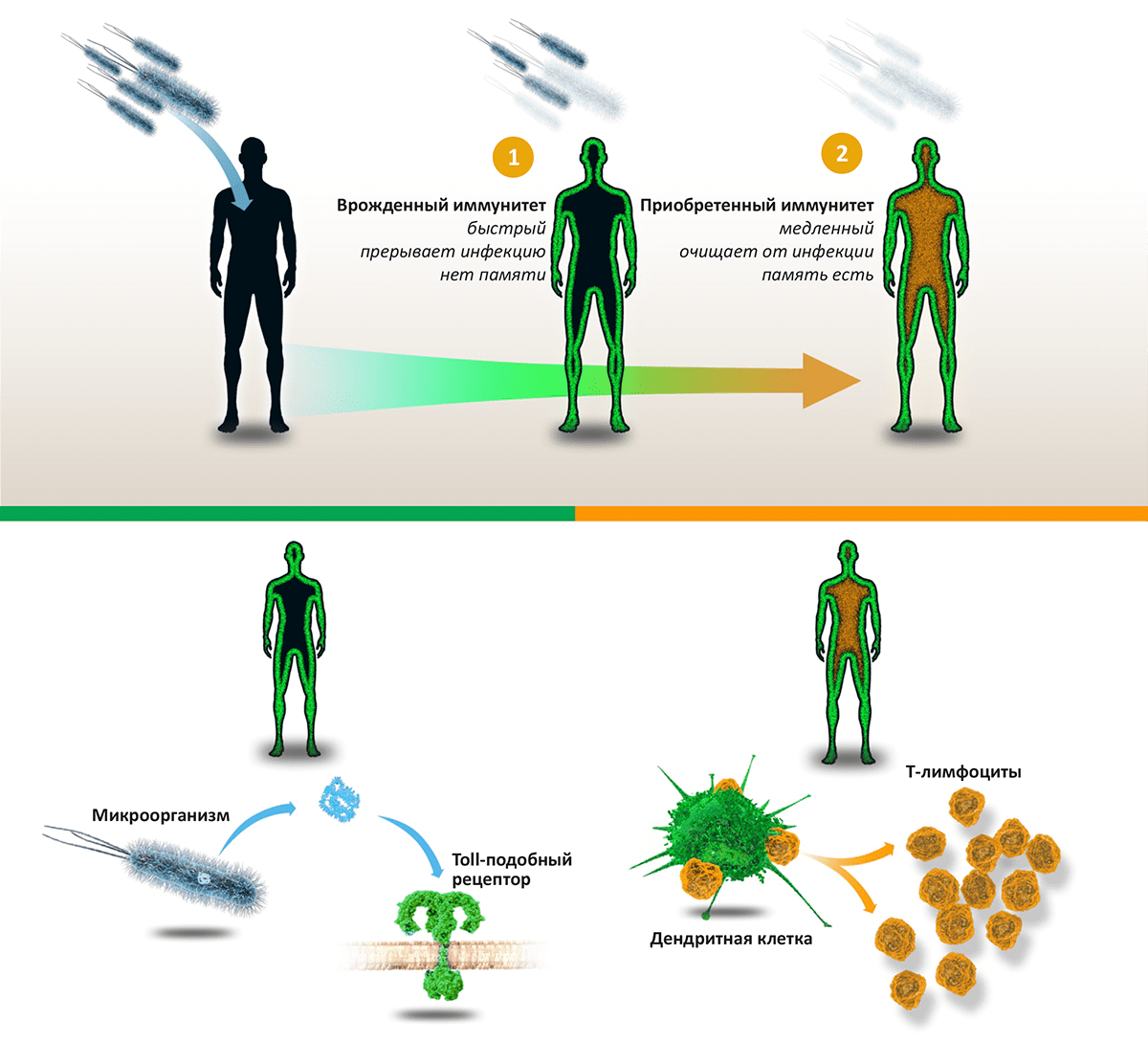
Рисунок 1. Схема работы иммунитета. Проникновение в тело человека патогенных микроорганизмов — бактерий, вирусов или грибов — активирует «две линии» иммунной реакции: врожденный иммунитет (останавливает инфекцию) и приобретенный иммунитет (выводит инфекцию из организма). Врожденный иммунитет: компоненты микроорганизмов, такие как липополисахарид, связываются с Toll-подобными рецепторами, находящимися на поверхности многих клеток организма. Это запускает врожденный иммунитет, активирующий воспалительную реакцию и уничтожающий «захватчиков». Приобретенный иммунитет: Дендритные клетки активируют T-лимфоциты, лежащие в основе каскада иммунных реакций, приводящих к синтезу антител и уничтожению патогенов и зараженных клеток.
Новый игрок в команде адаптивного иммунитета
Еще в 1973 году Ральф Стайнман открыл новый тип клеток иммунитета с длинными отростками, названный им дендритными клетками. Его предположение было — что эти клетки активируют T-лимфоциты, играющие ключевую роль в приобретенном иммунитете и иммунной памяти. Это предположение блестяще подтвердилось в клеточных экспериментах, где добавление дендритных клеток к популяции Т-лимфоцитов способствовало формированию иммунитета [3–5].
Дальнейшие работы Стайнмана и других исследователей были направлены на то, чтобы понять, как приобретенный иммунитет определяет, — надо ли реагировать на то или иное вещество, или можно этого не делать. Обнаружилось, что дендритные клетки воспринимают сигналы от системы врожденного иммунитета, и это управляет их способностью активировать T-клетки. Это позволяет нашему иммунитету прицельно бороться с патогенными микроорганизмами, «не обращая внимания» на молекулы нашего собственного тела.
Фундаментальные науки — медицине
Достижения нобелевских лауреатов 2011 года пролили свет на подробности работы систем врожденного и приобретенного иммунитета. Это знание легло в основу создания новых стратегий лечения многих болезней, — например, новых вакцин против инфекций и попыток «натравить» собственную иммунную систему на раковые опухоли. В дополнение к этому, стало понятно, почему организм иногда начинает атаковать свои собственные ткани, что приводит к воспалительным и аутоиммунным заболеваниям.
Горькая ирония
Как известно, Нобелевская премия не вручается посмертно. Однако этот год стал исключением: 30 сентября после продолжительной борьбы с раковой опухолью скончался Ральф Стайнман, — буквально за несколько дней до объявления лауреатов премии. Нобелевский комитет не знал об этом, и обнародовал свое решение 3 октября. Несмотря на этот печальный казус, решение менять не будут. Работы Стайнмана легли в основу терапии дендритными клетками — перспективного способа лечения воспалительных и онкологических заболеваний. К сожалению, самому ему оказалось суждено стать жертвой такого заболевания [6], [7].
И снова мимо!..
Сегодня интернет пестрит сообщениями, что опять — в который уже раз! — Нобелевский комитет обошел своим решением российских ученых. Речь идет о российском эмигранте Руслане Меджитове [8], который, вместе со своим (ныне уже покойным) учителем Чарльзом Дженуэем показал, что и у людей существуют Toll-подобные рецепторы [9]. Если бы Дженуэй был жив, то, скорее всего, именно он был бы третьим лауреатом премии (вместо Стайнмана), а сама премия была бы конкретно за врожденный иммунитет.
По материалам пресс-релиза Нобелевского комитета [10].
- Bruno Lemaitre, Emmanuelle Nicolas, Lydia Michaut, Jean-Marc Reichhart, Jules A Hoffmann. (1996). The Dorsoventral Regulatory Gene Cassette spätzle/Toll/cactus Controls the Potent Antifungal Response in Drosophila Adults. Cell. 86, 973-983;
- A. Poltorak. (1998). Defective LPS Signaling in C3H/HeJ and C57BL/10ScCr Mice: Mutations in Tlr4 Gene. Science. 282, 2085-2088;
- R. M. Steinman. (1973). IDENTIFICATION OF A NOVEL CELL TYPE IN PERIPHERAL LYMPHOID ORGANS OF MICE: I. MORPHOLOGY, QUANTITATION, TISSUE DISTRIBUTION. Journal of Experimental Medicine. 137, 1142-1162;
- R. M. Steinman, M. D. Witmer. (1978). Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice.. Proceedings of the National Academy of Sciences. 75, 5132-5136;
- G. Schuler. (1985). Murine epidermal Langerhans cells mature into potent immunostimulatory dendritic cells in vitro. Journal of Experimental Medicine. 161, 526-546;
- Нобелевскую премию присудили только что умершему от рака ученому. Но другого выбирать уже не будут. (2011). NewsRu;
- Воронин Е. (2011). Ральф Стайнман. shvarz.livejournal.com;
- Интервью с профессором Йельского университета Русланом Меджитовым;
- Ruslan Medzhitov, Paula Preston-Hurlburt, Charles A. Janeway. (1997). A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature. 388, 394-397;
- The Nobel Prize in Physiology or Medicine 2011. (2011). The Nobel Prize.
Днем в понедельник стало известно, что лауреатами Нобелевской премии по физиологии и медицине 2011 года стали американец Брюс Бойтлер и уроженец Люксембурга Жюль Хоффманн за их открытие в области врожденного иммунитета, а также родившийся в Канаде, но работающий в США Ральф Штайнман за открытие роли дендритных клеток в приобретенном иммунитете. Спустя несколько часов после объявления имен лауреатов стало известно, что Штайнман скончался в пятницу, 30 сентября. По данным университета Рокфеллера, где работал лауреат, четыре года назад Штайнману диагностировали рак поджелудочной железы, от которого он скончался за три дня до вручения премии.
Согласно уставу, Нобелевская премия не вручается посмертно. По словам представителя комитета Горана Ханссона, Нобелевский комитет не знал, что Штайнман мертв, когда выбирал его победителем премии.
Пока остается не ясным, будет ли менять Нобелевский комитет свое решение в связи со вновь открывшимся обстоятельством. Официальный сайт Нобелевской премии на данный момент ничего не сообщает о смерти Ральфа Штайнмана. «Газета.Ru» будет следить за развитием событий.
Пока же точно можно сказать, что половину премии в размере 10 млн шведских крон ($1,46 млн) поделят между собой американец Брюс Бойтлер и уроженец Люксембурга Жюль Хоффманн. Бойтлер родился в 1957 году в Чикаго. Он — профессор и председатель факультета генетики в исследовательском институте Скриппса в Ла-Хойя (Калифорния). Его отец, гематолог и медицинский генетик Эрнест Бойтлер также был профессором и председателем факультета в Скриппсе. Жюль Хоффманн родился в Люксембурге в 1941 году.
Ныне он гражданин Франции, в 2007–2008 годах возглавлял академию наук Франции. Он также является иностранным членом Российской академии наук.
Если Нобелевский комитет не изменит своего решения, то вторую половину премии, вероятно, получат наследники Ральфа Штайнмана. Он родился в 1943 году в Канаде, а работал в Университете Рокфеллера (Нью-Йорк). Штайнман – второй по цитируемости иммунолог в мире и лауреат Ласкеровской премии 2007 года.
«Сегодняшние лауреаты совершили революцию в изучении иммунитета, открыв ключевые принципы активации иммунной системы.
Благодаря их работам, сейчас мы совсем по-другому смотрим на изучение иммунитета, нам открылись новые возможности лечения, например, воспаления легких, рака и других заболеваний», — заявил представитель Нобелевского комитета после оглашения имен победителей.
Иммунитет человека — внутренняя система, которая защищает организм от воздействий внешней среды. У человека и родственных ему организмов существуют два типа иммунитета — врожденный и приобретенный. Врожденный иммунитет действует быстрее, обеспечивая борьбу с инфекцией на ранних этапах болезни, когда специфический, приобретенный иммунитет еще не сформировался. Соответственно, приобретенный иммунитет более эффективен, но ему нужно больше времени, чтобы очистить организм от инфекции.
Один из фундаментальных вопросов физиологии — как начинает работать иммунная система.
Прояснить работу врожденного иммунитета удалось Брюсу Бойтлеру и Жюлю Хоффманну. В 1996 году в своей работе Хоффманн обнаружил ген, который отвечает за иммунную реакцию при инфицировании грибковыми микроорганизмами. Брюс Бойтлер работал над этой же проблемой с другого «угла». Он изучал жизнедеятельность мышей и их реакцию на болезнетворные бактерии. В 1998 году он обнаружил ген, который отвечает за противостояние этим бактериям. Выяснилось, что ген, обнаруженный Бойтлером, соответствует гену, обнаруженному в более ранней работе его коллегой Хоффманном.
Таким образом, было найдено решение проблемы, над которой они работали.
Заслуга Ральфа Штайнмана состоит в том, что он еще в 1973 году заложил основы нового направления в иммунологии, объяснив роль дендритных клеток (тип клеток иммунной системы, имеющих длинные, похожие на щупальца или корни растений, ответвления, которыми они захватывают чужеродные объекты — примечание «Газеты.Ru») кожи, кишечного тракта и полости носа как первую линию защиты против некоторый бактерий. Работа ряда вакцин основана именно на стимуляции дендритных клеток. Они обладают очень причудливой формой, имеют длинные, похожие на щупальца, ответвления, которыми они захватывают чужеродные объекты. Штайман обнаружил, что эти клетки в присутствии инородных организмов могут активировать лимфоциты. «Штайман открыл путь к лучшему понимаю того, как происходит работа адаптивной иммунной системы», — подчеркивается в сообщении комитета.
Никто из трех лауреатов Нобелевской премии по физиологии и медицине 2011 года не входил в список авторитетного международного агентства Thomson Reuters (владельцы портала индексации научных публикаций Web of Science), которое ежегодно перед началом Нобелевской недели называет фаворитов в борьбе за научные премии.
В этом году в списке фаворитов Thomson Reuters в категории «физиология и медицина» присутствовало четыре направления. Так, премия могла быть вручена Брайану Друкеру (Орегонский университет здоровья и науки, США) вместе с Николасом Лидоном (Granite Biopharma, Висконсин, США) и Чарльзом Сойерсом (Мемориальный онкологический центр им. Слоуна-Кеттеринга, США), создавшим противоопухолевые препараты иматиниб и дазатиниб. Эти лекарства блокируют действие определенных белков, ответственных за быстрое деление раковых клеток, и весьма эффективны для направленного лечения хронического миелолейкоза — одной из разновидностей лейкоза. Это первый случай создания эффективного лекарства от данной формы рака. Другими кандидатами являлись Роберт Коффман (Dynavax Technologies, Беркли, США) и Тимоти Мосманн (Университет Рочестера, США), которые могли бы получить «Нобеля» за открытие двух типов Т-лимфоцитов (разновидность белых кровяных клеток) — так называемых Т-хелперов TH1 и TH2 — и изучение их роли в регуляции иммунного ответа.
Нынешнее решение Нобелевского комитета присудить премию за работы по иммунитету говорит о том, что Кофманн и Мосманн теперь не скоро получат своего «Нобеля».
Сходное направление работы и у Жака Милле (Университет Мельбурна, Австралия), который являлся претендентом на премию за открытие роли вилочковой железы (тимуса) в идентификации Т-клеток и В-клеток у млекопитающих. Наконец, за пионерские исследования в инженерии тканей и регенеративной медицине, проводимые с 70-х годов, премию могли бы получить Роберт Лангер (Массачусетский технологический институт, США) и Джозеф Ваканти (Гарвардская медицинская школа, США).
Год назад премию по физиологии и медицине получил британский ученый Роберт Эдвардс.
Награда ему была вручена за создание первого в мире «ребенка из пробирки» — то есть «за развитие области экстракорпорального оплодотворения».
Фаворитами же тогда назывались авторы работ по биологическим основам питания, возникновения аппетита и полноты Дуглас Коулман из лаборатории Джексона в Бар-Харбор (штат Мэн), а также Джеффри Фридман из Университета Рокфеллера (Нью-Йорк). В 1994 году в лаборатории Фридмана был открыт лептин — гормон, регулирующий энергетический обмен в организме человека, массу тела и насыщение при питании. В прошлом году также говорилось, что нобелевское жюри может отметить пионеров исследований стволовых клеток.
Что интересно, фаворитом в прошлом году назывался Ральф Штайнман, ставший лауреатом в нынешнем году.
Отечественные ученые Нобелевскую премию в области физиологии и медицины за всю ее историю получали дважды. В 1904 году лауреатом стал Иван Петрович Павлов (1849–1936) «в признание работ по физиологии пищеварения, изменивших и расширивших знания жизненно важных аспектов этого вопроса». Четыре года спустя Илья Ильич Мечников был награжден «в признание работ по иммунитету».
Во вторник будут объявлены лауреаты Нобелевской премии 2011 года по физике, в среду — по химии.
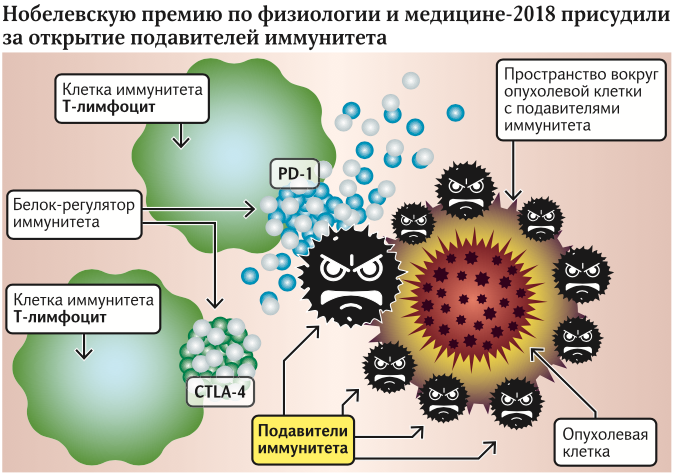
Вчера были названы лауреаты Нобелевской премии по физиологии и медицине. Ими стали иммунологи Джеймс Эллисон из США и Тасуку Хондзё из Японии. Почетным призом были отмечены работы ученых, касающиеся открытия механизма локального подавления иммунитета вокруг злокачественных опухолей. Пионерская работа Эллисона касалась открытия белка CTLA-4, а Хондзё параллельно открыл белок PD-1.
Открытия Джеймса Эллисона и Тасуку Хондзё касаются фундаментального вопроса, которым задавались врачи на всем протяжении изучения онкологических заболеваний. Понятно, что основным защитником организма в борьбе со злокачественными клетками является иммунитет. Каждый день в нашем организме возникают зачатки опасных опухолей, но иммунная система оперативно справляется с ними, поэтому мы и не догадываемся об их существовании. Диагноз «рак» ставят в случае, когда неожиданно одна из опухолей находит пути «взломать» защиту организма.
Длительное время у онкобольных пытались найти нарушение иммунитета — ведь понятно, что если опухоль растет, то иммунитет с ней не справляется. Однако все попытки найти системные нарушения иммунитета оказались неудачными.
Джеймс Эллисон и Тасуку Хондзё установили потрясающий факт: опухоль в стадии роста способна сама выделять иммуносупрессоры, то есть ограничители иммунитета. Поэтому на уровне организма эффекты падения защиты увидеть нельзя, а рядом с опухолью — можно.
По словам руководителя отдела биологии опухолевого роста НИИ онкологии им. Н.Н. Петрова, заведующего кафедрой медицинской генетики Санкт-Петербургского педиатрического университета, профессора кафедры онкологии Северо-Западного медицинского университета им. И.И. Мечникова Евгения Имянитова, это действительно один из самых значительных прорывов онкологии в понимании механизмов вовлечения иммунитета.

— Как мы знаем, онкологию лечат при помощи хирургического вмешательства, облучения и химиотерапии. Открытие нобелевских лауреатов привело к появлению четвертого столпа в борьбе с раком — работы с иммунитетом. Благодаря этому открытию были разработаны лекарства, которые снижают активность иммуносупрессоров и приводят к уменьшению опухоли, — отмечает эксперт.
Исследования белков СTLA-4 и PD-1 велись почти 30 лет. В настоящий момент получены лекарства, которые подавляют локальную защиту опухоли, вынуждая иммунитет работать в обычном режиме. Как считает руководитель лаборатории геномной инженерии МФТИ Павел Волчков, это говорит о том, что в будущем с раком будет бороться иммунитет человека, а не химиотерапия, которая убивает и «своих» и «чужих».
В настоящий момент, по словам научного сотрудника лаборатории молекулярной иммунологии и вирусологии НИЦ «Курчатовский институт» Сергея Крынского, разрабатываются и внедряются различные подходы к стимулирующей иммунотерапии у онкологических больных, основанные на природоподобных технологиях направленной активации иммунных клеток больного.
— В их числе, например, метод противоопухолевой вакцинации, основанный на введении в организм фрагментов белков опухоли для стимуляции иммунного ответа на нее. Другой современный метод — это использование собственных лимфоцитов пациента, обработанных в лабораторных условиях биологически активными веществами, лимфокинами, и затем возвращенных в организм для эффективной атаки на опухоль (метод лимфокин-активированных киллеров, или ЛАК-терапия). Эффективное применение этих методов было бы невозможным без открытий Джеймса Эллисона и Тасуку Хондзё.
Академик РАН, заведующий лабораторией молекулярных механизмов иммунитета Института молекулярной биологии им. В.А. Энгельгардта РАН и заведующий кафедрой иммунологии биологического факультета МГУ им. М.В. Ломоносова Сергей Недоспасов считает нынешнее присуждение одним из самых справедливых в недавней истории этой премии.
— Я лично хорошо знаю и Джеймса Эллисона, и Тасуку Хондзё. Почти 30 лет назад они открыли важные молекулы, которые участвуют в сигнальных каскадах иммунной системы. Потом они установили, что речь идет о молекулярных тормозах для Т-лимфоцитов. А потом оказалось, что именно эти молекулы могут стать мишенью для лекарств при борьбе с опухолями. Однако не стоит думать, что эти очень важные и наукоемкие лекарства станут панацеей. Это просто еще один важный инструмент для онкологов. И нужно понимать, что он работает не на всех видах рака, не на всех пациентах и имеет побочные действия, — подчеркнул Сергей Недоспасов.
Побочные эффекты связаны с тем, что лекарства отключают механизм, блокирующий аутоиммунные заболевания. Но так как они развиваются долго и только в редких случаях приводят к смерти, этот риск считается приемлемым для онкологического пациента. Поэтому российские производители также приступили к созданию лекарств на основе антител к PD-1 и CTLA-4.
Компания Biocad с 2013 года разрабатывает препараты против меланомы, один из которых уже близок к выходу на рынок.
— Решение работать с этими белками было принято еще в 2013 году, когда появились самые первые результаты клинических исследований при использовании антител к PD-1, показавшие прорывные результаты на меланоме, — рассказал вице-президент компании по исследованиям и разработкам Роман Иванов. — Сейчас мы понимаем, что самый лучший терапевтический эффект можно достигнуть при совмещении этих двух антител. Препарат от меланомы на основе антител к PD-1 будет подан в ближайшее время на регистрацию в Минздрав. В первой половине 2019 года препарат появится на российском рынке. Потом мы планируем провести испытания этого же препарата при раке легкого и раке шейки матки. А вот препарат, в котором два антитела будут применяться вместе, поступит на рынок через два-три года.
Понятно, что созданные на основе антител лекарства будут иметь высокую стоимость. Поэтому, прежде чем их применять, нужно убедиться в эффективности их воздействия на конкретного пациента. Для этого в Курчатовском институте разработан метод OncoBox, позволяющий подобрать онкологическому больному наиболее эффективное лечение на основе генного анализа раковой опухоли.
Технология OncoBox уже проходит клинические испытания. Ученые рассчитывают, что через два года начнется ее использование в больницах. OncoBox позволяет исследовать индивидуальную реакцию пациента на прием лекарств — в частности, какой препарат можно использовать для эффективного лечения поздней стадии рака. Анализ предполагает взятие образца опухоли и исследование более 2 тыс. его генов. После этого тест OncoBox сымитирует воздействие 140 целевых препаратов на раковую опухоль, а специалисты оценят эффективность лекарств для конкретного больного.
