Противовирусный иммунитет механизм развития

Глава 16. Противовирусный иммунитет
ЗАЩИТНЫЕ МЕХАНИЗМЫ С УЧАСТИЕМ Т- И В-КЛЕТОК
При отсутствии Т-клеток организм-хозяин весьма восприимчив к атакам вирусов. Так, у бестимусных мышей (мыши nude — голые, или бесшерстные) с врожденным отсутствием зрелых Т-клеток вирус простого герпеса (HSV, от herpes simplex virus), введенный в кожу, вызывает распространяющееся поражение и в конце концов, проникая в центральную нервную систему, гибель животных. Чтобы защитить этих мышей, достаточно вскоре после заражения перенести им HSV-специфичные Т-клетки. Важное значение Т- и В-клеток, противодействующих вирусным инфекциям, будет рассмотрено ниже.
Антитела и комплемент способны ограничить распространение вируса и предотвратить повторную инфекцию
Антитела могут нейтрализовать инфекционность вирусов. Если вирусу удается преодолеть барьеры врожденного иммунитета, он вызывает развитие адаптивного (специфического) иммунного ответа с появлением цитотоксических Т-клеток, хелперных Т-клеток и противовирусных антител. Антитела служат главным препятствием для распространения вируса в другие клетки и ткани, особенно для проникновения его в кровоток. В лимфоидной ткани слизистых оболочек образуются преимущественно антитела класса IgA, предотвращающие повторную инфекцию.
Антитела могут быть направлены против любого вирусного антигена, синтезируемого в инфицированной клетке, однако сдерживание инфекции обеспечивают только те из антител, которые специфичны к гликопротеинам, экспрессированным на оболочке вирусов иди на мембране инфицированных клеток. Механизмы гуморального противовирусного иммунитета могут быть различными. Так, способ устранения инфекционности вирусных частиц зависит от их локализации — внеклеточной или внутриклеточной (рис. 16.5). О действии in vivo защитных механизмов, перечисленных на рис. 16.5, свидетельствует то, что инъекция моноклональных вирус-нейтрализующих антител весьма эффективно угнетает репродукцию вирусов. Присутствие в кровотоке нейтрализующих вирус антител — это и важный фактор предотвращения повторной инфекции.
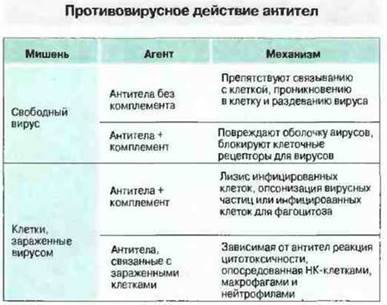
Рис. 16.5. Антитела нейтрализуют свободные вирусные частицы или участвуют в разрушении инфицированных вирусами клеток.
Комплемент участвует в нейтрализации внеклеточных вирусов некоторых видов. Комплемент также способен повреждать оболочку вируса — осуществлять виролиз. Некоторые вирусы непосредственно вызывают активацию комплемента по классическому или альтернативному пути. Тем не менее комплемент не рассматривают как главный фактор защиты против вирусов, поскольку при недостаточности компонентов системы комплемента не отмечено предрасположенности к тяжелым вирусным инфекциям у человека.
Антитела мобилизуют комплемент и/или эффекторные клетки для разрушения инфицированных вирусами клеток организма. Действие антител, помимо нейтрализации внеклеточных вирусов, состоит в том, что они вызывают разрушение инфицированных вирусами клеток, активируя систему комплемента. В результате его активации происходит сборка лизирующего мембрану комплекса и лизис зараженных клеток (см. гл. 4). Комплемент-зависимый цитолиз возможен лишь при высокой плотности экспрессии вирусных антигенов па клеточной мембране (примерно 5 х 106на клетку). В противоположность этому, для лизиса по механизму АЗКЦ необходимо присутствие на поверхности клетки-мишени лишь 103 молекул IgG — такое количество обеспечивает связывание с ней НК-клеток. Эти клетки связываются с нагруженной антителами мишенью через FcγRIII (CD16) и быстро разрушают ее посредством перфоринов (см. гл. 10). Насколько важен in vivo каждый из этих механизмов, пока трудно понять. Лучшее доказательство в пользу АЗКЦ получено на мышах при изучении защитного эффекта противовирусных моноклональных антител; не проявляя нейтрализующей активности in vitro, они оказались способны защитить С5-дефицитных животных при введении им высокой дозы вируса. (Эта линия мышей была использована для того, чтобы исключить антивирусный эффект терминальных компонентов системы комплемента.)
Т-клетки участвуют в формировании и действии противовирусного иммунитета несколькими путями
В иммунитете к вирусным инфекциям Т-клетки выполняют разнообразные функции. Образование антител в ответ на большинство антигенов зависит от тимуса, поскольку для переключения изотипа и созревания аффинности необходимо участие Т-клеток CD4+. Кроме того, эти клетки помогают в индукции цитотоксических Т-клеток CD8+, а также в привлечении макрофагов в очаг вирусной инфекции и в их активации.
Цитотоксические Т-клетки CD8+. Это главная Т-клеточная система для осуществления в организме противовирусного иммунологического надзора, и действует она весьма эффективно и избирательно. Цитотоксические Т-клетки CD8+, рестриктированные по антигенам МНС класса I, скапливаются в очагах размножения вирусов и разрушают инфицированные ими клетки. Данный механизм иммунологического надзора, по-видимому, весьма важен, так как фактически все клетки тела экспрессируют молекулы МНС класса I.
Процессинг и презентация вирусных белков. Вероятно, любой вирусный белок может быть процессирован в цитоплазме АПК с образованием пептидов, которые затем транспортируются к эндоплазматическому ретикулуму и ассоциируют с молекулами МНС класса I. Для организма-хозяина это создает определенные преимущества, так как белки вируса, экспрессируемые клеткой в начале цикла его размножения, становятся доступными для Т-клеточного распознавания задолго до появления нового поколения вирусных частиц. Например, Т-клеточный иммунитет к цитомегаловирусной инфекции у мыши специфичен в отношении наиболее раннего вирусного белка рр89. Его протективный эпитоп определен как пептид Lb, состоящий из девяти аминокислотных остатков и презентируемый молекулой МНС класса I. Иммунизация мышеи рекомбинантным вирусом коровьей оспы, несущим ген рр89, полностью защищает их от инфекции CMV. Делеция участка ДНК, кодирующего нано-пептид Ld, лишает белок рр89, экспрессируемый вирусом коровьей оспы, протективной активности.
Важность Т-клеточных механизмов в противовирусном иммунитете in vivo установлена различными способами:
• путем адоптивного переноса антигенспецифичных субпопуляций или клонов Т-клеток зараженным животным для проверки на способность устранения вируса;
• на животных, лишенных Т-клеток CD4+или CD8+путем введения специфических моноклональных антител, и
• на мышах, избирательно лишенных эмбриональных генов CD4, CD8 и β2-микроглобулина методом генного нокаута.
Как установлено, мыши, лишенные методом генного нокаута определенных субпопуляций лимфоцитов, сохраняют способность к иммунному ответу на вирусную инфекцию. Можно рассматривать это как хорошую иллюстрацию многократного функционального дублирования, вероятно свойственного иммунной системе. Например, Т-клетки CD4+в отсутствие Т-клеток CD8+могут компенсировать иммунологическую недостаточность и устранять инфекцию.
Т-клетки CD4+ способны выполнять важные эффекторные функции в иммунном ответе на вирусную инфекцию. В иммунном ответе на инфекцию эпителиальных покровов, вызванную вирусом простого герпеса I типа (HSV-I), главной эффекторной клеточной популяцией служат Т-клетки CD4+. Они, как и в реакциях гиперчувствительности замедленного типа (см. гл. 26), мобилизуют и привлекают макрофаги, и эго ускоряет ликвидацию вируса. Макрофаги служат важными участниками этого процесса (рис. 16.6). В качестве ключевых цитокинов в ответе на герпесвирусную инфекцию действует ИФγ, необходимый для активации моноцитов, и фактор некроза опухолей (ФИО), оказывающий ряд противовирусных эффектов, сходных с эффектами ИФγ, но осуществляемых иными путями.

Рис. 16.6. При кожной герпесвирусной (HSV) инфекции в качестве защитных факторов действуют Т-клетки СD4+, макрофаги и ИФγ. Т-клетки CD4+получали от мышей, зараженных HSV за 8 сут до опыта, и переносили сингенным мышам, вскоре после этого зараженным HSV внутрикожно. Одной группе этих мышей вводили антитела к CR3 (чтобы блокировать миграцию макрофагов в место заражения), другой — антитела к ИФγ (чтобы блокировать активацию макрофагов), остальные животные служили контролем. Мышей дополнительной контрольной группы заражали, но не переносили им Т-клетки CD4+. Через 5 сут после заражения определяли количество оставшегося инфекционного вируса. Результаты показывают, что протективный эффект Т-клеток CD4+реализуется при участии макрофагов и ИФγ.
Цитотоксические Т-клетки CD4+. При заражении вирусом кори в организме образуются цитотоксические Т-клетки CD4+, которые распознают и лизируют инфицированные вирусом клетки-мишени, экспрессирующие молекулы МНС класса II. Это указывает, что процессинг и презентация антигенов вируса кори происходят обычным способом — путем фагоцитоза и расщепления (см. гл. 9). Однако существует, предположительно, и другой, еще неизвестный механизм, посредством которого белки или пептиды вируса кори перемещаются из цитозоля в везикулы класса II.
Защитные противовирусные механизмы обобщенно представлены на рис. 16.7, а динамика их индукции — на рис. 16.8.

Рис. 16.7. Проникновению вирусов в клетки слизистой оболочки препятствуют антитела IgA. После первоначального инфицирования вирус может поражать и другие ткани, распространяясь с кровью. Интерфероны, образующиеся как факторы врожденного (ИФα и ИФβ) и приобретенного (ИФγ) иммунитета, делают близлежащие клетки устойчивыми к инфицированию распространяющимся вирусом. Антитела нужны для устранения свободных вирусных частиц, а Т- и НК-клетки — для разрушения инфицированных вирусом клеток-мишеней. (АЗКЦ — антителозависимая клеточноопосредованная цитотоксичность.)

Рис. 16.8. Динамика обнаружения факторов иммунитета при ответе на типичную вирусную инфекцию. После заражения вирусом (например, гриппа или герпеса) в крови и в инфицированных тканях раньше всего выявляются НК-клетки и интерферон. Затем в регионарных лимфоузлах или селезенке обнаруживаются активированные цитотоксические Т-клетки (Тц). После этого в сыворотке начинают определяться нейтрализующие вирус антитела. Активированные цитотоксические Т-клетки исчезают уже на второй или третьей неделе, но им на смену появляются Т-клетки иммунологической памяти, способные сохраняться многие годы.
Механизмы иммунитета:
механизм клеточного иммунитета (фагоцитоза);
механизм гуморального иммунитета (образование комплекса антиген-антитело)
Фагоцитоз
В конце XIX века русский биолог И. И. Мечников в период своей работы в Институте Пастера (Париж) занимался изучением роли клеток в осуществлении иммунных реакция.
Фагоцитоз, процесс поглощения чужеродного материала, является защитной реакцией, для которой не требуется специфичности, характерной для синтеза антител. С точки зрения эволюции, это — самый древний механизм защиты, присущий всем живым организмам, начиная с простейших.
Мечников изучал фагоцитоз на морских беспозвоночных (губках и кишечнополостных), наблюдая, как подвижные амёбовидные клетки поглощают частицы угля, попавшие в организм.
Оказалось, что открытое И. И. Мечниковым явление свойственно и человеку. Именно фагоцитоз и осуществляющие его клетки иммунной системы — нейтрофилы и Т-лимфоциты — осуществляют клеточный неспецифический иммунитет.
Фагоциты способны связывать микроорганизмы и антигены на своей поверхности, а затем поглощать и уничтожать их. Эта функция основана на простых механизмах распознавания, позволяющих связывать самые разнообразные микробные продукты, и относится к проявлениям врождённого иммунитета (рис. 1).

Рис. 1. Механизм клеточного иммунитета
Механизм воспалительной реакции
Клетки крови и соединительной ткани участвуют в защитной неспецифической реакции на любое повреждение или внедрение инородного тела. В данной иммунной реакции участвуют тучные клетки (тканевые базофилы).
Они выделяют гистамин и гепарин, которые вызывают повышение проницаемости стенки капилляров. Расширяются капилляры, усиливается кровоток (гиперемия).
Лейкоцитарная фаза воспалительной реакции. Нейтрофилы в большом количестве выходят из кровеносных сосудов в зону повреждения. Они образуют вокруг инородного тела лейкоцитарый вал (через 5-6 часов). Нейтрофилы фагоцитируют микроорганизмы, токсические вещества и быстро погибают.
Макрофагическая фаза воспалительной реакции. Моноциты выходят из кровеносных сосудов в зону повреждения — в ткань и превращаются в макрофаги. Образовавшиеся макрофаги мигрируют в зону вала и там фагоцитируют разрушенные, погибшие клетки, инородные частицы и погибших нейтрофилов.
Фибробластическая фаза воспалительной реакции. Фибробласты (клетки соединительной ткани) активно деляться в зоне воспаления. Они образуют коллагеновые волокна, которые выталкивают инородное тело на поверхность, или формируют вокруг него соединительнотканную капсулу, отграничивающую его от окружающей ткани.
Механизм гуморального иммунитета
В настоящее время известно, что B-лимфоциты программируются в кроветворной (миелоидной) ткани костного мозга, а T-лимфоциты — в корковом веществе тимуса. В процессе программирования на плазмалемме появляются белки-рецепторы, комплементарные определенному антигену. Связывание данного антигена с рецептором вызывает каскад реакций, которые приводят к пролиферации (делению) данной клетки и образованию множества потомков, реагирующих только с данным антигеном. Одним из важнейших свойств иммунной системы является иммунологическая память.
Гуморальный иммунитет состоит из следующей цепочки реакций:
В-лимфоцит распознает поверхностными рецепторами специфические антигены (определенные бактерии, вирусы и т. п.).
При участии Т-лимфоцита-хелпера В-лимфоцит преобразуется в плазматическую клетку (плазмоцит) и клетку памяти (рис. 2).
Клетка памяти при повторном вторжении данного антигена будет вызывать очень мощный вторичный иммунный ответ, противостоящий повторному заболеванию.
Плазмоцит несет на клеточной мембране антигенспецифичные рецепторы, которые при контакте с конкретным антигеном превращаются в антитела.
Антитела специфично контактируют с антигеном, образуя комплекс антиген-антитело (иммунный комплекс).
Далее возможно несколько вариантов событий:
дезактивация антигенов (например, лишение бактерий подвижности, растворение клеточной стенки бактерии и т. п.);
слипание антигенов;
осаждение растворимых антигенов (если комплекс антиген-антитело нерастворим);
изменение конформации антигена и потеря его химической активности (например, обезвреживание токсинов);
привлечение фагоцитов для поглощения антигенов.
Рис. 2. Механизм гуморального иммунитета
Для реализации иммунного ответа недостаточно лишь Т- и В-лимфоцитов. Согласно современной трехклеточной схеме кооперации образование антител осуществляется благодаря совместной функции макрофага, T- и B- лимфоцитов. При этом макрофаг передает антиген В-лимфоциту, но лишь после воздействия T-хелперного фактора лимфоцит начинает размножаться и дифференцироваться в плазматическую клетку.
Ãëàâà 49
Îñîáåííîñòè ïðîòèâîâèðóñíîãî èììóíèòåòà
 îñíîâå íåêîòîðûõ ñóùåñòâåííûõ ðàçëè÷èé ìåõàíèçìîâ çàùèòû îðãàíèçìà îò âèðóñîâ è áàêòåðèé ëåæàò îñîáåííîñòè áèîëîãèè ýòèõ âîçáóäèòåëåé.
 çàùèòå îðãàíèçìà îò âèðóñîâ ó÷àñòâóþò âñå ñèñòåìû èììóíèòåòà, îäíàêî ïðîòèâîâèðóñíûé èììóíèòåò èìååò ñóùåñòâåííûå ñïåöèôè÷åñêèå ÷åðòû. Îíè îïðåäåëÿþòñÿ òåì, ÷òî â ïåðâóþ î÷åðåäü íà ïðîíèêíîâåíèå âèðóñà â îðãàíèçì ðåàãèðóþò íå ñèñòåìû êîìïëåìåíòà è ìàêðîôàãîâ, à ñèñòåìû èíòåðôåðîíîâ è Ò-êèëëåðíûõ êëåòîê. Äðóãàÿ îñîáåííîñòü ôîðìèðîâàíèÿ èììóíèòåòà ñâÿçàíà ñ òåì, ÷òî âèðóñû îêàçûâàþò ñëàáîå àíòèãåííîå âîçäåéñòâèå íà Â-ëèìôîöèòû è äëÿ èõ àêòèâèðîâàíèÿ, ïðîëèôåðàöèè è äèôôåðåíöèðîâêè íåîáõîäèìî ó÷àñòèå Ò-õåëïåðîâ è ñîîòâåòñòâåííî ïðåäñòàâëåíèå ïîñëåäíèì ïðîöåññèðîâàííîãî âèðóñíîãî àíòèãåíà (ïåïòèäíûõ ôðàãìåíòîâ) ïðè ó÷àñòèè ìîëåêóë ÌÍÑ êëàññà II. Ïîýòîìó ðîëü ìàêðîôàãîâ è äðóãèõ àíòèãåíïðåäñòàâëÿþùèõ êëåòîê çàêëþ÷àåòñÿ íå ñòîëüêî â ñàìîì ôàãîöèòîçå, ñêîëüêî â ïðîöåññèðîâàíèè è ïðåäñòàâëåíèè àíòèãåíà.
Åùå îäíà îñîáåííîñòü ïðîòèâîâèðóñíîãî èììóíèòåòà îáóñëîâëåíà ñòðóêòóðíîé îðãàíèçàöèåé íåêîòîðûõ âèðèîíîâ. Âèðóñû ìîãóò âûçâàòü çàáîëåíèå ëèøü â òîì ñëó÷àå, åñëè ïðîíèêàþò â êëåòêó. Äëÿ ïðèêðåïëåíèÿ ê íåé îíè èñïîëüçóþò êëåòî÷íûå ðåöåïòîðû, êîòîðûå êëåòêà èñïîëüçóåò äëÿ ñîáñòâåííûõ ôèçèîëîãè÷åñêèõ öåëåé. Âñå èäåíòèôèöèðîâàííûå âèðóññïåöèôè÷åñêèå ðåöåïòîðû ãëèêîïðîòåèäû èëè ñèàëîãëèêîëèïèäû. Âèðóñ «óçíàåò» ñïåöèôè÷åñêèå ðåöåïòîðû è ïðèêðåïëÿåòñÿ ê íèì ñ ïîìîùüþ ñâîèõ ïðèêðåïèòåëüíûõ áåëêîâ VAP (àíãë. virion attachment proteins). Èìåííî îíè èãðàþò ðîëü ñâîåîáðàçíûõ ëîöìàíîâ, íàïðàâëÿþùèõ äâèæåíèå âèðóñà â êëåòêó. Ó íåêîòîðûõ âèðóñîâ ìîëåêóëû ýòèõ áåëêîâ-ëîöìàíîâ ðàñïîëîæåíû â ñêðûòûõ ìåñòàõ «ùåëÿõ», «êàíüîíàõ», ò. å. óãëóáëåíèÿõ íà ïîâåðõíîñòè âèðèîíà. Èõ äèàìåòð (ãëóáèíà) ó âèðóñîâ ãðèïïà, ïîëèîìèåëèòà, ÂÈ× íå ïðåâûøàåò 2,5 íì. Äèàìåòð æå àêòèâíîãî öåíòðà ìîëåêóëû àíòèòåëà ñîñòàâëÿåò 3,5 íì, ïîýòîìó àíòèòåëî íå ìîæåò ñâÿçàòüñÿ ñ áåëêîì-ëîöìàíîì âèðóñà è áëîêèðîâàòü åãî.  ðåçóëüòàòå âèðóñíåéòðàëèçóþùàÿ àêòèâíîñòü àíòèòåë îñëàáëÿåòñÿ. Íà ïðîíèêíîâåíèå âèðóñà ðàíüøå âñåãî ðåàãèðóåò ñèñòåìà èíòåðôåðîíîâ, êîòîðûå ïîäàâëÿþò âíóòðèêëåòî÷íîå ðàçìíîæåíèå âèðóñîâ. Êðîìå òîãî, ïðîòèâîâèðóñíîå äåéñòâèå îêàçûâàþò íàõîäÿùèåñÿ â ñûâîðîòêå êðîâè ? è ?-èíãèáèòîðû. Àëüôà-èíãèáèòîð òåðìîñòàáèëüíûé ñóáñòðàò, âõîäèò â ñîñòàâ ?-ãëîáóëèíîâ, ïðåïÿòñòâóåò àäñîðáöèè âèðóñîâ íà êëåòêå, ðàçðóøàåòñÿ íåéðàìèíèäàçîé îðòî è ïàðàìèêñîâèðóñîâ. Áåòà-èíãèáèòîð òåðìîëàáèëüíûé ìóêîïåïòèä, âõîäèò â ñîñòàâ ?-ãëîáóëèíîâ, ïîäàâëÿåò ðàçìíîæåíèå îðòî è ïàðàìèêñîâèðóñîâ.
Îäíàêî èíòåðôåðîíîâ è èíãèáèòîðîâ îêàçàëîñü íåäîñòàòî÷íî äëÿ çàùèòû îò âèðóñîâ, ïîýòîìó ïðèðîäà ñîçäàëà ïðîòèâ âèðóñîâ äðóãîé, î÷åíü ìîùíûé ìåõàíèçì çàùèòû íà óðîâíå îðãàíèçìà. Îí ïðåäñòàâëåí ïðåæäå âñåãî Ò-öèòîòîêñè÷åñêèìè ëèìôîöèòàìè è äðóãèìè êèëëåðíûìè êëåòêàìè. Ýòè êëåòêè ðàñïîçíàþò âñå ÷óæåðîäíûå àíòèãåíû, â òîì ÷èñëå è âèðóñíûå, ïðåäñòàëÿåìûå èì ìîëåêóëàìè ÌÍÑ êëàññà I. Ãëàâíîå áèîëîãè÷åñêîå çíà÷åíèå Ò-êèëëåðíûõ êëåòîê è çàêëþ÷àåòñÿ â îáíàðóæåíèè è óíè÷òîæåíèè ëþáûõ êëåòîê, èíôèöèðîâàííûõ ÷óæåðîäíûìè àíòèãåíàìè.
Ñèíòåç àíòèòåë ñâÿçàí, â ñâîþ î÷åðåäü, ñ ñèñòåìîé ôàãîöèòîâ,  è Ò-ëèìôîöèòîâ è ÌÍÑ. Â-ëèìôîöèòû ñ ïîìîùüþ èììóíîãëîáóëèíîâûõ ðåöåïòîðîâ ðàñïîçíàþò ñîîòâåòñòâóþùèé àíòèãåí è îòâå÷àþò íà íåãî ñèíòåçîì ðåöåïòîðîâ, íåîáõîäèìûõ äëÿ ðàñïîçíàâàíèÿ ñèãíàëîâ îò Ò-õåëïåðîâ. Àêòèâèðîâàííûå Ò-õåëïåðû ñèíòåçèðóþò è ñåêðåòèðóþò ôàêòîðû àêòèâàöèè, ïðîëèôåðàöèè è äèôôåðåíöèàöèè Â-ëèìôîöèòîâ.  ðåçóëüòàòå èõ äåéñòâèÿ èç àêòèâèðîâàííûõ Â-ëèìôîöèòîâ ôîðìèðóþòñÿ êëîíû àíòèòåëîîáðàçóþùèõ êëåòîê è êëåòîê ïàìÿòè (ñîîòâåòñòâåííî âîçíèêàþò è êëîíû êëåòîê ïàìÿòè Ò-ëèìôîöèòîâ).
Çàùèòíàÿ ðîëü àíòèòåë â ïðîòèâîâèðóñíîì èììóíèòåòå ñîñòîèò ãëàâíûì îáðàçîì â òîì, ÷òî îíè, âçàèìîäåéñòâóÿ ñ âèðóñíûìè ðåöåïòîðàìè, èñêëþ÷àþò âîçìîæíîñòü àäñîðáöèè âèðóñîâ íà ìåìáðàíå êëåòîê è òàêèì îáðàçîì íåéòðàëèçóþò èõ àêòèâíîñòü, äåëàþò íåâîçìîæíûì ïðîíèêíîâåíèå âèðóñà â êëåòêó. Òîëüêî òàêèì ïóòåì, ò. å. èñêëþ÷àÿ âîçìîæíîñòü ïðîíèêíîâåíèÿ âèðóñà â êëåòêó, àíòèòåëà îáåñïå÷èâàþò ôîðìèðîâàíèå ïðèîáðåòåííîãî èììóíèòåòà. Ïðèîáðåòåííûé ïðîòèâîâèðóñíûé èììóíèòåò ïðè íàëè÷èè ïîñòîÿííûõ êëîíîâ êëåòîê ïàìÿòè ìîæåò ñîõðàíÿòüñÿ ïîæèçíåííî. Ïîìèìî ñïîñîáíîñòè íåéòðàëèçîâàòü âèðóñû, àíòèòåëà âûïîëíÿþò áîëüøóþ ðîëü â îñâîáîæäåíèè îðãàíèçìà îò âèðóñîâ è âèðóñíûõ àíòèãåíîâ. Ñâÿçûâàÿñü ñ íèìè, àíòèòåëà îáðàçóþò èììóííûå êîìïëåêñû, êîòîðûå âûâîäÿò ýòè àíòèãåíû èç îðãàíèçìà. Ýôôåêòèâíîñòü àíòèòåë â ôîðìèðîâàíèè ïðèîáðåòåííîãî èììóíèòåòà ïðîòèâ âèðóñíûõ èíôåêöèé ïîäòâåðæäåíà ìíîãîëåòíåé ïðàêòèêîé ñïåöèôè÷åñêîé ïðîôèëàêòèêè ïîëèîìèåëèòà, êîðè, æåëòîé ëèõîðàäêè, äðóãèõ èíôåêöèé è ïîëíîé ëèêâèäàöèåé íà Çåìëå íàòóðàëüíîé îñïû.
Âìåñòå ñ òåì ñàìè ïî ñåáå âèðóñû ìîãóò ñòàòü ïðè÷èíîé âòîðè÷íûõ èììóíîäåôèöèòîâ. Òèïè÷íûì ïðèìåðîì òàêîãî âèðóñíîãî èììóíîäåôèöèòà ÿâëÿåòñÿ ÂÈ×-èíôåêöèÿ (ñì. ãëàâó 57).
