Вакцины для создания активного антитоксического иммунитета
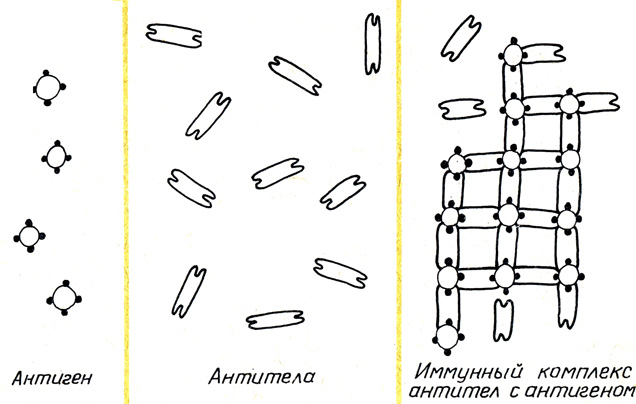
Препараты для иммунопрофилактики и иммунотерапии инфекционных заболеваний делятся на:
1) вакцины и анатоксины – для индукции специфического иммунного ответа с формированием активного противоинфекционного иммунитета за счет мобилизации механизмов иммунологической памяти;
2) иммунные сыворотки и Ig – содержат готовые специфические АТ (Ig), введение которых в Ò приводит к немедленному приобретению пассивного гуморального иммунитета, способного защитить организм от интоксикации или инфекции.
ВАКЦИНЫ (Э. Дженнер, Л. Пастер) – биопрепараты, предназначенные для создания активного искусственного иммунитета. Делятся на живые, убитые, химические, анатоксины и ассоциированные. Готовят т/же аутовакцины – из штаммов мкÒ, выделенных непосредственно из Ò чка.
ЖИВЫЕ ВАКЦИНЫ создают напряженный иммунитет, сходный с постинфекционным. Готовятся из АТТЕНУИРОВАННЫХ штаммов (т.е. вирулентные свойства утрачены, но при введении в Ò способны прижиться и вызвать выработку ВСЕХ ВИДОВ иммунитета). В большинстве случаев достаточно однократной вакцинации живой вакциной, т.к. вакцинный штамм может размножаться и персистировать в Ò. Применение живых вакцин опасно для людей (особенно детей) с врожденными или приобретенными иммунодефицитными состояниями → тяжелые инфекционные осложнения. Для получения используют следующие методы:
1) селекционный метод, направленный на выращивание мкÒ в неблагоприятных условиях отбор микробов со ↓ вирулентностью – классический метод получения живых вакцин (Пастер – сиб язва).
2) Адаптация мкÒ к Ò невосприимчивого Ж! или пассирование через ткани и органы, к/е не являются входными воротами для данного мкÒ.
3) Отбор мутантных штаммов со ↓ вирулентностью, выделенных из природы.
4) Методы генной инженерии.
УБИТЫЕ ВАКЦИНЫ готовят из мкÒ, обладающих максимально выраженной иммуногенностью. Их выращивают (на биопредприятиях), затем инактивируют t°С (55-60° в течение 1часа), УФ или хим в-вами (формалин, фенол, спирт и др) в условиях, исключающих денатурацию антигенов. Для профилактики – брюшного тифа, паратифов А и В, коклюша, бруцеллёза, лептоспироза… Для лечения – при вялотекущих и хронических инфекциях: бруцеллёз, туляремия, дизентерия, гоноррея, коклюш… Убитые вакциины создают ненапряжённый иммунитет.
Аттенуированный или убитый возбудитель – это множество различных АГ детерминант, но индуцировать защитный иммунитет могут немногие из них Þ очистить вакцинный препарат от токсичных или аллергизирующих компонентов. Выделение из Б!# АГ компонентов позволило получить вакцины второго поколения – ХИМИЧЕСКИЕ. По сравнению с др вакцинами они менее реактогенны. Аналогами Б! хим вакцин являются вирусные субъединичные (расщепленные) вакцины, содержащие лишь некоторые наиболее иммуногенные компоненты вирионов (противогриппозная вакцина, включающая гемагглютинин и нейраминидазу). Субъединичные вакцины оказались наименее реактогенными, но и наименее иммуногенными.
Для ↑ ИММУНОГЕННОСТИ химических и субъединичных вакцин к ним добавляют разного рода адъюванты (adjuvans – помогающий, поддерживающий): гидрооксид алюминия, алюминиево-калиевые квасцы, фосфат алюминия и др. Те же адъюванты добавляют для повышения иммуногенности и к препаратам анатоксинов.
АНАТОКСИНЫ получают путем обработки токсинов формалином (0,3% раствор) при температуре 37°С в течение 30 дней. При этом токсин утрачивает ядовитость, но сохраняет способность индуцировать синтез АТ. Анатоксинами широко пользуются для выработки активного антитоксического иммунитета при специфической профилактике столбняка, дифтерии и других инфекций, возбудители которых продуцируют экзотоксины.
ПЕРСПЕКТИВНЫЕ НАПРАВЛЕНИЯ:
1) получение в чистом виде эпитопов и их связывание с молекулой-носителем (природные белки, синтетические полиэлектролиты).
2) Генноинженерные методы: определяют гены, контролирующие нужные АГ детерминанты, переносят в геном других мкÒ и клонируют в них, добиваясь экспрессии этих генов в новых условиях.
3) На основе антиидиотипических антител.
4) Использование липосом для введения АГ. Благодаря их сходству с клеточными мембранами они не токсичны для Ò, заключенное в них вещество защищено от растворения в крови и они могут адсорбироваться на клетках. Такие «липосомные» вакцины вызывали тысячекратное усиление иммунного ответа.
Часть вакцин используется для обязательной ПЛАНОВОЙ ВАКЦИНАЦИИ детей: противотуберкулезная вакцина BCG, полиомиелитная вакцина, коревая, паротитная, АКДС.
Другие вакцины обязательны для введения определенным контингентам в определенных районах (например, вакцина против клещевого энцефалита) или при опасности профессиональных контактов с возбудителем.
Общие требования к вакцинам: высокая иммуногенность, ареактогенность (отсутствие выраженных побочных реакций), безвредность и минимальное сенсибилизирующее действие.
Препараты для
иммунопрофилактики и иммунотерапии
инфекционных заболеваний делятся на:
вакцины
и анатоксины – для индукции специфического
иммунного ответа с формированием
активного противоинфекционного
иммунитета за счет мобилизации
механизмов иммунологической памяти;иммунные
сыворотки и Ig – содержат готовые
специфические АТ (Ig), введение которых
в
приводит к немедленному приобретению
пассивного гуморального иммунитета,
способного защитить организм от
интоксикации или инфекции.
ВАКЦИНЫ
(Э. Дженнер, Л. Пастер) – биопрепараты,
предназначенные для создания активного
искусственного иммунитета. Делятся на
живые, убитые, химические, анатоксины
и ассоциированные. Готовят т/же аутовакцины
– из штаммов мк,
выделенных непосредственно из
чка.
ЖИВЫЕ
ВАКЦИНЫ
создают напряженный иммунитет,
сходный с постинфекционным. Готовятся
из АТТЕНУИРОВАННЫХ штаммов (т.е.
вирулентные свойства утрачены, но при
введении в
способны прижиться и вызвать выработку
ВСЕХ ВИДОВ иммунитета). В большинстве
случаев достаточно однократной вакцинации
живой вакциной, т.к. вакцинный штамм
может размножаться и персистировать в
.
Применение живых вакцин опасно для
людей (особенно детей) с врожденными
или приобретенными иммунодефицитными
состояниями → тяжелые инфекционные
осложнения. Для получения используют
следующие методы:
селекционный
метод, направленный на выращивание мк
в неблагоприятных условиях отбор
микробов со ↓ вирулентностью –
классический метод получения живых
вакцин (Пастер – сиб язва).Адаптация
мк
к
невосприимчивого Ж! или пассирование
через ткани и органы, к/е не являются
входными воротами для данного мк.Отбор
мутантных штаммов со ↓ вирулентностью,
выделенных из природы.Методы
генной инженерии.
УБИТЫЕ
ВАКЦИНЫ
готовят из мк,
обладающих максимально выраженной
иммуногенностью. Их выращивают (на
биопредприятиях), затем инактивируют
t°С
(55-60° в течение 1часа), УФ или хим в-вами
(формалин, фенол, спирт и др) в условиях,
исключающих денатурацию антигенов. Для
профилактики – брюшного тифа, паратифов
А и В, коклюша, бруцеллёза, лептоспироза…
Для лечения – при вялотекущих и
хронических инфекциях: бруцеллёз,
туляремия, дизентерия, гоноррея, коклюш…
Убитые вакциины создают ненапряжённый
иммунитет.
Аттенуированный
или убитый возбудитель – это множество
различных АГ детерминант, но индуцировать
защитный иммунитет могут немногие из
них
очистить вакцинный препарат от
токсичных или аллергизирующих
компонентов. Выделение из Б!
АГ компонентов позволило получить
вакцины второго поколения – ХИМИЧЕСКИЕ.
По сравнению с др вакцинами они менее
реактогенны. Аналогами Б! хим вакцин
являются вирусные субъединичные
(расщепленные) вакцины, содержащие лишь
некоторые наиболее иммуногенные
компоненты вирионов (противогриппозная
вакцина, включающая гемагглютинин и
нейраминидазу). Субъединичные вакцины
оказались наименее реактогенными, но
и наименее иммуногенными.
Для
↑ ИММУНОГЕННОСТИ химических и
субъединичных вакцин к ним добавляют
разного рода адъюванты (adjuvans
– помогающий,
поддерживающий): гидрооксид алюминия,
алюминиево-калиевые квасцы, фосфат
алюминия и др. Те же адъюванты добавляют
для повышения иммуногенности и к
препаратам анатоксинов.
АНАТОКСИНЫ
получают путем обработки токсинов
формалином (0,3% раствор) при температуре
37°С в течение 30 дней. При этом токсин
утрачивает ядовитость, но сохраняет
способность индуцировать синтез АТ.
Анатоксинами широко пользуются для
выработки активного антитоксического
иммунитета при специфической профилактике
столбняка, дифтерии и других инфекций,
возбудители которых продуцируют
экзотоксины.
ПЕРСПЕКТИВНЫЕ
НАПРАВЛЕНИЯ:
получение
в чистом виде эпитопов и их связывание
с молекулой-носителем (природные белки,
синтетические полиэлектролиты).Генноинженерные
методы: определяют гены, контролирующие
нужные АГ детерминанты, переносят в
геном других мк
и клонируют в них, добиваясь экспрессии
этих генов в новых условиях.На
основе антиидиотипических антител.Использование
липосом для введения АГ. Благодаря их
сходству с клеточными мембранами они
не токсичны для ,
заключенное в них вещество защищено
от растворения в крови и они могут
адсорбироваться на клетках. Такие
«липосомные» вакцины вызывали
тысячекратное усиление иммунного
ответа.
Часть
вакцин используется для обязательной
ПЛАНОВОЙ ВАКЦИНАЦИИ детей:
противотуберкулезная вакцина BCG,
полиомиелитная вакцина, коревая,
паротитная, АКДС.
Другие вакцины
обязательны для введения определенным
контингентам в определенных районах
(например, вакцина против клещевого
энцефалита) или при опасности
профессиональных контактов с
возбудителем.
Общие требования
к вакцинам: высокая иммуногенность,
ареактогенность (отсутствие выраженных
побочных реакций), безвредность и
минимальное сенсибилизирующее действие.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
У большинства россиян представление об иммунитете складывается под влиянием рекламных роликов. Средства для его поддержания и укрепления предлагают в виде йогуртов, творожков, витаминов, употребляя которые можно начисто забыть обо всех болячках. На самом деле, состояние иммунной системы зависит не только от приема кисломолочного продукта или биологической добавки. Более того, при изобилии всех широко рекламируемых средств для укрепления иммунитета, особенно лекарственных, таких как иммуномодуляторы и иммуностимуляторы, к их применению нужно подходить крайне осторожно. Зачастую громкие слова о чудодейственных продуктах — просто ловкий рекламный ход.
Понятие иммунитета
Иммунитет — это механизм действия иммунных клеток, направленный на поддержание постоянства внутренней среды организма, сформированный с целью защиты от инфекций и вирусов и выработки методов противостояния воздействию последних при их проникновении.
Виды иммунитета
Виды иммунитета имеют множество классификаций по различным признакам.
В первую очередь, разделяют врожденный и приобретенный виды иммунитета.
Врожденный тип обусловлен наследственностью, передается через плаценту с кровью матери, при грудном вскармливании с молоком.
Приобретенный иммунитет формируется на протяжении жизни человека. Факторами влияния являются окружающая среда с ее бактериями, перенесенные инфекции. Данный вид предполагает деление на активный иммунитет, который модулируется при помощи запоминания иммунными клетками возбудителя заболевания, и пассивный, когда в организм вводятся уже готовые антитела при помощи вакцин и сывороток.
Локально иммунитет подразделяют на общий и местный. Общая иммунная система охватывает защитой весь организм, местная — определенный орган.
По действию различают гуморальный и клеточный иммунитет.
По направлениям выделяют противоинфекционный, противоопухолевый и трансплантационный иммунитет.
К одному из видов противоинфекционного иммунитета относят иммунитет антитоксический.
Антитоксический тип иммунной реакции
Антитоксический иммунитет направлен на обезвреживание отравляющих веществ, выделяемых возбудителями таких заболеваний как дифтерия, столбняк, газовая гангрена, ботулизм, полиомиелит, дизентерия. Его защитные свойства основаны на действии иммуноглобулина G. Именно он строит защиту от токсического воздействия зловредных микроорганизмов, вырабатывая к каждому свои определенные антитела. Иммуноглобулин G также обладает памятью, и если в организм повторно подвергся интоксикации одним и тем же вирусом, он достаточно быстро удалит его.
Способ воздействия и особенности антитоксинов
Антитоксический иммунитет обусловлен действиями антитоксинов, которые вырабатываются в ответ на отравляющее влияние токсинов, выделяемых микроорганизмами-разносчиками инфекции, подавляя активность их токсических свойств.
Немецкий ученый П. Эрлих разработал схему, которая отображает принцип действия антитоксинов на токсины. Отравляющее действие токсина происходит в том случае, когда он сумел прицепиться к живому веществу в крови. Если такое соединение произошло, живой элемент крови подвергается ядовитому влиянию токсина.

Звенья живого элемента с присоединившимся чуждым токсином действуют в организме далеко не в этом направлении, поэтому соединяющие части, занятые токсинами, иммунная система начинает заменять новыми. Эти новые звенья и есть антитоксины. В спайке с токсином, они подавляют действие последнего на живое вещество.

Отсюда была выведена главная особенность антитоксического иммунитета: антитела (антитоксины) не убивают антиген, а нейтрализуют его токсические свойства. Исследования Эрлиха дали новую характеристику видам иммунитета. Он стал разделяться на клеточный (открытый ранее И. Мечниковым) и гуморальный, который образуется в плазме крови.
Использование антитоксинов в медицине
Не всегда вырабатываемых самим организмом антител хватает на подавление токсического воздействия антигенов. Немецким иммунологом-микробиологом А. Берингом и французом Э. Ру на основе исследований Эрлиха была изобретена антитоксическая сыворотка. На ранних стадиях такого заболевания как дифтерия пациенту вводятся антитела к дифтерийному токсину, и при их помощи больной успешно справляется с болезнью.
В общих чертах, антидифтерийная сыворотка представляет собой жидкость, содержащую большое число антитоксинов. Добывается она при участии лошадей, устойчивых к дифтерии. Животному впрыскивается дифтерийный антиген до тех пор, пока животное не начинает вырабатывать огромное количество антител к нему. Такая кровяная сыворотка с высокой концентрацией антител к дифтерии является мощным оружием против этой ядовитой инфекции.

Такой же метод лечения используется и при остальных инфекционных заболеваниях, таких как столбняк, дизентерия и др. Больным вводится сыворотка с высоким содержанием антитоксинов к отравляющим антигенам болезни.
Механизмы выработки антитоксической иммунной реакции
Эта форма иммунной реакции не является наследственной, способной передаваться от матери плоду. Антитоксический иммунитет — приобретенный, вырабатывается при внедрении отравляющих антигенов естественным или искусственным путем. Естественным образом антитоксическая защита приобретается при перенесении высокотоксикогенных инфекционных заболеваний, когда самостоятельная выработка организмом антитоксинов является ответом на ядовитое воздействие возбудителей.
Искусственно антитоксический иммунитет вырабатывается при введении вакцин или анатоксина, а также иммунных сывороток.
Напряженность иммунитета
Риск поражения организма инфекционным заболеванием зависит от количества антител, вырабатываемых в жидкой части крови против этого заболевания. Устойчивость организма к возбудителям называют напряженностью иммунитета.
Уровень устойчивости анализируется отдельно к каждой болезни и определяется количеством производимых антитоксинов. К примеру, если 1/30 в составе 1 мл крови составляет антитоксин против дифтерии, то можно уверенно говорить об отсутствии риска поражения инфекцией.
В заключении надо отметить, что иммунологией антитоксическому иммунитету отводится свое почетное место, поскольку изучение его механизмов действия и выработки дало возможность избавления человечества от таких смертельно опасных заболеваний как дифтерия, столбняк, дизентерия, ботулизм, газовая гангрена и др.
Иммунобиологические препараты (ИМП) — это препараты, которые оказывают влияние на иммунную систему или действие которых основало на иммунологических реакциях. Эти препараты применяют для профилактики, лечения и диагностики инфекционных заболеваний и тех неинфекционных заболеваний, в развитии которых участвует иммунная система.
К иммунобиологическим препаратам относят:
1. Вакцины и другие лечебные и профилактические препараты из живых микробов или микробных продуктов (анатоксины, фаги, эубиотики).
2. Иммунные сывороточные препараты.
3. Иммуномодуляторы.
4. Диагностические препараты, в том числе аллергены.
ИМП применяют для активации, подавления или нормализации деятельности иммунной системы.
Вакцины — это препараты для создания активного искусственно приобретенного иммунитета. Вакцины применяют для лечения, реже — для профилактики заболеваний.
Действующее начало вакцин – специфический антиген.
Классификация вакцин:
1. Живые вакцины:
— аттенуированные (ослабленные);
— дивергентные;
— векторные рекомбинантные.
2. Неживые вакцины:
— молекулярные;
— корпускулярные: а) цельноклеточные и цельновирионные; б) субклеточные и субвирионные; в) синтетические, полусинтетические.
3. Ассоциированные вакцины.
Характеристика живых вакцин.
Живые аттенуированные вакцины — препараты из ослабленных микробов, потерявших вирулентность, но сохранивших иммуногенность. Ослабленные микробы — это вакцинные штаммы.
Способы получения вакцинных штаммов
а) метод отбора мутантов с ослабленной вирулентностью;
б) метод направленного (искусственного) снижения вирулентности (выращивание на неблагоприятных питательных средах, длительное пассирование (последовательное заражение) через организм маловоспримчивых лабораторных животных);
в) метод генной инженерии (инактивация гена, который отвечает за образование факторов вирулентности патогенных микробов).
Вакцинные штаммы микробов сохраняют способность размножаться в месте введения и распространяться по организму. В результате этого возникает вакцинная инфекция (заболевание протекает в легкой форме). Вакцинная инфекция всегда приводит к формированию иммунитета к патогенным микробам данного вида, к которым относится вакцинный штамм.
Дивергентные вакцины — препараты из живых микробов, не болезнетворных для человека, но сходных по антигенным свойствам с болезнетворными микробами. Например, для прививки против оспы человека используют вирус оспы коров.
Векторные рекомбинантные вакцины получают методом генной инженерии. Для этого в геном вакцинного штамма встраивают ген (вектор), контролирующий образование антигенов другого возбудителя (чужеродного антигена). Например, в штамм вируса гепатита В (НВs — антиген). Такая векторная вакцина создает иммунитет и против оспы в против гепатита В.
Получение живых вакцин:
1) выращивают вакцинный штамм в асептических условиях на оптимальной питательной среде;
2)биомассу микробов концентрируют, стандартизуют (определяют титр — количество микробов в 1 мл), добавляют стабилизатор (сахарозожелатиновый агар, человеческий альбумин), который защищает от разрушения, лиофильно высушивают, фасуют в стерильные ампулы или флаконы.
После получения вакцины проходят государственный контроль -проверяется реактогенность, безвредность и иммуногенность.
Преимущества живых вакцин:
1) создание прочного (напряженного) и длительного иммунитета (5-7 лет);
2) прививки делают однократно более простыми способами (перорально, интраназально, накожно, подкожно);
3) менее реактогенны, т.к. не содержат консервантов и адьювантов.
Недостатки живых вакцин:
1) трудоемкости получения вакцинных штаммов;
2) малый срок хранения (1-2 года);
3) хранение и транспортировка при пониженной температуре (+4°С — +8°С). Для обеспечения безопасности живых вакцин необходимо проводить постоянный контроль реверсии вирулентности возбудителя, строго соблюдать требования, обеспечивающие сохранность и активность вакцинных микробов.
Примеры живых вакцин:
1) бактериальные вакцины – туберкулезная (БЦЖ), чумная, туляримийная, сибиреязвенная, бруцеллезная, против Ку—лихорадки;
2) вирусные вакцины — полиомиелитная, коревая, гриппозная, паротитная, против желтой лихорадки.
Характеристика неживых вакцин.
Корпускулярные вакцины — препараты из инактевированных культур патогенных (высоко вирулентных) или вакцинных штаммов бактерий и вирусов. Способы инактивирования: 1) физические: температура, УФ-лучи. ионизирующее излучение 2) химические — формалин, спирт, ацетон, β-пропиолактон.
Корпускулярные вакцины из целых бактерий называют цельноклеточными, а из целых (не разрушенных) вирусов – цельновирионными.
Получение корпускулярных вакцин:
1) выращивают в асептических условиях чистую культуру микробов;
2) проводят инактивацию в оптимальном режиме (нужно лишить микроорганизмы жизнеспособности, но сохранить их иммуногенность), например, гретые вакцины инактивируют путем прогревания взвеси микробов при 56°С;
3) стандартизуют (по концентрации микробов), добавляют консервант (мертиолат, формальдегид, 2-феноксиэтннол и др.), который подавляет постороннюю микрофлору при хранении, фасуют.
Вакцины могут быть жидкие (суспензии) или сухие. Готовые вакцины подвергают контролю на стерильность, безвредность, иммуногенность, проверяют густоту вакцины или титр (количество микробов в 1 мл).
Преимущества цельноклеточных и цельновирионных вакцин:
1) простота получения;
2) большая устойчивость при хранения вболее длительный срок хранения.
Недостатки цельноклеточиных и цельновирионных вакцин:
1) менее прочный и продолжительный иммунитет;
2) необходимость 2-х и 3-х-кратных прививок парентеральным путем (подкожно, внутримышечно), иногда перорально;
3) реактогенность — боль, чувство жжения на месте введения, повышение температуры, судорожный синдром и т.д.
Примеры вакцин: против Гриппа, коклюша, холеры, гепатита А, герпеса, вирусного энцефалитаи др. Они используются для профилактики соответствующих заболеваний. Некоторые вакцины используют для лечения (вакцинотерапии) хронических инфекционных заболеваний — бруцеллеза, хронической дизентерии, хронической гонореи, хронических стафилококковых инфекций. Для лечебных целей используют и аутовакциные — препараты из убитых бактерий, выделенных из организма больного.
Корпускулярные вакцины из разрушенных бактерий и вирусов называются субклеточными и субвирнонными. Такие вакцины сдержат антигенные комплексы, выделенные из бактерий и вирусов после их разрушения.
Раньше эти вакцины назывались химическими. Однако этот термин более применим к вакцинам, полученным методам химического синтеза.
Получение субклеточных и субвирионных вакцин более сложное, чем цельноклеточных и цельновирионных (например, ферментативное переваривание с последующим осаждением антигенов этиловым спиртом), но они содержат меньше балластных веществ.
Преимущества субклеточных и субвирионных вакцин:
1) содержат только иммунологически активные части клеток — антигены без других компонентов;
2) менее реактогены;
3) более стабильны и лучше подвергаются стандартизации и более точной дозировке;
4) можно вводить в больших дозах и ввиде ассоциированных препаратов.
Недостатки:
1) слабая иммуногенность;
2) малые размер, что приводит к быстрому выделению и к краткому антигенному раздражению.
Для устранения недостатков к таким вакцинам добавляют адъванты.
Адъванты усиливают иммуногенность вакцин. Они укрупняют антигенные частицы, создают в месте введения “депо’, из которого антигены медленно высвобождаются, что удлиняет время их воздействия на иммунную систему.
В качестве адъювантов используют минеральные коллоиды (фосфат алюминия, фосфат кальция, гидрат окиси алюминия, алюмо-калиевые квасцы), полимерные вещества (липополисахариды, синтетические полимеры), растительные вещества (сапонины) и др. Вакцины с адъювантами называются адъювантными, сорбированными, адсорбированными или депонированными вакцинами.
Примеры субклеточных и субвирионных вакцин: против брюшного тифа на основе О-, Н- иVi — антигенов, против гриппа на основе антигенов вируса (нейраминидаза и гемагглютинин), против сибирской язвы на основе капсульного антигена, против дизентерии, менингита, холеры.
Молекулярные вакцины — это специфические антигены в молекулярной форме.
Они могут быть получены путем биосинтеза, химического синтеза и генной инженерии.
Метод биосинтеза заключается в том, что из микроба или из культуральной жидкости выделяют протективный антиген в молекулярной форме. Например возбудители дифтерии, ботулизма, столбняка при росте синтезируют и выделяют в культуральную жидкость молекулы экзотоксинов. После обработки формалином экзотоксины теряют свои токсические свойства, но сохраняют иммуногенность, т.о. к типичным молекулярным вакцинам, которые получают путем биосинтеза, относятся анатоксины.
Получение анатоксинов:
1) выращивают возбудителей, которые образуют экзотоксины (возбудители столбняка, ботулизма, дифтерии, газовой гангрены), глубинным способом в жидкой питательной среде в ферментаторах, в результате этого в культуральной жидкости накапливается экзотоксин;
2) отделяют микробные клетки от культуральной жидкости путем фильтрации через бактериальные фильтры;
3) добавляют к культуральной жидкости, в которой находится экзотоксин, 0,4% формалин и выдерживают при 37°С в течение 3 — 4 недель;
4) анатоксин очищают, концентрируют, стандартизуют — определяют активность анатоксина, добавляют консервант и адъювант и фасуют.
Такие анатоксины называют очищенными сорбированными.
Активность анатоксина выражают в антигенных единицах: единицах связывания (ЕС) или единицах флоккуляции ЛФ).
1 ЛФ — это то количество анатоксина, которое с 1 МЕ антитоксической сыворотки дает начальную реакцию флокулляции.
Титр анатоксина — это содержание ЛФ в 1 мл вакцины.
Применяют анатоксины подкожно, внутримышечно, 2или 3-екратно с последующими ревакцинациями. Анатоксины вырабатывают антитоксический иммунитет.
Примеры молекулярных вакцин: противостолбнячный анатоксин, противоботулинический анатоксин, противогангренозный анатоксин. Получение молекулярных вакцин методом химического(искусственного) синтеза новое направление в вакцинологии. Некоторые низкомолекулярные антигены получены методом химического синтеза. Кроме того, получают синтетические высокомолекулярные носители и соединяют их с естественными антигенами. Например, гриппозная вакцина состоит из антигенов вируса гриппа и полиоксидония, который обладает выраженными адъювантными свойствами. Молекулярные вакцины получают также методом генной инженерии. Так получена вакцина против гептатита В, антигены которые синтезируются клетками дрожжей.
Характеристика ассоциированных вакцин.
Ассоциированные вакцины состоят из вакцин разного типа и вырабатывают иммунитет к нескольким заболеваниям. Они еще называются комплексными или поливалентными. Они могут включать однородные антигены (например, анатоксины) и антигены различной природы (например, корпускулярные и молекулярные антигены, убитых и живых микробов).
Антигены в вакцинах содержатся в дозировках, не создающих взаимной конкуренции, чтобы иммунитет вырабатывался ко всем антигенам.
Примеры ассоциированных вакцин: АКДС (ассоциированная коклюшно-дифтерийно-столбнячная вакцина) из столбнячного и дифтерийного анатоксина коклюшной корпускулярной вакцины: живая ассоциированная полиомиелитная вакцина из штаммов вируса полиомиелита I,II, III типов; гриппозная вакцина из трех штаммов вируса гриппа; менингококковая вакцина из антигенов 4-х серотипов менингококка; живая комплексная вакцина против кори, паротита и краснухи.
СЫВОРОТКИ.
Сывороточные препараты применяют для создания пассивного искусственного приобретенного иммунитета. Они содержат антитела, специфически связывающие и нейтрализующие определенные бактерии и вирусы, токсины.
Сыворотки используют для лечения, экстренной профилактики и диагностики инфекционных заболеваний. Различают лечебно-профилактические и диагностические —сыворотки.
Лечебно-профилактические сыворотки делят па противовирусные, антибактериальные и антитоксические. К диагностическим сывороткам относятся агглютинирующие, преципитирующие, гемолитические, антивирусине и антитоксические сыворотки. Преимущество сывороток перед вакцинами в том, что они сразу же после введения создают иммунитет (12 — 24 час). Недостаток — непродолжительный иммунитет, т.к. антитела — чужеродные белки, которые быстро (через 1 — 2 недели) выводятся из организма.
Лечебно-профилактические сыворотки получают из крови гипериммунизированных животных (лошадей) и из крови людей (донорской, плацентарной, абортивной), переболевших или иммунизированных.
Диагностические сыворотки получают из крови иммунизированных кроликов.
Для получения антитоксических сывороток проводят гипериммунизацию (многократное введение) лошадей токсинами. Иммунизацию проводят подкожно или внутривенно возрастающими дозами антигена с определенными интервалами времени между инъекциями. Вначале вводят анатоксин, а через 4 — 5дней — токсин. Антитоксические сыворотки используют для создания антитоксического иммунитета, т.е. для лечения и профилактики токсинемических инфекций (ботулизма, столбняка, газовой гангрены, дифтерии).Для получения антибактериальных сывороток проводят гипериммунизацию вакцинными штаммами бактерий или убитыми бактериями. Они содержат антитела с агглютинирующими и лизирующими свойствами. Это нетитруемые препараты. Малоэффективны.Для получения противовирусных сывороток проводят гипериммунизацию штаммами вирусов. Сыворотки очищают различными методами, концентрируют, стерилизуют и определяют ее активность (титр антител). Активность антитоксических сывороток выражают в Международных единицах (МЕ). Активность сыворотки отражает ее способность нейтрализовать определенную дозу токсина. Это условно взятая величина для каждого вида сыворотки. Например, для дифтерийной сыворотки 1 МЕ – это наименьшее количество сыворотки, которое нейтрализует 100 DLM дифтерийного токсина для морской свинки. Сыворотки представляют собой прозрачные, слегка опалисцирующие жидкости, бледно — желтого цвета. Выпускают в ампулах. Сыворотки, так же как и вакцины, после производства проходят госконтроль в соответствии с инструкциями Министерства здравоохранения. Сыворотки контролируют на стерильность, безвредность, количество белка, прозрачность и активность (титр антител). Сыворотки вводят подкожно, внутримышечно, реже — внутривенно или в спинномозговой канал. Вводят сыворотки по методу Безредке для предупреждения анафилактического шока и сывороточной болезни.
Из сывороток получают иммуноглобулины путем водно-спиртового извлечения (очистки). Иммуноглобулины — это очищенные и концентрированные иммунные сыворотки.
Иммуноглобулины, как и иммунные сыворотки бывают гомологичными и гетерологичными. Гомологичные получают из крови людей, гетерологичные — из крови животных. Иммуноглобулины из крови человека бывают 2-х видов: 1) противокоревой (нормальный)иммуноглобулин — получают из донорской, плацентарной или абортивной крови здоровых людей, которая содержит антитела против вируса кори, вирусов гриппа, гепатита, полиомиелита, против коклюша и некоторых других бактериальных и вирусных инфекций; 2) иммуноглобулины направленного действия— получают из крови переболевших людей и добровольцев, которых иммунизируют против определенной инфекции; эти сыворотки содержат повышенные концентрации специфических антител и приметаются с лечебной целью; получают иммуноглобулины направленного действия против гриппа, бешенства, оспы, клещевого энцефалита, столбняка и стафилококковых инфекций. Применение гомологичных сывороток и иммуноглобулинов предпочтительнее (лучше), т. к. антитела более длительно находятся в организме (4 — 5недель) и не вызывают сильных побочных реакций, как гетерологичные. Гетерологиные препараты быстро выводятся из организма (через 1 — 2 недели) и вызывают побочные эффекты. Они имеют строго ограниченное применение из-за опасности аллергических осложнений. Гомологичные сывороточные препараты широко применяют для профилактики и лечения вирусного гепатита, кори, для лечения ботулизма, столбняка, стафилококковых инфекций, клещевой о энцефалита, гепатита В и др. Против кори, эпидемического гепатита, гриппа, коклюша, полиомиелита применяют человеческий γ-глобулин.
Гетерологичных сыворотки — это лошадиные сыворотки против ботулизма, газовой гангрены, дифтерии, столбняка. Из крови иммунизированных животных получают гетерологичные иммупоглобулины: иммуноглобулины лошадиные против бешенства (антирабическии γ-глобулин), клещевого энцефалита, лихорадки Эбола, японского энцефалита, сибирской язвы; иммуноглобулины из сыворотки крови волов для лечения лептоспироза.
ФАГИ — иммунобиологические препараты из живых бактериофагов. Это фильтраты бульонных культур бактерий, лизированных (разрушенных) фагами. Применение основано на лизисе бактериальных клеток и стимулировании образования антител антигенами разрушенных бактериальных клеток. Фаги используются для диагностики, профилактики и лечения заболеваний (брюшного тифа, дизентерии, холеры, раненых инфекций).
ИММУНОМОДУЛЯТОРЫ – препараты, которые стимулируют, ингибируют или регулируют реакции. Они воздействуют на активность иммунокомпетеных клеток, процессы образования иммунных факторов. К ним относятся интерферон, интерлейкины, миелопептиды, вешества тимуса, а также химические вещества: декарис, циклоспорин А; препараты
