Вклад лимфоидных клеток в иммунитет
Врождённые лимфоидные клетки (ВЛК) это группа лимфоцитов которые вовлечены в быстрое цитокин-зависимое реагирование организма во время воспалительного процесса.
Они играют важную роль в гомеостазе органов тканей и в иммунном ответе организма на внешние раздражители а также регулируют процессы развития клеток приобретённого иммунитета.
В отличии от «обычных» лимфоцитов приобретённого иммунитета у ВЛК отсутствуют антиген-специфичные рецепторы, они могут реагировать на широкий спектрум воспалительных стимулов.
Как и Т-хелперы, ВЛК имеют общего предшественника охарактеризованного как клетка экспрессирующая транскрипторный фактор inhibitor of DNA binding 2 (ID2).
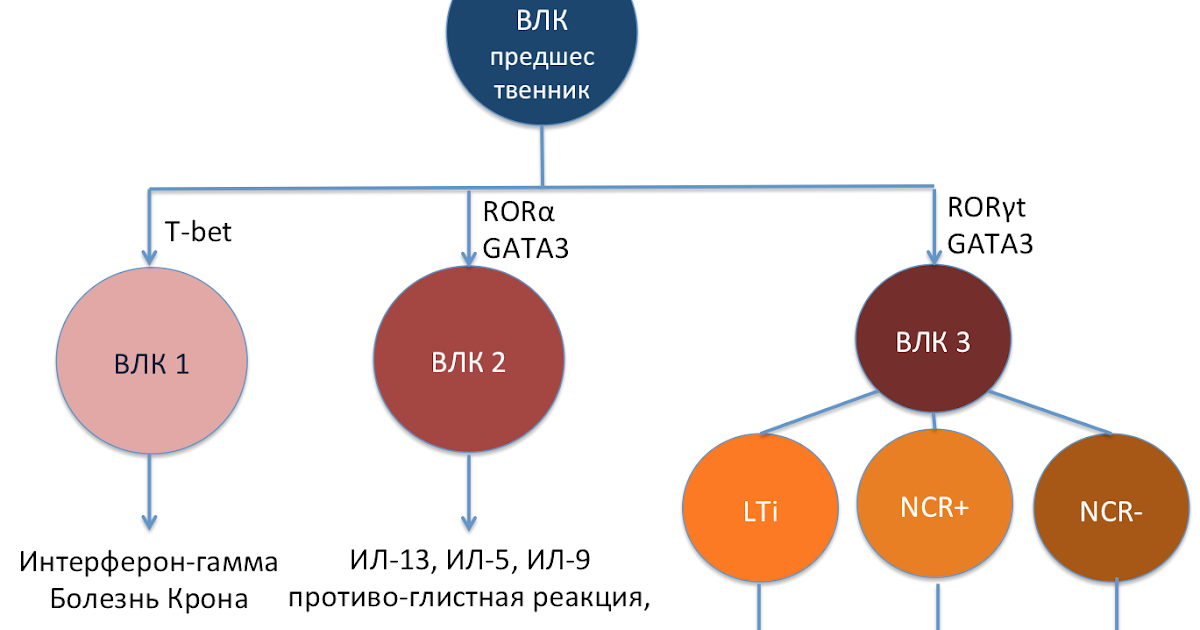
На сегодняшний день выделяют три группы ВЛК в зависимости от их функции и экспрессии воспалительных медиаторов (Рисунок 1).
1-ая группа
ВЛК делят множество характеристик с естественным киллерам (ЕК)
(Natural killer, NK cells). Также как и ЕК, 1-тип ВЛК экспрессируют интерферон-γ и нуждаются в транскрипторном факторе Т-bet для своего развития, но в отличие от ЕК, они нe экспрессируют перфорин, гранзим В (granzyme B) и рецептор киллерных клеток (Killer-cell Ig-like receptor) и также
активизируются в основном на интерлейкин-7 (ИЛ-7)
чем ИЛ-15. Высокое содержание 1-го типа
ВЛК были обнаружены в кишечнике пациентов страдающие болезнью Крона.
2-ая группа ВЛК имеют способность продуцировать ИЛ -13, -5 и -9. Впервые эта популяция клеток была описана в контексте анти-гельминтной реакции организма. Исследователи показали что
2-ой тип ВЛК стимулирует эозинофилию и гиперплазию бокаловидных клеток
, два важных процесса в анти-глистном ответе организма. Также недавно, 2-ой тип ВЛК был обнаружен в лёгких и играет важную роль в патофизиологии астмы. Для дифференциации во 2-ой тип ВЛК необходима активация таких транскрипторных факторов как retinoic acid receptor–related orphan receptor (ROR) α и Gata3.
3-я группа ВЛК для своего развития также нуждаться в Gata3 и ROR-γt. Эта группа делится на 3 под-группы. 1)
Клетки индуцирующие лимфоидную ткань
(Lymphoid tissue inducer, LTi) , они необходимы для лимфоидного органогенеза и продуцируют ИЛ -17 и -22. 2)
ИЛ-22 продуцирующие ВЛК
(natural cytotoxicity receptor, NCR позитивные) учавствуют в
защите организма от внешних патогенов
. 3)
ИЛ-17 продуцирующие ВЛК
(NCR негативные) были обнаружены у пациентов страдающие язвенным колитом, также существуют исследования показывающие вовлечение этой группы клеток в прогрессии астмы и других аллергически-воспалительных процессах.
| Рисунок 1 |
Что мы знаем….
ВЛК это новая популяция лимфоцитов, охарактеризованная относительно недавно.
ВЛК может продуцировать широкий спектрум цитокинов.
ВЛК реагирует в НЕ антиген зависимой манере.
ВЛК функционируют независимо от клеток приобретённого иммунитета но в тоже время влияют на приобретённый иммунитет.
Что не знаем…..
Как ВЛК взаимодействуют с клетками приобретённого иммунитета т.к. Т-хелперы.
Изначально ВЛК это очень малочисленная популяция клеток но в критических ситуациях (воспаление, защита от инфекционных патогенов),эта популяция клеток резко увеличивается. И остаётся неизвестным механизмы запускающие экспансию ВЛК.
Существуют ли дополнительные саб-группы ВЛК?
Литература:
Nature Reviews Immunology (2013) 13, 75-87
Immunology and Cell Biology (2013) 91, 215–224
Curr Opin Immunol (2014) 27, 75–82
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 марта 2020;
проверки требует 1 правка.
Принципиальная схема механизма иммунной памяти у В-лимфоцитов
(B-клетки, от bursa fabricii птиц, где впервые были обнаружены) — функциональный тип лимфоцитов, играющих важную роль в обеспечении гуморального иммунитета. При контакте с антигеном или стимуляции со стороны T-клеток некоторые B-лимфоциты трансформируются в плазматические клетки, способные к продукции антител. Другие активированные B-лимфоциты превращаются в B-клетки памяти. Помимо продукции антител, В-клетки выполняют множество других функций: выступают в качестве антигенпрезентирующих клеток, продуцируют цитокины и экзосомы[1].
У эмбрионов человека и других млекопитающих B-лимфоциты образуются в печени и костном мозге из стволовых клеток, а у взрослых млекопитающих — только в костном мозге. Дифференцировка В-лимфоцитов проходит в несколько этапов, каждый из которых характеризуется присутствием определённых белковых маркеров и степенью генетической перестройки генов иммуноглобулинов.
Аномальная активность В-лимфоцитов может быть причиной аутоиммунных и аллергических заболеваний[1].
Дифференцировка В-лимфоцитов[править | править код]
B-лимфоциты происходят от плюрипотентных гемопоэтических стволовых клеток, дающих также начало всем клеткам крови. Стволовые клетки находятся в определённом микроокружении, которое обеспечивает их выживание, самообновление или, при необходимости, дифференцировку. Микроокружение определяет, по какому пути пойдёт развитие стволовой клетки (эритроидному, миелоидному или лимфоидному)[1].
Дифференцировка В-лимфоцитов условно делится на две стадии — антигеннезависимую (в которую происходит перестройка генов иммуноглобулинов и их экспрессия) и антигензависимую (при которой происходит активация, пролиферация и дифференцировка в плазматические клетки). Выделяют следующие промежуточные формы созревающих В-лимфоцитов:
- Ранние предшественники В-клеток — не синтезируют тяжёлых и лёгких цепей иммуноглобулинов, содержат зародышевые гены IgH и IgL, но содержат антигенный маркер, общий со зрелыми пре-В-клетками.
- Ранние про-В-клетки — D-J-перестройки в генах IgН.
- Поздние про-В-клетки — V-DJ-перестройки в генах IgН.
- Большие пре-В-клетки — гены IgН VDJ-перестроены; в цитоплазме есть тяжёлые цепи класса μ, экспрессируется пре-В-клеточный рецептор.
- Малые пре-В-клетки — V-J-перестройки в генах IgL; в цитоплазме есть тяжёлые цепи класса μ.
- Малые незрелые В-клетки — гены IgL VJ-перестроены; синтезируют тяжёлые и лёгкие цепи; на мембране экспрессируются иммуноглобулины (B-клеточный рецептор).
- Зрелые В-клетки — начало синтеза IgD.
В-клетки поступают из костного мозга во вторичные лимфоидные органы (селезёнку и лимфатические узлы), где происходит их дальнейшее созревание, презентация антигена, пролиферация и дифференцировка в плазматические клетки и В-клетки памяти.
В-клетки[править | править код]
Экспрессия всеми В-клетками мембранных иммуноглобулинов позволяет осуществляться клональному отбору под действием антигена. При созревании, стимулировании антигеном и пролиферации существенно меняется набор маркеров В-клеток. По мере созревания В-клетки переключаются от синтеза IgM и IgD на синтез IgG, IgA, IgE (при этом у клеток сохраняется способность синтезировать также IgM и IgD — вплоть до трёх классов одновременно). При переключении синтеза изотипов антигенная специфичность антител сохраняется.
Различают следующие типы зрелых В-лимфоцитов:
- Собственно В-клетки (ещё называемые «наивными» В-лимфоцитами) — неактивированные В-лимфоциты, не контактировавшие с антигеном. Не содержат тельца Голла, в цитоплазме рассеяны монорибосомы. Полиспецифичны и имеют слабое сродство к многим антигенам.
- В-клетки памяти — активированные В-лимфоциты, вновь перешедшие в стадию малых лимфоцитов в результате кооперации с Т-клетками. Являются долгоживущим клоном В-клеток, обеспечивают быстрый иммунный ответ и выработку большого количества иммуноглобулинов при повторном введении того же антигена. Названы клетками памяти, так как позволяют иммунной системе «помнить» антиген на протяжении многих лет после прекращения его действия. В-клетки памяти обеспечивают долговременный иммунитет.
- Плазматические клетки являются последним этапом дифференцировки активированных антигеном В-клеток. В отличие от остальных В-клеток, несут мало мембранных антител и способны секретировать растворимые антитела. Являются большими клетками с эксцентрично расположенным ядром и развитым синтетическим аппаратом — шероховатый эндоплазматический ретикулум занимает почти всю цитоплазму, также развит и аппарат Гольджи. Живут недолго (2—3 дня) и быстро элиминируются при отсутствии антигена, вызвавшего иммунный ответ.
Маркеры В-клеток[править | править код]
Характерной особенностью В-клеток является наличие поверхностных мембраносвязанных антител, относящихся к классам IgM и IgD. В комплексе с другими поверхностными молекулами иммуноглобулины формируют антигенраспознающий рецептивный комплекс — B-клеточный рецептор, ответственный за узнавание антигена. Также на поверхности В-лимфоцитов расположены антигены МНС класса II, важные для взаимодействия с Т-клетками, также на некоторых клонах В-лимфоцитов присутствует маркер CD5, общий с Т-клетками. Рецепторы компонентов системы комплемента C3b (Cr1, CD35) и C3d (Cr2, CD21) играют определённую роль в активации В-клеток. Следует отметить, что маркеры CD19, CD20 и CD22 используются для идентификации В-лимфоцитов. Также на поверхности В-лимфоцитов обнаружены Fc-рецепторы.
Активация В-клеток[править | править код]
Антигенпрезентирующие клетки (макрофаги, клетки Купфера, фолликулярные дендритные клетки, интердигитальные дендритные клетки и т. д.) вскоре после процессирования патогена выносят эпитопы на поверхность клетки при помощи белков МНС II, делая их доступными для Т-клеток. Т-хелпер при помощи Т-клеточного рецептора распознаёт комплекс эпитоп—МНС II. Активированный Т-хелпер выделяет цитокины, усиливающие антигенпрезентирующую функцию, а также цитокины, активирующие В-лимфоцит — индукторы активации и пролиферации. В-лимфоциты присоединяются при помощи мембраносвязанных антител, выступающих в роли рецепторов, к «своему» антигену и в зависимости от получаемых от Т-хелпера сигналов пролиферируют и дифференцируются в плазматическую клетку, синтезирующую антитела, либо перерождаются в В-клетки памяти. При этом от качества и количества антигена будет зависеть исход взаимодействия в данной трёхклеточной системе. Описанный механизм справедлив для полипептидных антигенов, относительно неустойчивых к фагоцитарному процессингу — т. н. тимусзависимых антигенов. Для тимуснезависимых антигенов (обладающих высокой полимерностью с часто повторяющимися эпитопами, относительно устойчивых к фагоцитарному перевариванию и обладающих свойствами митогена) участия Т-хелпера не требуется — активация и пролиферация В-лимфоцитов происходит за счёт собственной митогенной активности антигена.
Роль В-лимфоцитов в презентации антигена[править | править код]
В-клетки способны интернализовать свои мембранные иммуноглобулины вместе со связанным с ними антигеном и затем презентировать фрагменты антигена в комплексе с молекулами МНС класса II. При низкой концентрации антигена и при вторичном иммунном ответе В-клетки могут выполнять функцию основных антигенпрезентирующих клеток.
Клетки В-1 и В-2[править | править код]
Выделяют две субпопуляции В-клеток: В-1 и B-2. Субпопуляцию В-2 составляют обычные В-лимфоциты, к которым относится всё сказанное выше. В-1 — это относительно небольшая группа В-клеток, обнаруживаемая у человека и мышей. Они могут составлять около 5 % от общей популяции B-клеток. Такие клетки появляются в течение эмбрионального периода. На своей поверхности они экспрессируют IgM и небольшое количество (или вовсе не экспрессируют) IgD. Маркером этих клеток является CD5. Однако он не является обязательным компонентом клеточной поверхности. В эмбриональном периоде В1-клетки появляются из стволовых клеток костного мозга. В течение жизни пул B-1-лимфоцитов поддерживается за счёт активности специализированных клеток–предшественников и не пополняется за счёт клеток, происходящих из костного мозга. Клетка–предшественница отселяется из кроветворной ткани на свою анатомическую нишу — в брюшную и плевральную полости — ещё в эмбриональном периоде. Итак, место обитания B-1-лимфоцитов — прибарьерные полости.
B-1-лимфоциты значительно отличаются от B-2-лимфоцитов по антигенной специфичности продуцируемых антител. Антитела, синтезированные B-1-лимфоцитами, не имеют значительного разнообразия вариабельных участков молекул иммуноглобулинов, но, напротив, ограничены в репертуаре распознаваемых антигенов, и эти антигены — наиболее распространённые соединения клеточных стенок бактерий. Все B-1-лимфоциты — как бы один не слишком специализированный, но определённо ориентированный (антибактериальный) клон. Антитела, продуцируемые B-1-лимфоцитами, почти исключительно IgM, переключение классов иммуноглобулинов в B-1-лимфоцитах не «предусмотрено». Таким образом, B-1-лимфоциты — «отряд» противобактериальных «пограничников» в прибарьерных полостях, предназначенных для быстрой реакции на «просачивающиеся» через барьеры инфекционные микроорганизмы из числа широко распространённых. В сыворотке крови здорового человека преобладающая часть иммуноглобулинов — продукт синтеза как раз B-1-лимфоцитов, т.е. это относительно полиспецифичные иммуноглобулины антибактериального назначения.
Примечания[править | править код]
- ↑ 1 2 3 Samitas K., Lötvall J., Bossios A. B cells: from early development to regulating allergic diseases // Arch Immunol Ther Exp (Warsz).. — 2010. — Т. 58, вып. 3. — С. 209—225. — doi:10.1007/s00005-010-0073-2. — PMID 20458549.
Литература[править | править код]
- А. Ройт, Дж. Брюсстофф, Д. Мейл. Иммунология — М.: Мир, 2000 — ISBN 5-03-003362-9
- Иммунология (в 3 т.) / Под. ред. У. Пола. — М.: Мир, 1988
См. также[править | править код]
- Иммунная система
- Гуморальный иммунитет
Врожденные лимфоидные клетки (КМО) представляют собой группа врожденных иммунных клеток , которые являются производной от общих лимфоидных клеток — предшественников (CLP) и принадлежат к лимфоидному . Эти клетки определяются отсутствием антиген — специфических В или Т — клеточного рецептора из — за отсутствия рекомбинации активации гена (КГР). КМО не выражают миелоидных или дендритных клеточных маркеров.
Эта относительно недавно описана группа клеток имеет различные физиологические функции; некоторые функции аналогичны хелперные Т — клетки , в то время как группа также включает цитотоксические NK — клетки . Соответственно, они играют важную роль в защитном иммунитете и регуляцию гомеостаза и воспаления , поэтому их дисрегуляция может привести к иммунной патологии , таким как аллергии , бронхиальная астма и аутоиммунные заболевания . Кроме того, они могут регулировать жировой функции и метаболического гомеостаза, в частности, выявляя beiging .
классификация
КМО можно разделить на основе цитокинов , которые они могут производить, и транскрипционных факторов , регулирующих их развитие и функционирование. Для каждой обнаруженной ветви семьи МКТА, будет важно , чтобы определить , является ли типом клеток устойчивой линии или просто этап дифференцировки или активации. Возникающие тело данных о факторах транскрипции и цитокины сигналах , которые дифференцируются ILCS способствует развивающейся системе классификации , используемой для идентификации ILCS.
В 2013 году номенклатура и система классификации была предложена, разделяющий известные КМО на три группы.
Группа 1 КМО
Группа 1 КМО конститутивно экспрессируют транскрипционный фактор Т-бет и способен производить Th1 цитокинов ( в частности , IFN & gamma ; и TNF ) после стимуляции с IL-12 или IL-18.
ILC1 клетки содержат NK-клетки, CD127low CD103 + интраэпителиальной ILC1s и CD127high ILC1s.
- ILC1s слабо цитотоксические клетки тесно связаны с 3 -й группе КМО, из которых они даже , как представляется, возникают. ILC1s аналогичны Т ч 1 клеток и разделяют общий фактор транскрипции Т-бет.
- Природные киллеры (NK «») клетки являются цитотоксическими врожденные эффекторные клеткианалогичные цитотоксических Т — клеток в адаптивной иммунной системы . Они распределенывсей крови, органов и лимфоидной ткани и составляют около 15% от периферической крови лимфоцитов . NKклетки играют роль в надзоре опухоли и быстрое устранение инфицированных вирусом клеток. Они не требуют недостающего «Я» сигнала MHC класса I и могут распознавать напряженные клетки в отсутствии антител,позволяет им реагировать гораздо быстреечем адаптивная иммунную система. NKклетки, обнаруженные в 1975 году, являются прототипическая врожденной лимфоидной клетки, и были описаны как больших гранулярных лимфоцитовкоторые испытывают недостаток рецепторов Тклеток.
Группа 2 КМО
Группа 2 КМО может производить типа 2 цитокины (например , IL-4 , IL-5 , IL-9 , IL-13 ).
ILC2s (также называемые естественные хелперы, nuocytes или врожденные клетки хелперов 2) играют решающую роль секретирующие 2 типа цитокины в ответ на гельминта инфекцию. Они также участвуют в развитии аллергического воспаления легких. Они выражают характерные поверхностные маркеры и рецепторы хемокинов , которые участвуют в распределении лимфоидных клеток на специфических сайтах органов. Они требуют IL-7 для их развития, который активирует два транскрипционных факторов (как требуется этими клетками) — RORα и GATA3 . После стимуляции Th2 цитокинов поляризационных (напримерИЛ-25, ИЛ-33, TSLP) ILC2s начинают производить IL-5, IL-13, IL-9, IL-4. ILC2s имеют решающее значение для первичной реакции на местные антигены Th2напримергельминтов и вирусыи поэтому ILC2s обильны в тканях кожи, легких, печени и кишечнике.
У мышей, ILC2s может регулировать жировой функцию и метаболического гомеостаза , в частности с помощью производства энкефалина пептидов , которые вызывают beiging .
Группа 3 КМО
Группа 3 КМО определяются их способностью продуцировать цитокины IL-17A и / или IL-22 . Они являются врожденным аналогом T H 17 клеток, и разделить общий фактор транскрипции RORγt . Они включают в себя ILC3s и ткани-индуктора (LTI) клеток лимфоидных:
- ILC3s является лимфоидной популяцией клетокчто может привестиIL-22 и выражает NKp46 (ые NK — клетки активации рецептора ). Тем не менее, ILC отличаются от клеток NK,как они зависят от фактора транскрипции RORγt , они испытывают недостатокцитотоксические эффекторы ( перфорина , Гранзимы и рецепторы смерти )и они не производят IFN-или TNF. Они находятсяосновном в слизистой ткани и особенно в желудочно — кишечном тракте .
- Лимфоидная ткань индуктор ( «LTi») клетка лимфоидной ткани индуктор клетка является подмножеством врожденных лимфоидных клетокпринадлежащих к лимфоидному из кроветворного происхождения. Они представлены эмбриональных тканей индуктора клеток lymhoid, которые имеют основную роль в первичной и вторичной организации лимфоидной ткани, авзрослых лимфоидных тканей индуктора клеток, регулирующих адаптивный иммунный ответ и поддержание вторичной структуры lymhoid ткани.
Характеристика клеток LTi
LTi являются клетками положительной для IL — 7 + CD45 + CD4 + и отрицательных для CD3 маркеров , выражающих LTαβ. Кроме того, они выражают TNF-связанные активации индуцированной хемокин ( TRANCE ), фактор некроза опухоли Надсемейство Член 14 ( TNFSF14 , также известный как свет) и фактор некроза опухоли альфа ( TNF — alpha ), которые все являются лигандами фактора некроза опухоли (ФНО) семьи. Они также выражают рецепторы хемокинов, таких как СХС типа рецепторов хемокинов 5 ( CXCR5 ), CXC типа рецепторов хемокинов 7 ( CXCR7 ) и молекул адгезии очень позднего антигена-4 (VLA-4 , также известный как интегрина α4β1), интегрина α4β7 и межклеточных Молекула адгезии 1 ( ICAM-1 ). Кроме того, LTis являются позитивными для CD25 , CD44 , CD90 , CD117 , CD122 , CD132 маркеров.
Генерация клеток LTi
LTi клетки являются очень ранние гемопоэтические клетки колонизируют лимфоидную Anlagen узла, селезенки и эмбриональной кишки, индуцированного пейеровых бляшек и носовой лимфоидной ткани. Они получены из IL-7Rα + клеток-предшественников печени плода. LTi клетки вызывают развитие вторичного лимфоидного органа ANLAGEN через взаимодействие с LTβR выражаясь мезенхимными клетками. Присутствие фактора транскрипции Ikaros и белок Id2 (член семьи Id) является необходимым условием для дифференциации клеток-предшественников в клетки CD45 + CD4 + CD3- LTi. Еще одна молекулы требуется для генерации LTi является ядерной ретиноевой кислотой, связанными с сиротоями-рецептор RORγt. TRANCE-R, вызывая приводит к повышенной экспрессии LTαβ на клетках LTi. Передача сигналов с помощью IL-7R или через TRANCE-R имеют важное значение для intiatiot поверхности LTαβ экспрессии в клетках LTi.
развитие
CLPS или общие лимфоидные предшественники обладают способностью к дифференцировке в ряде различных типов клеток , в том числе Т — клетки, В — клетки и КМО, в зависимости от клеточных сигналов , присутствующих. За исключением клеток NK, все КМО требуют IL-7 сигнализации для выживания. Транскрипционный репрессор ID2 , как представляется , противодействуют В и Т — клеток дифференциации , приводит к получению ID2-зависимого предшественника , который может дополнительно дифференцировать с линии дифференцировки специфических факторов транскрипции. Существует доказательство того, что различные ветви КМО разделяют общий предшественник. Выемка сигнализация может также быть вовлечена в начальной дифференциации к общему ILC предшественнику. Развитие КМО не до конца понятен. ILC3s могут быть необходимыми предшественниками ILC1s.
функция
КМО являются многофункциональная группа клеток. Их способность быстро секретируют иммунорегуляторных цитокинов позволяет им вносить свой вклад на ранних стадиях иммунного ответа на инфекцию. Они часто находятся на поверхности слизистой оболочки , где они подвергаются инфекционных агентов в окружающей среде.
гельминтами инфекции
ILC2 клетка играет важную роль в защите от глистной инфекции. Они являются основным источником раннего IL-13 , который может активировать Т — клетки и индуцируют физиологические реакции , которые помогут изгнать паразитов. Эти физиологические реакции включают стимулирующую бокаловидную клетки секрецию слизи и сокращение гладкой мускулатуры. Кроме того, они выделяют сигналы , которые вербуют и активируют тучные клетки и эозинофилы , и которые стимулируют пролиферацию В — клеток. Они также секретируют Амфирегулин , член семейства эпидермальных факторов роста, который стимулирует восстановление тканей. Это может функционировать для повышения барьерной функции эпителия и медленного входа патогена.
Кишечные патогены
В среде желудочно — кишечного тракта, ILC3s играют решающую роль в обеспечении баланса между симбиотической микрофлорой и кишечной иммунной системы . В ответ на воспалительные сигналы от dendridic клеток и эпителия кишечника, они производят IL-22 , которые увеличивают производство антимикробных пептидов и дефенсинов. ILC3s также помочь в иммунной реакции на внеклеточные бактерий путем поддержания гомеостаза эпителии . Поэтому, когда появляется неисправность, эти клетки могут участвовать в развитии воспалительных заболеваний кишечника (IBD).
Опухоль наблюдения
Различные группы врожденных лимфоидных клеток имеют способность влиять туморогенез несколько способов.
ILC1 являются основным населением ILC с анти-онкогенного потенциала. Лучший разведанным ILC1 являются NK — клетки. Их функция регулируются с помощью сигналов от стимулирующих и тормозных рецепторов. NK — клетки обладают способностью распознавать недостающую MHC класса I на клетки опухоли. Таким образом, они действуют в взаимодополняющем образе с цитотоксическим Т — клетками , которые распознают и уничтожают клетку опухоли , которые представляют чужеродный антиген на МНС класс I. NK — клетках экспрессируют ряд клеточной поверхности активирующего рецепторы NK — клеток со специфичностью для напряжений индуцированных лигандов суперэкспрессированных на клетки опухоли. В организме человека, рецептор NKG2D распознает ULBP 1-6 и MICA , MICB и RAET1E , тогда как у мышей , он связывает RAE1 молекулу семьи, H60 молекулы семьи и mult1 белок. Другое семейство рецепторов , активирующих клеток NK являются NCRs (естественная цитотоксичность рецепторов), DNAM1 (DNAX Аксессуар Молекула-1 CD266 ) и CD16 (опосредуют ADCC после связывания опухоли специфического антитела на опухолевого антигена).
ILC1 микроокружение опухоли влияние на производство нескольких цитокинов , например , IFNg и TNF & alpha ;, которые в начале иммунного ответа поляризовать другие иммунные клетки в воспалительном фенотип, например , макрофаги M1 . ILC1 также вербовать DC и клетки цитотоксического Т . С другой стороны, IFN и TNF г игра важную роль в индукции иммуносупрессивной фенотипа иммунных клеток или MDSC, производство противовоспалительных цитокинов и образование метастазов.
Другие ILC популяции также влияют на опухолевую микросреду.
ILC2 продуцируют цитокины , которые способствуют противовоспалительный иммунный ответ , например , IL-13, IL-4, Амфирегулин. Однако, в некоторых ситуациях ILC2 производят IL-5 и способствовать цитотоксической реакции эозинофилов и противоопухолевой реакции и подавления метастазирования.
ILC3 участвуют в воспалении , связанных с онкогенеза производством IL-17, IL-22, IL-23 цитокинов. Это микроокружение приводит к развитию опухоли и прогрессии и способствует для лучшего выживания раковых клеток.
метаболизм
Исследования определили ILC2s в жировой ткани , как фактор развития ожирения у мышей. ILC2s имеют решающее значение в энергетическом гомеостазе, производя метионин-энкефалина пептиды в ответ на IL-33 . Эта продукция способствует появлению бежевых адипоцитов в белой жировой ткани. Процесс beiging приводит к увеличению расхода энергии и снижение ожирению.
патология
Аллергии и астмы
ILC2s играет различные роли в аллергии . В первую очередь, они обеспечивают источник 2 типа цитокинов , которые Orchestrate аллергический иммунный ответ. Они производят профиль сигналов в ответ на про-аллергенных цитокинов ИЛ-25 и ИЛ-33 , который подобен тем , которые получают в ответ на глистной инфекции. Их вклад в эту сигнализацию , как представляется, сравнима с Т — клетками. В ответ на аллергена экспозиции в легких, ILC2s производства ИЛ-13, необходимым цитокина в патогенезе аллергических реакций. Этот ответ , как представляется, не зависит от Т и В — клеток. Кроме того, аллергические реакции , которые напоминают астму-подобные симптомы были вызваны у мышей , которые не имеют Т- и В — клетки с использованием IL-33. Кроме того , было обнаружено , что ILC2s присутствуют в более высоких концентрациях в тканях , где аллергические симптомы присутствуют, например, в носовых полипов у пациентов с хроническим риносинуситом и кожи от пациентов с атопическим дерматитом .
Аутоиммунное заболевание
NK — клетки экспрессируют множество рецепторов на поверхности клеток , которые могут быть активирующими, ингибирующими, адгезия, цитокин или хемотактическими. Интеграции информации , собранной с помощью этих многочисленных входов позволяет NK — клетки поддерживать аутотолерантность и распознавать сигналы напряжения собственной ячейки. Если нюансы, динамическое регулирование активации NK — клеток становится несбалансированным в пользу атакующего самостоятельно клеток, аутоиммунные патологии заболевания. Клетки дисрегуляция НК участвует в ряде аутоиммунных расстройств , включая рассеянный склероз , системную красную волчанку , и сахарный диабет типа I. .
Врожденное или адаптивная
Исторически сложилось, что различие между врожденной и адаптивной иммунной системы сосредоточены на неспецифической природы врожденной системы и отсутствие памяти. Так как информация возникла о функциях клеток NK и других КМЫ как эффекторы и оркестраторы адаптивного иммунного ответа, это различие становится менее четким. Некоторые исследователи предполагают , что определение должно уделять больше внимания зародышевого кодирования рецепторов в врожденной иммунной системе по отношению к перестроенным рецепторам адаптивной иммунной системы.
Рекомендации
Смотрите также
- Врожденная иммунная система
- NK клеток
